Патобіологія гострого панкреатиту: орієнтація на внутрішньоклітинний кальцій і кальмодулін
Оле Х. Петерсен
MRC Group, Кардіфська школа біологічних наук, Кардіфський університет, Будівля біомедичних наук, Музейний проспект, Кардіфф, CF10 3AX, Великобританія
Анотація
Екзокринна підшлункова залоза синтезує всі ферменти, необхідні для розщеплення в кишечнику білків, жирів та вуглеводів у нашому раціоні. На жаль, протеази, необхідні для перетравлення м’яса, яке ми їмо, можуть, якщо їх неналежним чином активувати всередині ацинарних клітин, також перетравлювати саму підшлункову залозу, а також навколишні тканини, що трапляється при інколи летальному захворюванні людини на гострий панкреатит. В даний час хвороба не піддається лікуванню, але останнім часом було досягнуто значного прогресу у розумінні основних процесів, що ініціюють патологічні зміни, що лежать в основі автоперетравлення підшлункової залози. Зараз стало зрозуміло, що активація внутрішньоклітинного трипсину - вирішальний етап у патогенезі - зумовлена надмірним викидом Са 2+ із внутрішньоклітинних запасів, головним чином через два типи рецепторів інозитолу трисфосфату. Несподіване нещодавнє відкриття внутрішнього захисного механізму, спричиненого внутрішньоклітинним кальмодуліном, і, зокрема, виявлення того, що цей захисний ефект може бути посилений мембранопроникним Ca 2+-подібним пептидом.
Вступ та контекст
Існує загальна думка, що активація внутрішньоклітинної протеази є вирішальним початковим етапом і що цей процес залежить від значного вивільнення Са 2+ із внутрішніх запасів з подальшим надходженням Са 2+ із позаклітинного простору. Зрозуміло також, що початкова біохімічна подія, а саме активація протеази, відбувається одночасно з і, певним чином, пов’язана з внутрішньоклітинною вакуолізацією; тобто перетворення гранул зимогену (електронно-щільні секреторні пухирці, що містять профермент) у порожні на вигляд вакуолі. Вакуолізація, як і активація протеази, є процесом, що залежить від Ca 2+. Демонстрація того, що активація трипсину була розпочата в постекзоцитозних, ендоцитарних вакуолях, стала вирішальним знахідкою, що пов'язує активацію та вакуолізацію протеази (трипсину) [6].
Фізіологічне сполучення стимул-секреція та патологічне подразнення – активація протеази
Ще одним дуже важливим аспектом, який слід враховувати щодо патогенезу, є виробництво енергії. Повторювані цитозольні спайки Са 2+ викликають неодноразові стрибки підвищення мітохондріального [Са 2+], що, в свою чергу, активує дегідрогенази циклу Кребса, залежні від Са 2+, генеруючи продукцію АТФ в мітохондріях. На відміну від цього, стійке підвищення рівня цитозолю [Ca 2+] викликає лише один початковий сплеск підвищення рівня [Ca 2+] мітохондрій, а отже, лише один перехідний період генерації АТФ [7]. Оскільки АТФ необхідний для секреторного процесу, це, безсумнівно, є однією з причин відсутності секреції протеази на високих (нефізіологічних) рівнях стимуляції, а також при гострому панкреатиті.
Жовчні кислоти викликають гострий панкреатит
Частою причиною гострого панкреатиту є камені в жовчному міхурі, які, як вважають, викликають захворювання, перекриваючи протоку підшлункової залози або перешкоджаючи загальному (жовчно-панкреатичному) каналу. Цей останній механізм дозволить рефлюксу жовчі у підшлункову залозу та спричинить пошкодження підшлункової залози, хоча значення цього конкретного механізму вже обговорювалося [9]. У будь-якому випадку було показано, що опосередковане транспортером поглинання жовчних кислот спричиняє загибель клітин, залежних від Ca 2+, у ацинарних клітинах підшлункової залози in vitro [10]. Основним ефектом внутрішньоклітинних жовчних кислот є вивільнення Са 2+ як з ендоплазматичного ретикулуму, так і з запасів кислоти в апікальній зернистій області шляхом активації трифосфату інозитолу (IP3) та ріанодінових рецепторів (внутрішньоклітинні кальцієві канали) [11], викликаючи або апоптоз, або некроз. Внутрішньоклітинний рівень АТФ видається вирішальним для визначення того, який тип загибелі клітин відбувається. Це можна продемонструвати в експериментах з цільноклітинною фіксацією пластирних затискачів (де внутрішня частина клітини безпосередньо контактує з великим об’ємом розчину піпетки), які показують, що наявність АТФ у розчині призводить до жовчних кислот, що викликають апоптоз на відміну від некрозу [12].
Алкоголь: Чи небезпечно це для підшлункової залози?
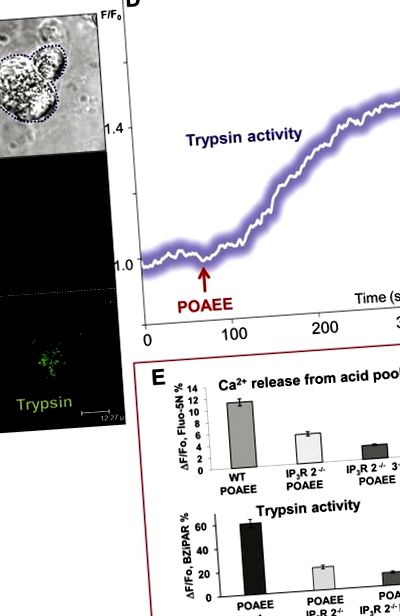
Рівень активності трипсину корелюється зі ступенем вивільнення Са 2+ із запасів кислоти в зернистому верхівковому полюсі через рецептори інозитолтрифосфату (IP3) типів 2 і 3. (A) Передане світле зображення, що показує дві ацинарні клітини. Ліва клітина була профомебілізована двофотонами. (B) та (C.) Показ флуоресцентних зображень (в C.) початкова локалізація активності трипсину після стимуляції POAEE (зонд BZiPAR стає флуоресцентним, коли трипсин розщеплює два бічні ланцюги олігопептиду). (B) До і (C.) після початку стимуляції POAEE (100 мкМ). (D) Часовий хід збільшення внутрішньоклітинної активності трипсину після початку стимуляції 100 мкМ POAEE. (Е) Результати експериментів, в яких вивільнення Са 2+ із кислотного зернистого полюса пермеабілізованих клітин та активацію трипсину у мишей дикого типу (WT) порівнювали з результатами мишей, у яких були видалені рецептори IP3 типу 2 (IP3R 2 -/- ) та від мишей, у яких були видалені рецептори IP3 типу 2 та 3 (IP3R 2 -/- 3 -/-). Адаптовано за Герасименком та ін., 2009 [13].
Підводячи підсумок, хоча сам алкоголь (етанол) здебільшого має лише незначний гострий вплив на ацинарні клітини підшлункової залози, існує меншість клітин, які виробляють великі стійкі сигнали Ca 2+ під впливом етанолу [6]. Останні дані показують, що хоча етанол здатний викликати викид значної кількості Са 2+ з внутрішньоклітинних запасів, нормальні інтактні клітини мають вбудований захисний механізм, про який йдеться нижче [16] (рис. 2).
(A) Типові сліди двох експериментів, в яких оцінювали зміни в запасі [Ca 2+] після стимуляції етанолом. За відсутності CaM 10 мМ етанолу (EtOH) викликає явне зменшення запасу [Ca 2+], тоді як ця концентрація етанолу не викликає жодного виділення при додаванні CaM (2,5 мкМ) до зовнішнього розчину (при безпосередньому контакті з внутрішньоклітинний розчин через пору, утворену двофотонною пермеабілізацією). Значно вища концентрація етанолу (100 мМ) все ще може викликати викид Ca 2+. (B) СаМ інгібує індуковану етанолом активацію трипсину способом, дуже подібним до його захисного ефекту проти внутрішньоклітинного вивільнення Са 2+. Крім того, найнижчі сліди демонструють, що Ca 2+ -подібний пептид CALP-3 - у присутності CaM - скасовує активуючий трипсин ефект навіть дуже високої концентрації етанолу (100 мМ). Адаптовано за Герасименком та ін., 2011 [16].
Активація всюдисущого кальцієзв’язуючого білка кальмодулін захищає від внутрішньоклітинного вивільнення Са 2+, викликаного алкоголем, і активації трипсину
Недавнє розуміння пролило світло на те, як можна запобігти алкогольному викиду Ca 2+. Було встановлено, що коли кальцій, що зв’язує Са 2+, кальмодулін вимивається з клітин, сам алкоголь має сильну і гостру токсичну дію на ацинарні клітини. Повторний прийом кальмодуліну (при нормальній внутрішньоклітинній концентрації) має захисний ефект. Особливо захоплює той факт, що останні дані показують, що мембранопроникний малий пептидний активатор кальмодуліну (Ca 2+-подібний пептид, відомий як CALP-3), коли додається зовні ізольованих клітин, запобігає токсичним діям навіть дуже високих концентрації алкоголю [16] (рис. 2), оскільки це свідчить про те, що він може мати потенціал як терапевтичний засіб для зменшення алкогольного пошкодження підшлункової залози.
Шляхи загибелі клітин
Панкреатит характеризується загибеллю клітин, але прогноз багато в чому залежить від того, який процес загибелі клітин відбувається [17,18]. Апоптоз є «фізіологічним» механізмом загибелі клітин і відбувається без втрати цілісності плазматичної мембрани, тоді як некроз призводить до втрати клітинних компонентів до інтерстиціальної рідини, сприяючи запаленню. Апоптоз вимагає енергії у формі АТФ, тому, якщо функція мітохондрій помітно порушена повною деполяризацією внутрішньої мітохондріальної мембрани, єдиним доступним механізмом загибелі клітин є некроз (рис.3).
Стрілки внизу на малюнку, позначені + ATP та –ATP, вказують на те, що баланс між апоптозом та некрозом певною мірою диктується наявністю або відсутністю ATP. Δψm, різниця електричних потенціалів у внутрішній мітохондріальній мембрані; CCK, холецистокінін; ЕР, ендоплазматичний ретикулум; FAEE, етиловий ефір жирних кислот; АФК, активні форми кисню, ZG, гранула зимогену. Адаптовано з Criddle et al., 2007 [17].
Потенційні терапевтичні шляхи
Висновки
На закінчення, основними моментами, які випливали з останніх досягнень у цій галузі, є: (a) надмірне навантаження цитозольної Ca 2+ ініціює внутрішньоклітинну активацію протеази, що призводить до гострого панкреатиту; (b) надмірне надходження Ca 2+ в цитозоль в першу чергу і головним чином обумовлено вивільненням Ca 2+ із запасів кислоти Ca 2+ у гранульованій частині ацинарних клітин, опосередкованих через IP3 рецептори типів 2 і 3; (c) внутрішньоклітинний зв'язуючий Са 2+ білок, кальмодулін, надає захисну дію проти пов'язаного з алкоголем панкреатиту, зменшуючи ймовірність відкриття каналів рецепторів IP3; і (d) активація кальмодуліну мембранопроникним Ca 2+-подібним пептидом посилює захисний ефект кальмодуліну проти алкогольно-індукованої внутрішньоклітинної активації протеази. Сподіваємось, зрозумівши більше про етіологію цієї хвороби, ми наблизимось до забезпечення кращих профілактичних та терапевтичних методів для полегшення страждань постраждалих від цього стану.
Подяка
Експериментальна робота в лабораторії авторів була підтримана Програмою від Ради медичних досліджень (Великобританія). OHP - професор Ради з медичних досліджень.
- Лікарі-гастроентерологи Саут-Бенда - Гострі та хронічні симптоми панкреатиту, лікування, причини
- Ожиріння є фактором ризику важкого гострого жовчного та алкогольного панкреатиту - PubMed
- Ожиріння є фактором ризику гострої гірської хвороби, проспективне дослідження на залізниці в Тибеті
- Некротизуючий панкреатит Радіологія Довідкова стаття
- Післяпологова гостра жирова печінка вагітності звіт про випадок Повний текст журналу Medical Case Reports