Ортореовіруси ссавців кажанів викликають важку пневмонію у мишей
Рен-Ді Цзян
Ключова лабораторія CAS спеціальних патогенів та біобезпеки, Інститут вірусології Ухані, Китайська академія наук, Ухань, Китай
b Університет Китайської академії наук, Пекін, Китай
Бей Лі
Ключова лабораторія CAS спеціальних патогенів та біобезпеки, Інститут вірусології Ухані, Китайська академія наук, Ухань, Китай
Сян-Лін Лю
Ключова лабораторія CAS спеціальних патогенів та біобезпеки, Інститут вірусології Ухані, Китайська академія наук, Ухань, Китай
Мей-Цінь Лю
Ключова лабораторія CAS спеціальних патогенів та біобезпеки, Інститут вірусології Ухані, Китайська академія наук, Ухань, Китай
b Університет Китайської академії наук, Пекін, Китай
Цзин Чень
Ключова лабораторія CAS спеціальних патогенів та біобезпеки, Інститут вірусології Ухані, Китайська академія наук, Ухань, Китай
b Університет Китайської академії наук, Пекін, Китай
Донг-Шен Ло
Ключова лабораторія CAS спеціальних патогенів та біобезпеки, Інститут вірусології Ухані, Китайська академія наук, Ухань, Китай
b Університет Китайської академії наук, Пекін, Китай
Бінг-Цзе Ху
Ключова лабораторія CAS спеціальних патогенів та біобезпеки, Інститут вірусології Ухані, Китайська академія наук, Ухань, Китай
b Університет Китайської академії наук, Пекін, Китай
Вей Чжан
Ключова лабораторія CAS спеціальних патогенів та біобезпеки, Інститут вірусології Ухані, Китайська академія наук, Ухань, Китай
Ши-Юе Лі
c Університет Ухань, Ухань, Китай
Сін-Лу Ян
Ключова лабораторія CAS спеціальних патогенів та біобезпеки, Інститут вірусології Ухані, Китайська академія наук, Ухань, Китай
Чжен-Лі Ши
Ключова лабораторія CAS спеціальних патогенів та біобезпеки, Інститут вірусології Ухані, Китайська академія наук, Ухань, Китай
Пов’язані дані
Анотація
Інфекції ортореовірусів ссавців (MRV) повсюдні у ссавців. Збільшення доказів свідчить про те, що деякі MRV можуть спричинити важкі респіраторні захворювання та енцефаліт у людей та інших тварин. Раніше ми виділили шість штамів MRV кажанів. Однак патогенність цих вірусів кажанів залишається незрозумілою. У цьому дослідженні ми досліджували діапазон хазяїна та патогенність 3 штамів MRV-кажанів (WIV2, 3 та 7), які представляють три серотипи. Наші результати показали, що всі вони можуть інфікувати клітинні лінії різних видів ссавців і демонструють різну ефективність реплікації. Миші BALB/c, інфіковані MRVs кажанів, виявляли клінічні симптоми із систематичним зараженням, особливо в легенях та кишечнику. Очевидне пошкодження тканин було виявлено у всіх заражених легенях. Один із штамів, WIV7, продемонстрував вищу ефективність реплікації in vitro та vivo та більш серйозний патогенез у мишей. Наші результати дають нові докази, що свідчать про потенційну патогенність MRV у кажанів у тварин та ймовірний ризик для людей.
1. Вступ
Ортореовіруси ссавців (MRV) належать до роду Orthoreorivus сімейства Reoviridae з десятьма сегментованими дволанцюжковими генами РНК (Day, 2009; Мер та ін., 1965). MRV є прототипом реовірусу, і чотири серотипи були визначені відповідно до реакції нейтралізації сироватки проти MRV та здатності інгібувати гемаглютинацію (Attoui et al., 2001; Rosen, 1960; Sabin, 1959; Vasquez and Tournier, 1962) . Вони широко поширені по всьому світу. Інфекційні вірусні частинки можна виявити у річковій воді та сирих стічних водах (Matsuura et al., 1988, 1993). З моменту свого відкриття людські MRV неодноразово виділяли із зразків дихальних та кишкових шляхів у дітей. Незважаючи на те, що вони зазвичай спричиняють слабкі респіраторні/шлунково-кишкові симптоми або безсимптомні захворювання (El-Rai and Evans, 1963; Leers and Rozee, 1966; Sabin, 1959), нещодавно були зареєстровані випадки у людей, що показує, що MRV відповідають за важку пневмонію та енцефаліт (Ouattara et al., 2011; Steyer et al., 2013; Tyler et al., 2004).
Кажани - єдині літаючі ссавці, що мають понад 50 мільйонів років еволюційної історії (Teeling et al., 2005). Кажани добре відомі як природні резервуари деяких важливих патогенів людини, таких як важкий гострий респіраторний синдром коронавірусу (SARS-CoV), вірус Марбурга та вірус Nipah (Botvinkin et al., 2003; Chua et al., 2002; Ge et al., 2013; Leroy et al., 2005; Yang et al., 2015a). Ортореовіруси були виявлені у кажанів у всьому світі (Jansen van Vuren et al., 2016; Lelli et al., 2015; Lorusso et al., 2015; Yang et al., 2015b). Відомі ортореовіруси кажанів в основному поділяються на 2 групи, ортореовіруси птеропіну (PRV) та MRVs кажанів (Kohl et al., 2012; Lelli et al., 2013; Li et al., 2016). Підозрюється, що деякі PRV, такі як вірус Мелака та вірус Кампар, ізольовані від кажанів, відповідають за захворювання людей (Chua et al., 2007, 2008). Проведено деякі дослідження щодо патології PRV та MRV кажанів, виділених від інших ссавців (Egawa et al., 2017; Kanai et al., 2018; Li et al., 2015). Однак патогенність MRV для кажанів у людей та тварин залишається незрозумілою.
Раніше ми виділили 6 штамів MRV із фекалій кажанів та зразків сечі (Yang et al., 2015b), і їх геномні послідовності мають високу схожість із ізолятами хворих норок, поросят або дітей (Dai et al., 2012; Lian et al ., 2013; Ouattara et al., 2011). Ці MRV, що належать до кажанів, належать до ортореовірусів ссавців серотипу 1, 2 або 3. Однак їх патогенність та потенціал міжвидової передачі не аналізовані. У цьому дослідженні ми відібрали кожен із 3 серотипів та оцінили діапазон їх хазяїв у різних клітинних лініях та патогенезі у мишей.
2. Матеріали та методи
2.1. Заява про етику
З усіма тваринами, інфікованими MRVs з кажанами, обробляли засоби для тварин з рівня біобезпеки відповідно до рекомендацій з догляду та використання Інституційної комісії з огляду Інституту вірусології Уханю Китайської академії наук (етичний номер WIVA05201401). Мишам прищеплювали вірус під відповідною анестезією, і всі зусилля були зроблені, щоб мінімізувати будь-який потенційний біль та дистрес.
2.2. Віруси та клітинні лінії
Кажани MRV-WIV2, WIV3 та WIV7, що представляють серотип 1, 2 та 3, відповідно, були виділені із зразків кажанів, як описано раніше (Yang et al., 2015b). Всі віруси розмножувались та титрувались у клітинах нирок африканської зеленої мавпи (Vero E6) (ATCC CRL-1586). Надосадову рідину вірусу послідовно розводили у модифікованому Дульбекко середовищі Eagle (DMEM) (Gibco, Waltham, USA) і додавали до клітин Vero E6, висіяних у 96-лункову платівку. Через 1 год інкубації супернатант видаляли і додавали DMEM, доповнений 2% фетальною бичачою сироваткою (FBS) (Gibco, Waltham, USA). Пластини спостерігали щодня протягом 5–7 днів для відстеження розвитку цитопатичного ефекту (CPE). Середню інфекційну дозу культури тканин (TCID50) розраховували за формулою Ріда-Муенча.
Нирки Myotis ricketti (MdKi), клітини легенів Hipposideros pratti (HpLuT) та клітини нирок Pteropus alecto (PaKi) вирощували в модифікованій суміші Dulbecco Eagle Medium/Nutrient Mixed F-12 (DMEM/F-12) (Gibco, Waltham, USA) з 10% FBS при 37 ° C і 5% CO2. Клітини альвеолярного базального епітелію людини A549 (ATCC CCL-185), клітини шийки матки людини Hela (ATCC CCL-2), клітини нирок мавпи LLC-MK2 (ATCC CCL-7), клітини котячих нирок FK (ATCC CCL-94) та Madin- Клітини нирок Darby собак MDCK (ATCC CCL-34) вирощували в DMEM з додаванням 10% FBS при 37 ° C і 5% CO2.
2.3. Клітинний тест на тропізм
Клітини висівали в 24 лунки за 1 день до цього та заражали вірусом при множинності інфекції (MOI = 1) (Ge et al., 2013). Через 24 години зараження клітини промивали забуференним фосфатом фізіологічним розчином (PBS), фіксували 4% параформальдегідом і пронизували 0,1% Triton X-100. Пермеабілізовані клітини блокували бичачим сироватковим альбуміном (BSA) (Sangon Biotech, Шанхай, Китай), а потім інкубували з первинними антитілами (кролячі анти-WIV3 поліклональні антитіла). Клітини промивали PBS і фарбували міченим флюоресцеїном ізотіоціанатом (FITC) мишачим анти-кролячим вторинним антитілом (PTGLab, Роузмонт, США) та 4 ', 6-діамідино-2-феніліндол, дигідрохлоридом (DAPI) (Roche, Basel, Швейцарія). Зображення були отримані за допомогою конфокального мікроскопа FV1200 (Олімп, Токіо, Японія). Криву росту визначали методом зворотної транскрипції полімеразної ланцюгової реакції (RT-qPCR), описаною нижче. Коротко кажучи, 200 мкл супернатанту культури клітин було зібрано через 0, 12, 24, 48 та 72 год після зараження (hpi) із засіяних клітин відповідно. Виділяли вірусну РНК і проводили RT-qPCR для визначення вірусного навантаження.
2.4. Експерименти з зараженням тварин
Чотири тижні самок мишей BALB/c (Лабораторний центр тварин Інституту вірусології Ухань, CAS) знеболювали 250 мг/кг авердину (Sigma-Aldrich, Сент-Луїс, США) перед тим, як тваринам інтраназально прищеплювали 10 5 TCID50 з WIV2, WIV3, WIV7 або DMEM як імітаційний контроль. Клінічні симптоми та масу тіла контролювали щодня до 21 дня. Реплікацію вірусу та патогенез визначали на тканинах, зібраних у мишей, на 1, 3, 5, 7, 10, 14 та 21 день після зараження (dpi). Зразки сироватки крові відокремлювали від цільної крові згортанням при 37 ° С протягом 1 год і центрифугуванням при 3000 × g протягом 10 хв.
2.5. Гістопатологія та імуногістохімія (IHC)
Зібрані тканини розрізали та використовували для фарбування гематоксиліном та еозином (H&E) та IHC для виявлення антигену MRV. Для IHC зрізані парафіном тканинні зрізи поміщали в антиген-репараційний буфер для вилучення антигену в мікрохвильовій печі. Зрізи поміщали в 3% розчин перекису водню та інкубували зі світлом, щоб блокувати ендогенну пероксидазу. Тканину рівномірно покривали 3% BSA та інкубували при кімнатній температурі. Первинне антитіло (кроляче анти-WIV 3 поліклональне антитіло) по краплях додавали до зрізів і потім промивали в PBS. Після злегка висушування зрізів тканини покривали пероксидазою хрону (HRP), міченою проти кролячого імуноглобуліну G (IgG, Proteintech, Rosemont, USA). Після промивання в PBS додавали свіжоприготований розчин 3,3'-діамінобензидину (DAB), а потім ядра інкубували з гематоксиліном. Інформація про зображення була зібрана за допомогою системи Pannoramic MIDI (3DHISTECH, Будапешт, Угорщина).
2.6. Визначення реплікації вірусу in vivo
2.7. Експресія генів, пов’язаних з цитокінами
Гомогенізовані легені готували, як описано раніше. Сто мікролітрів суспензії використовували для вилучення мРНК господаря за допомогою набору RNAprep Pure Cell/Bacteria Kit (TIANGEN, Пекін, Китай). Відносну RT-qPCR проводили, як було описано раніше (Zeng et al., 2016). Послідовності праймерів використовували для ампліфікації генів-мішеней (Додаткова таблиця S1). РНК РНК 18-х років використовували як ендогенний контроль для нормалізації надходження кДНК. Експресію гена, пов'язану з цитокінами, визначали за допомогою програмного забезпечення StepOne.
2.8. Статистичний аналіз
Статистичний аналіз проводили за допомогою PRISM ™ 5.01 для Windows (GraphPad, Сан-Дієго, США). Значущі відмінності між групами визначали за допомогою двостороннього дисперсійного аналізу (ANOVA).
3. Результат
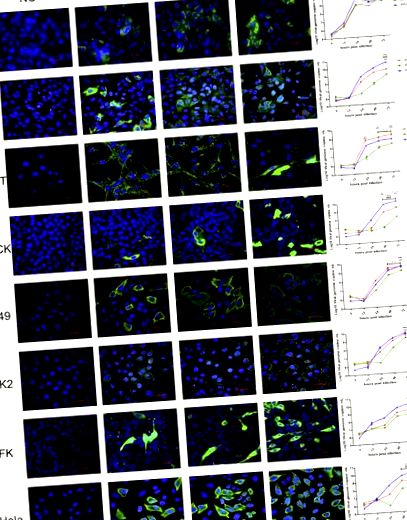
3.1. MRV для кажанів демонстрували ширококлітинний тропізм in vitro
Усі клітинні лінії, включаючи людину, мавпу, собаку, кота та кажана, були сприйнятливі до 3 MRVs для кажанів. Кінетика росту показала, що 3 віруси мають різну ефективність реплікації (рис. 1). WIV7 показав найвищу ефективність реплікації в 6 з 8 перевірених клітинних ліній. WIV2 реплікувався краще, ніж WIV3, у всіх тестованих клітинних лініях.
Зміна маси тіла після вірусної інфекції. Чотиритижневі самки мишей BALB/c були інфіковані 10 5 TCID50 кажаном MRV WIV2, WIV3 або WIV7 через внутрішній канал. Вагу тіла вимірювали через 0, 1, 2, 3, 4, 5, 6, 7, 10, 14 і 21 день після зараження. Панель помилок вказує на стандартну помилку. ** P Рис. 3, Додаткова Рис. S2). Всі ці штами викликають системну інфекцію у мишей. Віруси добре розмножуються в легенях, селезінці, печінці та кишечнику. Найвище вірусне навантаження спостерігалося в легенях для всіх штамів, за якими слідували кишечник. WIV2 реплікувався краще, ніж WIV3, у всіх тестованих клітинних лініях, але він не виявлявся в мозку, на відміну від WIV3 був виявлений з 10-го дня до кінцевої точки. WIV7 показав вищу ефективність реплікації у мишей, ніж інші 2 штами, виявляючи більш високе вірусне навантаження та довшу стійкість інфекції в більшості перевірених органів, особливо в мозку. Низький рівень віремії був виявлений лише у сироватці мишей, інфікованої WIV7, між 3 і 7 dpi (Додаткова таблиця S2).
Вірусне навантаження РНК в тканинах легенів та мозку після зараження MRV кажаном. Легені та мозок інфікованих мишей BALB/c при 1, 3, 5, 7, 10, 14 та 21 dpi були виявлені на вірусне навантаження РНК. WIV2, WIV3 та WIV7 демонструють різну ефективність зараження у мишей BALB/c. N = 3 у кожній точці часу. Панель помилок вказує на стандартну помилку. Чорне підкреслення представляє порівняння між зазначеними групами, * P Рис. 4 A та E, Supplemenaty Fig. S1). Очевидні пошкодження тканин та запалення були виявлені у всіх інфікованих відділах легенів. Легкі, інфіковані WIV2 та WIV3, демонстрували різну альвеолярну товщину та з деякою лімфоцитарною інфільтрацією навколо судин (рис. 4 B, C Додатковий рис. S1). У інфікованих WIV7 мишей структура альвеол значно зменшилася в легенях і виявила більше лімфоцитарної інфільтрації в інтерстиціальній тканині (рис. 4 D). Ніяких відмінностей не спостерігалося в інших тканинах порівняно з контрольною групою для всіх тестованих вірусів (додатковий малюнок S3). Вірусні антигени були виявлені в зонах ураження легенів за допомогою фарбування IHC (рис. 4 F, G та H).
Інфекція MRV кажанів викликає важку пневмонію у мишей BALB/c. Ліву частку легені мишей BALB/c при 14 dpi піддавали патологічному дослідженню за допомогою фарбування H&E та аналізу IHC, знімки робили з основи легенів. A та E, мимовільно інфіковані миші, досліджені за допомогою фарбування H&E та IHC, відповідно. B-D, мишей, інфікованих WIV2, WIV3 та WIV7, відповідно, досліджували за допомогою фарбування H&E. Досліджувані тканини показали важку пневмонію з виразним альвеолярним потовщенням, зменшенням бронхіол та альвеол (чорний ящик) та лімфоцитарною інфільтрацією (чорна стрілка). Шкала шкали становить 200 мкм. Для аналізу IHC в якості основного антитіла використовували поліклональне антитіло проти WIV3, а як вторинне антитіло - мічений HRP козячий IgG. Позитивна область буро-жовта і може спостерігатися у заражених WIV2- (F), WIV3- (G) та WIV7 (H) легенях. Шкала шкали становить 100 мкм.
3.5. Імунна відповідь у інфікованих вірусом мишей
MRV з 3 кажанами показали різні профілі тканинного тропізму та ефективності реплікації. Всі віруси розмножуються в серці, печінці, селезінці, легенях, кишечнику та тканинах головного мозку, з найвищою реплікацією в легенях, за якими слідує кишечник. Серед трьох штамів WIV7 показав найвищу ефективність реплікації у 6 з 8 перевірених клітинних ліній. In vivo також виявлено вищу реплікацію WIV7 у легенях навіть до 10 dpi порівняно з WIV2 та WIV3, а також у мозку, що може сприяти його високій патогенності. Крім того, низький рівень віремії спостерігався лише у мишей, інфікованих WIV7, на ранній стадії зараження, що може допомогти розповсюдженню вірусу для системної інфекції. Інфіковані WIV7 миші, структура альвеол значно знизилася в легенях і виявила більше лімфоцитарної інфільтрації, ніж інфіковані WIV2 та WIV3 легеневі тканини, які також демонстрували різну альвеолярну товщину і з деякою лімфоцитарною інфільтрацією навколо судин.
Поєднуючи вищу реплікацію в клітинах і тканинах, особливо головного мозку, а також більш серйозне пошкодження легеневої тканини та слабшу та уповільнену вроджену імунну відповідь у мишей, інфікованих WIV7, ми підозрюємо, що WIV7 має вищу патогенність, ніж WIV2 та 3, та WIV2 має найменшу патогенність. У майбутньому слід проводити нагляд за цим вірусом. На закінчення ми продемонстрували потенційний ризик передачі MRV кажанів людям або іншим тваринам, надавши докази їх широкого клітинного тропізму, патогенності та імунної відповіді у мишей. Результати показали, що деякі MRV для кажанів є потенційно патогенними для популяцій тварин і людей, у яких раніше не було антитіл через шлях передачі MRV та тісний контакт між кажанами та людським суспільством. Постійне спостереження за цими вірусами кажанів та освіта, щоб триматися подалі від диких тварин, слід проводити довгостроково.
Заява автора про внесок
Рен-Ді Цзян: Концептуалізація, методологія, розслідування, Написання оригіналу проекту Bei Li: Методологія, ресурси, перевірка Xiang-Ling Liu: Валідація Mei-Qin Liu: Investigation Jing Chen: Investigation Dong-Sheng Luo: Validation Bing-Jie Hu: Дослідження Вей Чжан: Ресурси Ши-Юе Лі: Ресурси Сін-Лу Ян: Концептуалізація, методологія, курація даних, написання-огляд та редагування Чжен-Лі Ши: Концептуалізація, формальний аналіз, нагляд, написання-огляд та редагування.
Подяка
Ми вдячні Центру інструментального аналізу та метрології Інституту вірусології Ухань, CAS, за допомогу у зйомці конфокальних мікроскопів (Ding Gao) та гістологічних експериментах (Juan Min). Ми дякуємо Лабораторному центру тварин Інституту вірусології Ухань, CAS, за допомогу в експериментах на тваринах (Сюе-фанг Ан і Фан Чжан).
Це дослідження було спільно профінансовано Національним фондом природничих наук Китаю (31400143) компанії XLY. Стратегічна пріоритетна дослідницька програма Китайської академії наук (XDB29010101) до ZLS.
Виноски
Додаток А Додаткові дані до цієї статті можна знайти в Інтернеті за посиланням https://doi.org/10.1016/j.virol.2020.05.014.
Додаток А. Додаткові дані
Нижче наведено додаткові дані до цієї статті:
- Антидепресанти, що викликають схуднення (найкращі продукти) Найкращі таблетки для збільшення ваги
- Малорухливий спосіб життя може бути причиною кокцидінії
- 11 20 2019) Таблетки Adhd Причина Для схуднення рідкі таблетки для схуднення надзвичайно незаконні таблетки для схуднення
- 9 непопулярних вправ, які не дозволяють; t Викликають біль у попереку
- 5 продуктів, що викликають жир на животі