Оцінка невропатологічних ефектів дієти з високим вмістом жиру з високим вмістом сахарози у самців мишей C57BL6/J середнього віку
Департамент наук про здоров'я, Університет Брока, Онтаріо, Канада
Департамент наук про здоров'я, Університет Брока, Онтаріо, Канада
Департамент наук про здоров'я, Університет Брока, Онтаріо, Канада
Листування
Ребекка Е. К. Макферсон, Департамент наук про здоров'я, Університет Брока, Сент-Катарінс, Онтаріо, Канада.
Тел: 905‐688‐5550 × 6620
Департамент наук про здоров'я, Університет Брока, Онтаріо, Канада
Департамент наук про здоров'я, Університет Брока, Онтаріо, Канада
Департамент наук про здоров'я, Університет Брока, Онтаріо, Канада
Листування
Ребекка Е. К. Макферсон, Департамент наук про здоров'я, Університет Брока, Сент-Катарінс, Онтаріо, Канада.
Тел: 905‐688‐5550 × 6620
Інформація про фінансування:
Ми вдячні Раді природничих та технічних досліджень Канади (NSERC) за фінансову підтримку фінансування цього проекту (RGPIN ‐ 2017‐03904 REK MacPherson), а також за фінансування оригінального випробування in vivo (RGPIN 2016‐04300 SJ Peters) як канадський фонд інновацій для фінансування оригіналу випробування in vivo (грант № 222084 WE Ward). К.Н. Ботта підтримала стипендія для аспірантів Онтаріо. Б. Дж. Барановський отримав нагороду студентів за наукові дослідження студентів Канади з питань природничих та технічних досліджень (NSERC).
Анотація
Дисфункція обміну речовин, пов’язана з ожирінням, спричиненим дієтою, нещодавно пов’язана з патогенезом епізодичної хвороби Альцгеймера (БА). Однак основні механізми, що пов'язують ожиріння та АД, залишаються неясними. Метою цього дослідження було вивчення ранніх змін сигналізації інсуліну мозку, маркерів запалення/стресу та енергетичного стресу в моделі ожиріння, спричиненого дієтою, у середньому віці. Самців мишей C57BL/6J рандомізували на контрольну дієту (AGE n = 12) або дієта з високим вмістом жиру та сахарози (AGE ‐ HFS n = 12) протягом 13 тижнів з 20-тижневого віку. Зразки префронтальної кори та гіпокампа збирали у віці 20 тижнів (BSL n = 11) та у віці 33 тижнів (AGE та AGE ‐ HFS). Дієта HFS призвела до збільшення маси тіла (30%; P = 0,0001), підвищений% жирової маси (28%; P = 0,0001), і зменшення% нежирної маси (33%; P = 0,0001) порівняно із контролем віку. У префронтальній корі AGE-HFS призвів до збільшення фосфорилювання 5 ′ аденозинмонофосфат-активованої протеїнкінази (AMPK) (P = 0,045). В гіпокампі AGE-HFS призвів до збільшення фосфорилювання позаклітинної регульованої сигналом кінази (ERK) та c-Jun N-кінцевої кінази (JNK) та фосфорилювання протеїнкінази B (Akt) та глікогенсинтази кінази (GSK) (P
Вступ
Хвороба Альцгеймера (БА) - це прогресуючий нейродегенеративний розлад, що призводить до зниження когнітивних здібностей у подальшому житті. Старіння є найбільшим фактором ризику розвитку AD (Jorm et al. 1987), однак ожиріння, спричинене дієтою, безпосередньо пов'язане з етіологією AD (Lester-Coll et al. 2006; Verdelho et al. 2007; Maesako et al. 2012a, b, 2013; Bhat and Thirumangalakudi 2013). Недавній аналіз тенденцій ожиріння продемонстрував, що серед американців середнього віку рівень ожиріння найвищий серед усіх вікових груп - 41,0% (Flegal et al. 2016), і дослідження показали, що ожиріння в середньому віці може бути показником легких когнітивних порушень у пізніші роки (Nguyen et al. 2014). Враховуючи нинішню відсутність ефективних методів лікування АД та розглядаючи АД як метаболічну хворобу, розуміння основних молекулярних механізмів, що виникають на досимптомних стадіях, має значне значення.
AD характеризується двома гістопатологічними ознаками: (1) накопичення бляшок бета-амілоїдного білка (Aβ); та (2) гіперфосфорильовані тау-клубки (Behl and Holsboer 1998). Ці Aβ-пептиди були встановлені як ключові гравці деградації нейронів, що відбувається при AD (Gouras et al. 2005), і відіграють фундаментальну роль у механізмах раннього прогресування AD (Selkoe 2004; Gandy 2005). Незважаючи на велику кількість інформації, що стосується патофізіології БА, початкові події, що викликають утворення нальоту Aβ, недостатньо вивчені. Aβ походить від великого трансмембранного білка 1 типу, відомого як амілоїдний білок-попередник (APP) (Selkoe 2001). Шлях β-секретази ініціюється ферментом 1, що розщеплює білок-попередник амілоїдного бета-сайту (BACE1), обмежуючим швидкість ферментом протеази у виробництві пептидів Aβ.
Обезогенні дієти часто призводять до інсулінорезистентності та стану енергетичного стресу в периферичних тканинах, і факти свідчать, що ожиріння також змінює сигналізацію інсуліну мозку та, в свою чергу, енергетичний статус. Аберрантний контроль передачі сигналів інсуліну через PI3-кіназу та протеїнкіназу B (Akt) був продемонстрований у тканинах мозку від хворих на АД людини, а також у мозку тварин із ожирінням, спричиненим дієтою. У зразках AD людини, Griffin et al. (2005) виявили посилене фосфорилювання Akt зі значним збільшенням фосфорилювання декількох субстратів Akt, включаючи глікогенсинтазу кіназу (GSK). Це важливо, оскільки GSK безпосередньо причетний до прогресування AD. Робота гризунів продемонструвала
2-кратне збільшення фосфорилювання Akt у зразках префронтальної кори у молодих самців мишей C57BL6 (
16 тижнів) після дієти з високим вмістом жиру (Macpherson et al. 2015), а також мишей у віці після 5-місячного годування з високим вмістом жиру (Muller et al. 2008). Мозок людини у хворих на АД демонструє аномально активований AMPK (Vingtdeux et al. 2011; Ma et al. 2014), і це вважається маркером порушеного енергетичного обміну мозку. Вплив старіння та/або дієти на діяльність мозку AMPK недостатньо вивчений. Небагато досліджень зосереджувались на безпосередньому впливі старіння або обезогенної дієти на активність AMPK (на що вказує фосфорилювання Thr172), і багато з них суперечать попереднім висновкам. Попередня робота продемонструвала зменшення активації AMPK з віком у 28-місячних щурів-самців Fisher 344, проте механізми залишаються невідомими (Reznick et al. 2007). Існує думка, що ці вікові зниження активності AMPK можуть сприяти дисфункції мітохондрій (Jornayvaz and Shulman 2010), що було пов’язано з патогенезом БА. Однак попередні роботи встановили, що спостерігається підвищення рівня фосфорилювання AMPK у 12-місячної моделі миші AD (APPswe/PS1d9E) порівняно з диким типом (Ma et al. 2014). Потрібні подальші дослідження, щоб точно визначити, як старіння та дієта з високим вмістом жиру впливають на активність та експресію АМФК.
Мета цього дослідження - вивчити вплив обезогенної дієти на метаболічні зміни мозку у дорослих самців мишей C57BL/6J при переході їх від дорослого до середнього віку. Зокрема, у цьому дослідженні вивчались маркери запалення/клітинного стресу, сигналізації про інсулін та енергетичного стресу, які, як було показано, мають вплив на прогресування АД. Ми припускаємо, що споживання дієти з високим вмістом жиру з високим вмістом сахарози посилить наслідки старіння на метаболічні шляхи, пов'язані з прогресуванням АД.
Методи та матеріали
Матеріали
Вторинні антитіла IgG проти кролячих та козячих антимишачих антитіл до ослиної пероксидази хрону були від лабораторій Jackson ImmunoResearch (Westgrove, PA). Маркер молекулярної маси, реагенти та нітроцелюлозні мембрани для SDS-PAGE були отримані від Bio-Rad (Mississauga, ON). Західна блискавка Plus ‐ ELC (PerkinElmer, 105001EA). Антитіла до GAPDH (# 2118S), BACE1 (# 5606P), AMPK (# 2793S), pAMPK (# 2531S), AKT (# 4685S), pAKT S473 (# 4058S), pAKT Thr172 (# 2531S), ERK 1/2 (# 4695S), pERK 1/2 (# 9101S), p38 (# 9212S), p ‐ p38 (# 9211S), JNK (# 9252S), pJNK (# 4671S), GSK ‐ 3β (# 9315S) та pGSK‐ 3β (# 5558S) були від клітинної сигналізації (Danvers, MA, США), а Vinculin (# 05‐386) від Milipore. Усі інші джерела перераховані у всьому тексті.
Тварини
Експериментальні протоколи були затверджені Комітетом з догляду за тваринами університету Брока (файл № 15‐06‐01) і відповідають Канадській раді з догляду за тваринами. Тварини та експериментальний дизайн - це нещодавнє дослідження, опубліковане в Університеті Брока (Bott et al. 2017). Самці мишей C57BL/6J (19 тижнів; 26,9 ± 1,9 г., n = 35) були придбані у лабораторії Джексона (м. Бар-Харбор, штат Мен, США) та дозволено протягом 5 днів проводити акліматизацію в Університеті Брока, що займається порівняльними біологічними науками. Під час акліматизації мишей годували стандартним чау (2014 Teklad, загальнодоступна дієта для підтримки гризунів з 14% білками, Harlan Tekland, Mississauga, ON). Після акліматизації мишей рандомізували до вихідного рівня (BSL, n = 11), контролювати дієту та старіння (AGE, n = 12), або дієта з високим вмістом жиру та сахарози у поєднанні зі старінням (AGE-HFS, n = 12). В усіх мишах протягом усього періоду дослідження проводився 12-годинний темний цикл і 12-годинний темний цикл, і вони мали вільний доступ до їжі та води.
Експериментальний дизайн
Збір тканин
Мишей знеболювали 5% ізофлураном (CDMV). Мишей евтаназували знекровленням шляхом розрізання аорти та порожнистої вени. Колекція специфічних для головного мозку областей (ліва та права передня лобова кора та гіпокамп) була розкрита згідно з Spijker (2011). Коротко кажучи, хірургічними ножицями використовували голову з порізом ззаду від вух, а середній розріз робили для видалення шкіри для оголення черепа. Потім зробили невеликий розріз біля основи тім'яної кістки, а потім прорізали до самої передньої частини черепа (тобто лобової кістки). Потім за допомогою щипців відшаровувались назад і відламували обидві сторони тім'яної кістки. Як тільки мозок був відкритий, вигнуті хірургічні ножиці (закриті) підсунули під задню частину мозку і обережно підняли вгору. Потім ножицями розрізали черепно-мозкові нерви, звільняючи мозок. Після вилучення мозку з черепа хірургічним скальпелем застосовували дисекцію мозку в ліву та праву півкулі. Після ізоляції у відповідні сторони ліву та праву передню лобову кору та гіпокамп видаляли. Зразки швидко заморожували у рідкому азоті та зберігали при -80 ° C для вестерн-блот-аналізу.
Вестерн-блот
Статистичний аналіз
Відмінності у вмісті білка та фосфорилюванні визначали за допомогою одностороннього ANOVA з подальшим пост-хок-тестом Тукі. Було проведено тест Шапіро-Вілка на нормальність, і у випадках, коли дані зазвичай не розподілялись, дані були логарифмічно перетворені. Значення P
Результати
Маса тіла та склад
Раніше повідомлялося про дані про масу тіла та склад тіла (Bott et al. 2017). Коротше кажучи, до дієтичного втручання не було різниці у масі тіла між групами (BSL, AGE, AGE-HFS). Після 13-тижневої дієти/вікового втручання група AGE-HFS мала масу тіла, яка на 30% перевищувала групу AGE (P = 0,0001). Як у групах AGE, так і в AGE-HFS спостерігалося збільшення маси жиру (P = 0,0001), проте AGE-HFS мав більший приріст (79%) порівняно з AGE (51%; P = 0,0001). Зниження худої маси спостерігалося як у AGE, так і у AGE-HFS (P = 0,0001), однак AGE-HFS мав більший спад м'язової маси (46%) порівняно з AGE (13%; P = 0,001). Результати демонструють ефективність дієти HFS для індукції стану ожиріння.
Маркери запалення/клітинного стресу
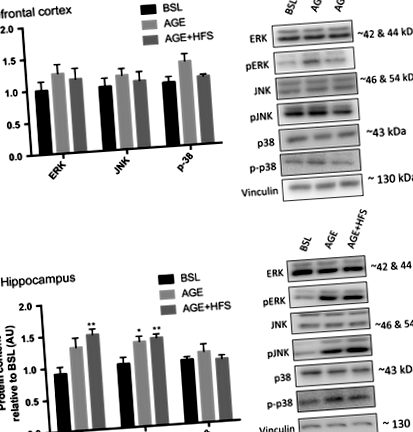
Вважається, що шлях MAPK є одним з основних шляхів, що беруть участь у прогресуванні AD, завдяки їх ролі в різних механізмах; наприклад, посилений нейрональний апоптоз, посилена активація BACE1 та фосфорилювання APP (Hashimoto et al. 2003; Marques et al. 2003; Puig et al. 2004) Були досліджені зміни загального та фосфорильованого вмісту кожної з підродин MAPK. Не було відмінностей у вмісті загального p38, ERK або JNK у всіх групах в префронтальній корі та гіпокампі. Не було відмінностей між групами щодо pERK, pJNK або фосфо-p38 в префронтальній корі (рис. 1А). В гіпокампі вміст pERK був значно вищим у групі AGE ‐ HFS порівняно з BSL та AGE (P = 0,02). Як групи AGE, так і AGE-HFS мали вищий вміст білка pJNK порівняно з BSL (рис. 1B) (P = 0,005).
Маркери інсулінорезистентності
Докази свідчать, що захворювання, пов’язані з ожирінням, внаслідок інсулінорезистентності сприяють нейродегенеративним процесам, таким як АД (Bigornia et al. 2012; Candeias et al. 2012). Як в префронтальній корі, так і в гіпокампі відмінностей у вмісті загального білка Akt або GSK-3β не спостерігалось. Префронтальна кора продемонструвала більш високе фосфорилювання Akt серину 473 як в групах AGE, так і в AGE-HFS порівняно з BSL (P = 0,03) без різниці у фосфорилюванні Akt треоніну 308 або фосфорилюванні GSK-3β (рис. 2А). Гіпокамп продемонстрував більш високе фосфорилювання Akt серину 473 як в групах AGE, так і в AGE-HFS порівняно з BSL (P = 0,0008) без різниці у фосфорилюванні Akt треоніну 308. Крім того, в гіпокампі спостерігалося більш високе фосфорилювання GSK-3β у групі AGE-HFS порівняно з BSL (рис. 2B) (P = 0,002).
Маркери енергетичного стресу
AMPK є маркером порушеного енергетичного обміну мозку і аномально активується при БА (Vingtdeux et al. 2011; Ma et al. 2014). В подальшому виявлено, що AMPK підвищує вміст і активність білка BACE1 (Chen et al. 2009). У префронтальній корі не було відмінностей у загальному вмісті АМФК між експериментальними групами; однак, вміст фосфорильованого AMPK був вищим у AGE-HFS порівняно з BSL та AGE (P = 0,045) (рис. 3А). В гіпокампі не було суттєвих відмінностей як у загальному, так і у фосфорильованому AMPK (рис. 3B).
Обробка білка амілоїдними попередниками
BACE1 вважається біомаркером для виявлення та прогнозування AD (Hampel and Shen 2009). Для вивчення ефектів старіння та старіння за допомогою дієти з високим вмістом жиру/сахарози на маркери раннього прогресування АД вимірювали зміни рівня BACE1, загального вмісту АРР та білка sAPPβ. У префронтальній корі (рис. 4А) не було статистично значущих змін вмісту BACE1, загальної кількості АРР або sAPPβ в жодній групі. В гіпокампі змін вмісту BACE1, загальної кількості АРР або sAPPβ не виявлено (рис. 4В).
Обговорення
Це дослідження дає нове уявлення про ранні зміни, що відбуваються в мозку у відповідь на дієту HFS під час переходу від дорослого до середнього віку у мишей-самців. Наші результати демонструють, що лише перехід у середній вік призводить до вищого фосфорилювання JNK гіпокампа та Akt Ser473, і що старіння протягом цього періоду під час споживання дієти HFS призводить до ще більшого фосфорилювання JNK та Akt Ser473 гіпокампа, а також фосфорилювання ERK та GSK-3β. Крім того, в префронтальній корі дієта HFS призвела до збільшення фосфорилювання AMPK, що свідчить про енергетичний стрес. Ці результати виділяють нейрозапалення/стрес, змінену передачу сигналів інсуліну мозку та підвищений енергетичний стрес як важливі зміни мозку при ожирінні, спричиненому дієтою, у середньому віці. Ця робота вдосконалює наші сучасні знання про основні механізми та шляхи, які можуть призвести до патологій, пов'язаних з АД, на ранніх стадіях захворювання. Додаткові нові результати цієї роботи демонструють регіональні відмінності між префронтальною корою та гіпокампом у відповідь на старіння з дієтою HFS, вказуючи на те, що патологія захворювання не є однорідною у всьому мозку.
На додаток до підвищених маркерів запального/клітинного стресу та зміненої сигналізації інсуліну, група AGE-HFS також продемонструвала посилене фосфорилювання AMPK в префронтальній корі. Ці висновки підтверджують гіпотезу про те, що старіння та старіння, накладені на дієту HFS, збільшують нервово-енергетичний стрес і узгоджуються з попередніми дослідженнями (Vingtdeux et al. 2011; Ma et al. 2014; Macpherson et al. 2015). Не було змін у фосфорилюванні AMPK в гіпокампі, що вказує на регіональні відмінності у відповіді на обезогенну дієту. Різні реакції префронтальної кори та гіпокампу на старіння та СНС можуть бути зумовлені різницею в енергетичному обміні між двома регіонами, або це може свідчити про різний часовий хід у прогресуванні захворювання. Потрібна подальша робота для вивчення цих регіональних відмінностей.
Висновки
Це дослідження надає нову інформацію стосовно механістичного зв’язку між ожирінням та переходом від дорослого до середнього віку та каскадів сигналізації, які можуть бути пов’язані з патологією АД пізніше в житті. Наші результати демонструють, що старіння в поєднанні з дієтою HFS посилює наслідки старіння на запалення/стрес (фосфорилювання ERK та JNK) в гіпокампі та енергетичний стрес на передфронтальній корі. Такі адаптації в префронтальній корі в порівнянні з областями гіпокампа дозволяють припустити, що патологія захворювання не є рівномірною у всьому мозку. Крім того, дієта HFS призвела до більш високого рівня фосфорилювання Akt Ser473 як в префронтальній корі, так і в гіпокампі. Ці результати додають до нашого базового розуміння шляхів, що беруть участь у ранньому прогресуванні патогенезу БА, і демонструють негативні наслідки дієти HFS як на префронтальну кору, так і на області гіпокампа.
Подяки
Автори дякують доктору. Сандра Дж. Пітерс та Венді Уорд за допомогу в цьому експерименті.
- Комбінована дієта з високим вмістом жиру та стійке споживання сахарози сприяє розвитку НАЖХП у мишачих моделей -
- Вплив ранньої дієти на сахарозі на перевагу та поведінку етанолу у самців і самок щурів вістар
- Вплив преадипоцитів, отриманих від мишей, що харчуються з високим вмістом жиру, на ангіогенний потенціал
- Вплив личинової дієти на швидкість розвитку та репродуктивне дозрівання самців та жінок
- Вплив неомилюваних речовин із рисових висівок на ожиріння, спричинене дієтою, у мишей - шинка - 2015 - журнал