Гормоночутливі нокаути ліпази
Анотація
Вступ
Вільні жирні кислоти (ВЖК) є основним джерелом енергії для більшості тканин ссавців. Циркулюючі FFA в плазмі в основному отримуються з жирової тканини, яка є основним сховищем для зберігання триацилгліцерину. Усі методи лікування ожиріння, включаючи обмеження дієти вуглеводами, мають на меті зменшити запас жиру в адипоцитах. Вважалося, що головним ферментом, відповідальним за мобілізацію FFA з жирової тканини, тобто ліполізом, є гормоночутлива ліпаза (HSL). У цьому огляді розглядаються деякі аспекти організації компонентів жирового обміну в адипоцитах, ліполіз та ліпогенез, а також те, як генетична маніпуляція шляхом ліполізу впливає на жировий обмін в адипоциті.
Властивості HSL
HSL - це внутрішньоклітинна нейтральна ліпаза, яка має широку субстратну специфічність, каталізуючи гідроліз триацилгліцерину, діацилгліцерину, моноацилгліцерину та ефірів холестерилу, а також ефірів ретинілу; однак він не має фосфоліпазної активності [1]. Його активність проти діацилгліцерину приблизно в 10 разів і в 5 разів вища, ніж активність проти триацилгліцерину та моноацилгліцерину відповідно, тоді як його активність щодо ефірів холестерилу приблизно вдвічі більша за триацилгліцерин. Гідролітична активність HSL щодо триацилгліцерину та ефірів холестерилу, але не проти діацилгліцерину, стимулюється фосфорилюванням, опосередкованим переважно протеїнкіназою А (РКА) [1].
Ліполіз
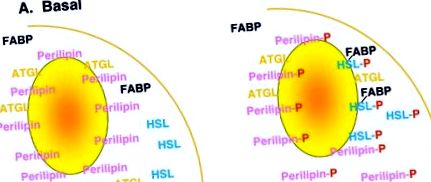
Регуляція ліполізу є складною і, хоча і не повністю зрозумілою, включає безліч механізмів, включаючи ліполітичні (β-адренергічні агоністи, АКТГ та ін.) Та антиліполітичні (інсулін, аденозин та ін.) Гормони та їх споріднені рецептори та сигнальні шляхи., особливо за участю циклічних AMP та PKA. Сучасні робочі моделі механізмів, що лежать в основі ліполізу, зосереджені на етапах розвитку гормональних рецепторів та сигнальних каскадів, концентруючись на асоційованих з краплями ліпідів білках, таких як периліпіни, та ліпазах, таких як HSL та інші, які, як видається, відіграють важливу роль у ліполізі [ 1]. У спрощеному поданні (рис. 1) ці моделі дозволяють припустити, що в базальних, нестимульованих умовах, периліпін прикрашає поверхню ліпідної краплі, захищаючи краплю ліпідів від гідролізу за допомогою HSL, який в основному знаходиться всередині цитозолю. При ліполітичній стимуляції активується РКА, що призводить до фосфорилювання як периліпіну, так і HSL. Тоді фосфорилювання периліпіну полегшує транслокацію HSL з цитозолю в ліпідну краплю, де може тривати гідроліз триацилгліцерину та ліполіз.
Мультфільм модель ліполізу. За базових умов периліпін локалізується в краплі ліпідів разом з іншими білками, пов'язаними з краплями, такими як ATGL (жирова тригліцеридна ліпаза), тоді як HSL в основному локалізується в цитозолі разом з іншими цитозольними білками, такими як FABP (білок, що зв'язує жирні кислоти). Після ліполітичної стимуляції активується РКА, що призводить до фосфорилювання периліпіну та HSL. Це пов'язано з транслокацією HSL з цитозолю в ліпідну краплю, де відбувається гідроліз ліпідної краплі триацилгліцерину.
Ліпази в адипоцитах
Миші HSL KO стійкі до ожиріння
Змінена експресія жирового гена у мишей HSL KO
На додаток до накопичення діацилгліцерину в тканинах, зазначених вище, вміст холестерину в жировій тканині збільшувався у нуль-мишей HSL, і це підсилювалося годуванням з високим вмістом жиру, де вміст холестерину був у 5 разів більшим у нуль-мишей HSL [13]. Окрім змін гістології та вмісту ліпідів, дефіцит HSL багаторазово впливає на жировий обмін. Рівні експресії мРНК активованого проліфератором пероксисом рецептора γ (PPARγ) та білка α, що зв’язує CCAAT/енхансер α (C/EBPα), двох основних факторів транскрипції адипогенезу [15, 16], були пригнічені на 40–70% у ВАТ Нульові миші HSL. Подібним чином рівень PPARα також був знижений
70% у ВАТ нульових мишей HSL.
Паралельно пригніченню факторів транскрипції експресія мРНК маркерів жирової диференціації, таких як адипонектин, лептин, резистин та адипсин, які є гуморальними факторами, що походять від жирової тканини, знижувалась на 60–90% [13]. На відміну від цього, експресія TNFα регулювалася в 2–3 рази в WAT та в 5–10 разів у BAT нульових мишей HSL порівняно з контролем. Знову узгоджується зі зниженням адипогенних факторів транскрипції, усі гени, пов’язані з метаболізмом жирних кислот і тригліцеридів, такі як адіпоцитарний білок, що зв’язує жирні кислоти, периліпін, ліпопротеїн-ліпаза, гліцерол-3-фосфат-ацилтрансфераза (GPAT), мітохондріальна GPAT, ацетил-КоА-карбоксилаза, синтаза жирних кислот, ацил-КоА-синтетаза, ацил-КоА: діацилгліцерол-ацилтрансфераза 1 (DGAT-1), DGAT-2, АТФ-цитратна ліаза, знижувались у ВАТ нульових мишей HSL як на звичайній чау-їжі, так і на дієті з високим вмістом жиру [13, 17]. Ці зміни в експресії генів призвели до помітного зменшення шляхів етерифікації жирних кислот та синтезу нейтральних ліпідів та гліцерол-фосфоліпідів у ВАТ нульових мишей HSL [17]. Таким чином, при порушенні ліполізу шляхом видалення HSL відбувається різке зменшення ліпогенезу, що може забезпечити більш ефективний експорт жирних кислот, що виділяються ліполізом, з клітини.
Відповідно до зниження регуляції адипогенних факторів транскрипції, експресія рецептора інсуліну, субстрату рецептора інсуліну-1 та транспортера глюкози 4 мРНК знижувалась на 30–80% у ВАТ нульових мишей HSL порівняно з контролем [13]. Однак обстеження генів, що беруть участь в метаболізмі холестерину, показало, що експресія 3-гідрокси-3-метилглутарил-КоА (HMG CoA) редуктази, ферменту, що обмежує швидкість синтезу холестерину, регулюється вгору
2-кратний; тоді як HMG CoA-синтаза-1, фермент перед ГМГ CoA-редуктазою, регулювався на 50–70% у ВАТ нульових мишей HSL [13]. Дивно, але експресія ацил-КоА: холестерину ацилтрансферази 1, ферменту, який опосередковує етерифікацію холестерину до клітинних ефірів холестерилу, збільшилася у 2–4 рази за ВАТ та у 5–8 разів за БАТ. Рівні експресії регулюючого елемента ліпогенного фактора транскрипції стеролу, що зв’язує білок-1c (SREBP-1c), були пригнічені на 50–75%, тоді як експресія SREBP-2, яка контролює синтез та поглинання холестерину, регулювалася вдвічі. Паралельно із змінами в SREBP-2, від'єднання білка 2 збільшувалось у 3–4 рази в НДТ у нуль-мишей HSL [13].
Обмін інсуліну та глюкози у мишей HSL KO
Вплив дефіциту HSL на метаболізм інсуліну та глюкози суперечливий, оскільки було опубліковано кілька статей, які повідомляють суперечливі результати. Наприклад, загальна чутливість до інсуліну у нульових мишей HSL, як повідомляється, знижується деякими авторами [7], а нормальною - іншими авторами [18, 19]. Повідомлялося, що печінкова чутливість до інсуліну підвищена [18, 19], тоді як чутливість до інсуліну в жировій тканині та м’язах знижена [7, 17] або нормальна [18, 19]. Так само, як повідомляється, секреція інсуліну у нульових мишей HSL є або нормальною [7, 20], або зниженою [21, 22]. Основи цих відмінностей у результатах не очевидні, але можуть бути обумовлені відмінностями в генетичному фоні, на якому досліджували нульових мишей HSL, або можуть залежати від того, чи проводились дослідження в пробірці або в природних умовах.
Макрофаги в жировій тканині мишей HSL KO
Нещодавні спостереження щодо збільшення інфільтрації макрофагів у ВАТ при ожирінні були поширені на нульових мишей HSL [23]. Незважаючи на те, що у нульових мишей HSL знижується маса WAT, на відміну від збільшення ожиріння, спостерігається більша поширеність гіпертрофованих адипоцитів у нульових мишей HSL. Недавні дослідження відзначають, що паралельно з гіпертрофією адипоцитів спостерігається збільшення макрофагів, розташованих у коронкоподібних структурах, що оточують адипоцити, при цьому макрофаги відсмоктують вільні від адипоцитів краплі ліпідів, що вивільняються з клітин, що зазнають некротично подібної загибелі клітин [23]. Таким чином, більша кількість макрофагів у ВАТ у нульових мишей HSL може сприяти збільшенню TNFα та деяким іншим змінам функції адипоцитів, що спостерігаються.
Висновок
Мультиплікаційні моделі потенційних механізмів, що лежать в основі зміненого метаболізму адипоцитів у мишей HSL KO. Панель A. Оскільки HSL є ключовою діацилгліцериновою ліпазою в жировій тканині, діацилгліцерин накопичується в нульових мишах HSL, що призводить до активації членів сімейства протеїнкінази C та їх подальших цілей, таких як MAPK, впливаючи таким чином на клітинну проліферацію, апоптоз та диференціацію. Панель B. Оскільки HSL є ключовою нейтральною гідролазою холестерилового ефіру в жировій тканині, у нульових мишей HSL може вичерпатися регуляторний пул вільного холестерину, що призводить до збільшення фактора транскрипції SREBP2 (регулюючий елемент стеролу елемент, що зв’язує білок 2) і подальшого підвищення регуляції його транскрипційні мішені, такі як UCP2 (роз'єднання білка 2). Панель С. Оскільки HSL опосередковує мобілізацію жирних кислот, вивільнення специфічних жирних кислот HSL може знадобитися для отримання лігандів, які переважно використовуються PPARγ. Відносна відсутність лігандів PPARγ може придушити взаємну активацію PPARγ та C/EBPα, 2 найважливіших факторів транскрипції, необхідних для диференціації адипоцитів.
- Мізопростол до введення внутрішньоматкової апаратури (ВМС) у жінок, що народили народження - Повний текст
- Вправи середньої інтенсивності та фенілкетонурія - Повний текст
- Muscletech Vitamax Energy and Metabolism for Men SX-7 Black Onyx 120 таблетки; Харчування Bizz
- Кето тонкі харчові трави для збільшення метаболізму Способи схуднення за тиждень Eagle CNC
- Я; m Текст Уеслі Уілліса для схуднення - оригінальна пісня повний текст