Оцінка безпеки та переносимості харчової композиції у пацієнтів із синдромом Ангельмана (FANS): протокол дослідження для рандомізованого контрольованого дослідження
Анотація
Передумови
Кетогенні та дієти з низьким глікемічним індексом ефективні при лікуванні стійких до наркотиків судом у дітей із синдромом Ангельмана. Пізнання, рухливість, сон та здоров’я шлунково-кишкового тракту невід’ємно пов’язані із судомною активністю та загальною якістю життя. Кетогенні та низькоглікемічні дієти обмежують споживання вуглеводів та стабілізують рівень глюкози в крові. Кетогенна дієта індукує кетоз, метаболічний стан, коли кетонові тіла переважно використовуються для палива. Застосування екзогенних кетонів для стимулювання кетозу при синдромі Ангельмана раніше не вивчалося. Рецептура дослідження, що оцінюється в цьому документі, містить екзогенний бета-гідроксибутират кетону для швидкого переміщення організму в бік кетозу, що призводить до підвищення метаболічної ефективності.
Методи/дизайн
Це 16-тижневе рандомізоване подвійне сліпе плацебо-контрольоване перехресне дослідження для оцінки безпеки та переносимості харчової суміші, що містить екзогенні кетони. Він також досліджує потенціал екзогенних кетонів для поліпшення харчового статусу пацієнта, що може вплинути на фізіологічні, симптоматичні та наслідки здоров'я, пов'язані з життям із синдромом Ангельмана.
Обговорення
Цей рукопис окреслює обгрунтування дослідження, покликаного першим надати дані про підходи до харчування для пацієнтів із синдромом Ангельмана з використанням екзогенних кетонів.
Судова реєстрація
ClinicalTrials.gov, ID: NCT03644693. Зареєстровано 23 серпня 2018 р. Останнє оновлення 23 серпня 2018 р.
Передумови
Вперше синдром Ангельмана (АС) був описаний у 1965 р. [1] і має поширеність у загальній популяції 1: 10 000–1: 24 000 [2,3, 4]. Втрата або зниження функції материнської UBE3A ген (убіквітин-білкова лігаза E3A) було визначено наприкінці 1990-х як причинний механізм у більшості випадків [5, 6]. У пацієнтів з АС загалом спостерігаються загальні затримки розвитку, включаючи порушення мови та рухові розлади [7]. Як правило, людей описують як щасливу вдачу з частим сміхом. Вісімдесят відсотків пацієнтів також відчувають судоми, і всі особи з АС мають невпорядковану електроенцефалограму (ЕЕГ) [8, 9]. Велика частина населення також має проблеми з харчуванням (75%) та інші скарги на шлунково-кишковий тракт (ШКТ) [7, 10]. На жаль, АС не має ліків. Типові протоколи лікування включають фармакотерапію судом, фізичну та поведінкову терапію та освітні втручання [11]. Однак приблизно 77% населення АС відчувають стійкі до лікування судоми [8].
Тугоплавку епілепсію успішно лікували за допомогою спеціалізованих дієтичних підходів, таких як кетогенні (KD), тригліцеридні (МСТ) на основі середніх ланцюгів та дієти з низьким глікемічним індексом (LGIT); ці дієти також мали успіх при АС [12,13,14,15]. KD дозволяє організму перейти від метаболізму на основі вуглеводів до метаболізму на основі жиру, стимулюючи тим самим печінковий кетогенез. Харчовий кетоз - це стан, коли рівень кетонових тіл у крові значно перевищує вихідний рівень, як правило> 0,5 ммоль/л. Кетонові тіла (ацетоацетат та бета-гідроксибутират (BHB)) є енергетичними субстратами, що використовуються мітохондріями для отримання аденозинтрифосфату, і можуть використовуватися як альтернативне паливо для мозку, серця та скелетних м'язів для глюкози.
Високий рівень рефрактерних нападів, проблеми з харчуванням та шлунково-кишковим трактом, а також серйозні порушення комунікації при АС призводять до високої незадоволеної медичної потреби. Існує величезна кількість проблем із забезпеченням відповідних дієт, які задовольняють складні потреби людей з АС. Харчові підходи, що сприяють використанню організмом кетонів як альтернативного палива, можуть покращити загальний стан харчування та дозволити лібералізовану дієтичну терапевтичну стратегію у осіб з АС, а отже, і поліпшити якість життя.
Передбачається, що дієтичні добавки з кетогенними інгредієнтами мають важливий вплив на задоволення харчових потреб у кетозі пацієнтів з АС. Кетонові добавки можуть допомогти у досягненні та підтримці кетозу, поліпшити загальний стан харчування пацієнта при лікуванні симптомів АС та можуть поліпшити якість життя пацієнтів та їх сімей. Це дослідження розроблено як перше в історії для оцінки безпеки та переносимості кетогенного інгредієнта бета-гідроксибутират у популяції пацієнтів з високим рівнем рефрактерної епілепсії. Цей рукопис описує обґрунтування, методи та потенційне значення дієтичних втручань на основі кетонів у дітей з АС.
Завдання
Основною метою випробування є оцінка переносимості харчової композиції, що містить BHB, у пацієнтів з АС у віці 4–11 років на різних харчових рівнях. Вторинні цілі включають оцінку кетозу при споживанні харчової композиції та безпеку харчової композиції у пацієнтів з АС. Ці міри результатів були обрані, оскільки це вразливе, невербальне населення з обмеженими можливостями спілкування з труднощами щодо переносимості та безпеки. Крім того, ступінь досягнутого кетозу може бути результатом подальших випробувань для оцінки корисного впливу стану харчування пацієнта на результати здоров'я. Усі заходи оцінюються на вихідному рівні та в кінці кожного 4-тижневого періоду втручання (плацебо проти рецептури тесту).
Методи/дизайн
Населення та обстановка
Додатковий нагляд та аудит випробування забезпечує Донна Гербер, доктор філософії, головний науковий керівник Disruptive Nutrition, LLC, щотижневі конференції з членами дослідницької групи Вандербільта. Очні зустрічі плануються щокварталу, а аудит даних проводиться раз на півроку. Створено медичний та науково-консультативний комітет, який складається з незалежних експертів та ключових лідерів думок. Засідання комітету проводяться раз на півроку. Рада з моніторингу безпеки даних обговорюється в окремому розділі цього протоколу в розділі «Моніторинг даних».
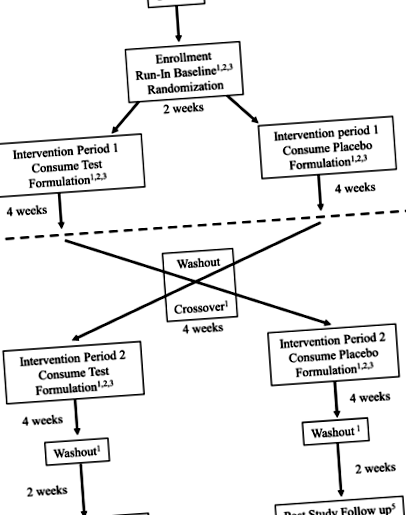
Пацієнтів вербують на сайт Нешвілла, штат Теннессі, в університеті Вандербільта. Суб'єкти з АС набираються за допомогою практики провідного слідчого, направлення лікарів, пропаганди через соціальні мережі та батьківські групи підтримки, такі як Фонд терапії синдрому Ангельмана та Фонд синдрому Ангельмана. Суб'єкти зараховуються за такими критеріями включення: генетично підтверджений діагноз синдрому Ангельмана; вік 4–11 років; в даний час на LGIT, KD (звичайний 4: 1 або 3: 1, MCT, модифікований Аткінс) або стандартна дієта (звичайна дієта) послідовно протягом принаймні 3 місяців; готовність споживати досліджуваний препарат; і готовність проходити протокольні обстеження вдома та в клініках. Суб'єкти виключаються, якщо вони: потребують парентерального харчування; мають великі порушення функції печінки або нирок; мають діабет в анамнезі або страждають на цукровий діабет; мають значно нижчу вагу з індексом маси тіла Рис. 1
Дизайн дослідження FANS - рандомізоване, плацебо-контрольоване, перехресне дослідження. Елементи стандартного протоколу: Рисунки рекомендацій щодо інтервенційних випробувань (SPIRIT); графік зарахування, втручання та оцінки. * Може проводитися по телефону або особисто на сайті клініки. ** Додатковий зразок крові буде зібраний під час базового відвідування та доданий до сховища. Зразки можуть бути використані для досліджень, таких як ДНК і РНК, протеоміка та метаболоміка, а також можуть бути використані для допоміжних досліджень, не пов'язаних з поточним випробуванням. На момент публікації інших досліджень не планувалося
Схема дослідження для цього протоколу харчових втручань - це рандомізоване, подвійне сліпе, плацебо-контрольоване, перехресне дослідження. Існує два напрямки дослідження: (1) досліджуваний період формулювання, за яким слідує період формулювання плацебо, або (2) період формулювання плацебо, за яким слід досліджуваний період формулювання. Кожен пацієнт отримуватиме як досліджуваний препарат, так і препарат плацебо, з періодом вимивання між кожною рукою. Графік рандомізації був створений Аптекою дослідницьких служб наркотиків із застосуванням програм для рандомізації у співвідношенні 1: 1 із розміром блоку 4. Учасники реєструються в наступному відкритому слоті таблиці рандомізації. Харчові рецептури кодуються номером партії виробника, і, отже, клінічний персонал незрячий щодо фактичного вмісту контейнера (активні вірші плацебо).
Після рандомізації суб’єкти починають період втручання 1, 4-тижневий період, коли вони отримують харчові препарати, що містять BHB або плацебо, зберігаючи дієту, зазначену на вході в дослідження. Домашнє спостереження відбувається, як зазначено на рис. 1. Після 4 тижнів сліпого втручання обстежуваних обстежують у клініці, а потім припиняють споживання кетонової композиції або плацебо протягом 4-тижневого періоду вимивання. Після завершення промивання суб'єкти вводять другий 4-тижневий період, коли отримують рецептуру проти плацебо. Вони будуть продовжувати домашній моніторинг протягом усього періоду дослідження. Згодом, після завершення другого втручання, вони проходять остаточний плановий навчальний візит та відбір проб у лабораторії. Період вимивання проходить після періоду втручання 2, і приблизно на 16 тижні дослідження сім'ї роблять повторний виклик для перегляду симптомів та переконання, що пацієнт не зазнає несприятливих явищ протягом цього періоду. Графік випробувань для зарахування, втручань та оцінок викладений на рис. 1 (Графік випробувань FANS).
Процедури та втручання
Переносимість визначається в кінці кожного 4-тижневого періоду втручання. Відповідність протоколу контролюється як під час досліджень, так і періодів втручання плацебо, реєструючи кількість споживаної рецептури. Прийнятність препарату оцінюється в кінці кожного періоду втручання за допомогою опитувальника батьків, що оцінює зручність, смак та ступінь прийняття харчової рецептури за 10-бальною шкалою Лікерта або на основі відповідності протоколу дослідження та споживання препарату тричі щодня постійно протягом 4-тижневого інтервенційного періоду. Подібні системи ранжування для оцінки прийнятності рецептур використовувались з іншими дієтичними втручаннями у популяціях епілепсії [22,23,24,25].
Безпека оцінюється протягом усього періоду протоколу шляхом (1) повідомлення про несприятливі події та (2) оцінки клінічних параметрів, зібраних у всьому протоколі, включаючи антропометрію, профіль метаболізму крові, споживання їжі, частоту судом, ЕЕГ, ERP, рухливість, функцію ШКТ та звички сну. У цій популяції необхідно ретельно контролювати потенціал негативних наслідків втручання, оскільки пацієнти є невербальними. Додатковий файл 4 містить деталі щодо збору, оцінки, звітування та управління побічними та спонтанно повідомленими побічними явищами.
Препарати, що досліджуються та плацебо, вводяться з розміром порції залежно від маси тіла суб’єкта. Рецептура, що досліджується, забезпечує бета-гідроксибутират, 2 г вуглеводів, 1 г білка та 9 г жиру, а також мінерали на 100 ккал. Плацебо відповідає лише вмісту мінеральних речовин. Формула дається всередину як їжа або напої тричі на день.
Статистичні міркування
Основним результатом дослідження є оцінка переносимості харчової композиції, що містить BHB, у пацієнтів з АС. Переносимість демонструється завдяки дотриманню пацієнтом протоколу, що визначається кількістю спожитих препаратів порівняно з призначеною кількістю і оцінюється в кінці кожного періоду втручання. Передчасне припинення прийому харчових препаратів сімейством також вважається потенційною непереносимістю. Переносимість також оцінюється в кінці кожного періоду втручання за допомогою батьківської анкети. Ці міри результатів були обрані, оскільки це вразлива, невербальна популяція з обмеженою здатністю до спілкування, а отже, визначення того, чи є рецептура придатною та добре переноситься, є відповідним першим кроком.
Вторинні результати включають оцінку кетозу при споживанні харчової композиції та безпеку харчової композиції у пацієнтів з АС. Кетоз оцінюють щодня за допомогою аналізу сечі, а також аналізу крові в кінці кожного періоду втручання. Ступінь та терміни кетозу можуть мати клінічне значення для демонстрації кращого харчування пацієнта, оскільки харчовий кетоз був пов'язаний з кращими результатами для пацієнтів, як описано у фоновому режимі цього рукопису. Безпека оцінюється за зміною рухової функції, когнітивної функції, толерантності до шлунково-кишкового тракту, сну та судом, а також змін у зрості, вазі та метаболічних панелях крові, як оцінювали в кінці кожного періоду втручання. Крім того, звіт про несприятливі події контролюється в режимі реального часу координатором дослідження.
Жодних досліджень, що перевіряють добавки кетонів у пацієнтів з АС, не існує. Тому оцінка обсягу вибірки базується на показниках кетозу. З доклінічних досліджень мишей, клінічних досліджень, що не стосуються АС, з використанням МСТ та/або BHB та дієтичних втручань з низьким вмістом вуглеводів, мінімальна зміна вторинного результату, ступеня кетозу, від базової лінії до кінця Четвертий тиждень досліджуваного періоду рецептурних втручань становитиме 100% зміну від вихідного рівня (базовий рівень для звичайної дієти, як правило,
Обговорення
Синдром Ангельмана характеризується рефрактерною епілепсією. Насправді ЕЕГ осіб з АС є ненормальними у порівнянні з нейротиповим контролем навіть за відсутності судом [26]. Голодування було визнано потенційним методом лікування нападів з давніх часів, а дієтичне втручання, що імітувало голодування, було введено на початку 1920-х років [27, 28]. Ці дієти ставлять організм у стан харчового метаболічного кетозу. Використовуючи харчовий кетоз як модель, багато дієтичних втручань вивчали як на тваринних моделях, так і в клінічних випробуваннях на людях щодо різних неврологічних розладів.
Для дітей з рефрактерною епілепсією дієтичні втручання, що призводять до харчового кетозу, є ефективними та безпечними. Модифікована дієта Аткіна, проспективно вивчена у дітей у віці 3–18 років, продемонструвала, що помірний кетоз сечі розвивався протягом 4 днів із значним покращенням частоти нападів через 6 місяців [29]. У АС повідомлення про випадки також демонструють ефективність [30]. Для 5-річної дівчинки з неконтрольованими щоденними нападами, стійкими до потрійної протисудомної терапії, КД виявився ефективним у зменшенні судом з першого тижня початку. ЕЕГ без епілептичної активності підтвердила поліпшення стану пацієнта, а також покращення сну та гіперактивності. В окремому дослідженні у пацієнтів з АС 4 місяці LGIT призвели до зменшення частоти нападів з корелятивним поліпшенням ЕЕГ після випробувань із свідченнями прогресу в розвитку. Дієта добре переносилася, і п’ять із шести випробовуваних залишались на LGIT після завершення випробування [14]. Ретроспективний огляд медичних записів 23 суб'єктів з АС, які застосовували LGIT, припустив, що 22% пацієнтів підтримували повну свободу судом, 43% підтримували свободу судом, крім випадків захворювання або несудомного статусу епілептику, і 30% мали зменшення судом частота [13].
Література пропонує безпечний перехід від глюкози до кетонових тіл як палива. Велике дослідження використання дієти LGIT при дитячій епілепсії виявило обмежені побічні ефекти та зменшення частоти судом [31]. Дослідження дієти MCT виявили скарги на шлунково-кишковий тракт як найбільшу проблему переносимості [32]. Також повідомлялося про ацидоз. Ризик харчової недостатності у дітей на обмежувальних дієтичних процедурах та відсутність KD-специфічних добавок викликали занепокоєння щодо стану мікроелементів. Вимірювали рівні вітамінів А та Е, цинку, селену, кальцію та магнію у дітей з нерозв'язною епілепсією, які отримували КД [33]. Дослідники припустили, що зміни в плазмі вітамінів А та Е та зниження рівня магнію через 12 місяців можуть бути неоптимальними та потребуватимуть додаткових підходів до КД.
Докази на тваринах, що підтверджують додавання кетонів, та клінічні докази КД на моделях АС та контролю нападів, відповідно, припускають, що дієтичні втручання, включаючи екзогенні кетони, можуть бути важливим розвитком у стратегіях клінічного лікування. Поточне дослідження призначене як початкова оцінка кетогенних препаратів, що використовуються з різними дієтичними ознаками. Це унікальна можливість вивчити потенційні переваги дієтичного втручання у педіатричної популяції (віком 4–11 років) із АС. Знання, отримані в ході дослідження, можуть допомогти подальшим оцінкам використання екзогенних кетонів для харчових стратегій в дієтичному веденні пацієнтів AS.
У популяції АС відомо, що спостерігається великий ефект плацебо. Наше дослідження також пропонує унікальний дизайн, при якому використання об’єктивних заходів є пріоритетним. Ми сподіваємось, що це дасть заходи, які принесуть користь майбутнім випробуванням у громаді Ангельмана на додаток до більш чіткого розуміння загальної ефективності та механізму дії BHB для індукування кетозу. Кінцевою метою буде позитивний вплив на харчовий статус, що повинно покращити здатність пацієнта долати такі симптоми АС, як напади, пізнання та навчання, хода/рухливість та/або порушення сну.
Статус пробної версії
ClinicalTrials.gov, ID: NCT03644693. Зареєстровано 23 серпня 2018 р. Останнє оновлення 23 серпня 2018 р .; дата початку набору персоналу листопад 2018 р .; приблизна дата завершення грудня 2019 року.
Наявність даних та матеріалів
Обмін даними не застосовується до цієї статті, оскільки під час поточного дослідження набори даних не створювались та не аналізувались. Головний дослідник та клінічна група матимуть доступ до остаточного набору даних. Дослідницька група з Disruptive Nutrition матиме доступ лише до неідентифікованих даних.
- Формулювання та харчова оцінка відлучених від їжі продуктів, приготованих від приготування банана, доповнена
- Розробка та перевірка опитувальника частоти їжі (FFQ) для оцінки поживності
- Оцінка харчового складу водяної лілії (Nymphaea lotus Linn
- Оцінка анкети для оцінки харчових знань, ставлення та практики в тайській мові
- Перетворіть BTU в британську теплову одиницю Cal на калорійну їжу