Нейтралізація IL-10 або нейтралізація TGF-β анулює захисний ефект специфічної неперетравної олігосахаридної суміші у алергічних мишей на коров’ячому молоці
Джоан Керпер'єн
1 Відділ фармакології, Відділ фармацевтичних наук, факультет наук, Утрехтський університет, Утрехт, Нідерланди
Désirée Veening-Griffioen
1 Відділ фармакології, Відділ фармацевтичних наук, факультет наук, Утрехтський університет, Утрехт, Нідерланди
Tjalling Wehkamp
2 Nutricia Research BV, Утрехт, Нідерланди
Бетті К А М ван Еш
1 Відділ фармакології, Відділ фармацевтичних наук, факультет наук, Утрехтський університет, Утрехт, Нідерланди
Джерард Хофман
1 Відділ фармакології, Відділ фармацевтичних наук, факультет наук, Утрехтський університет, Утрехт, Нідерланди
Пакіта Корнеліссен
1 Відділ фармакології, Відділ фармацевтичних наук, факультет наук, Утрехтський університет, Утрехт, Нідерланди
Луїс Бун
3 Bioceros BV, Утрехт, Нідерланди
Пресцилла V Jeurink
1 Відділ фармакології, Відділ фармацевтичних наук, факультет наук, Утрехтський університет, Утрехт, Нідерланди
Йохан Гарссен
1 Відділ фармакології, Відділ фармацевтичних наук, факультет наук, Утрехтський університет, Утрехт, Нідерланди
Leon M J Knippels
1 Відділ фармакології, Відділ фармацевтичних наук, факультет наук, Утрехтський університет, Утрехт, Нідерланди
Linette E M Willemsen
1 Відділ фармакології, Відділ фармацевтичних наук, факультет наук, Утрехтський університет, Утрехт, Нідерланди
Пов’язані дані
Анотація
Передумови
Харчові неперетравлювані галакто-, довголанцюгові фрукто- та пектинові кислотні олігосахариди (GFA) знижують ефекторну відповідь у мишей з алергією на коров’яче молоко (CMA); Показано, що позитивні регуляторні Т-клітини (Tregs) сприяють цьому на вилковій коробці P3 (Foxp3).
Об’єктивна
Метою цього дослідження було оцінити внесок інтерлейкіну 10 (IL-10) та трансформуючого фактора росту β (TGF-β) у захисний ефект дієти GFA у мишей CMA.
Методи
Самки мишей C3H/HeOuJ, віком 3–4 тижні, перорально сенсибілізували холерним токсином (Sham) або сироваткою та холерним токсином (Whey) 1 раз на тиждень протягом 5 тижнів поспіль, а через 1 тиждень інсультували сироваткою. Мишей годували контрольною або 1% дієтою GFA (9: 2: 1) (Whey + GFA), починаючи з 2 тижнів до першої сенсибілізації. У другому експерименті мишам також ін'єктували рецептор αIL-10 (αIL-10r), αTGF-β або антитіла до контролю ізотипу за 24 год до кожної сенсибілізації. Визначали гостру алергічну реакцію шкіри, показник анафілаксії, сироватковий IgE, протеазу слизових тучних клітин 1 (mMCP-1) та частоту Treg у мезентеріальних лімфатичних вузлах (MLN) та експресії мРНК кишечника Foxp3, Il10 та Tgfb.
Результати
У мишей Whey + GFA експресія мРНК кишечника Il10, Tgfb або Foxp3 була в 2–10 разів вищою (P Ключові слова: алергія на коров'яче молоко, неперетравлювані олігосахариди, профілактика, регуляторні Т-клітини, IL-10, TGF-β, миша модель
Вступ
Алергія на коров’яче молоко (КМА) - одна з найпоширеніших харчових алергій серед маленьких дітей, яка вражає 2–3% немовлят у всьому світі (1–3). Більшість із цих дітей набувають толерантності до білків коров’ячого молока у віці від 3 до 5 років (2, 4, 5). Однак у дітей, які мали або мали ХМА, схильність до розвитку інших харчових алергій або астми в подальшому житті (6, 7). Існує багато різних підходів для підтримки індукції толерантності, які включають використання специфічних дієтичних компонентів для запобігання розвитку алергічної реакції на білок коров’ячого молока. Ефективність суміші коротколанцюгових галакто-, довголанцюгових фрукто- та пектинових кислотних олігосахаридів (GFAs) вивчали на мишах, сенсибілізованих сироваткою сироватки коров'ячого молока (1, 4). Ці олігосахариди структурно та функціонально імітують специфічні аспекти олігосахаридів, присутніх в жіночому молоці, і можуть позитивно впливати на імунну систему та ріст корисних бактерій у кишечнику. Вони можуть частково запобігати симптомам CMA у мишей, і було показано, що вони знижують ризик розвитку атопічного дерматиту у немовлят (8–11).
Коли DC перекошують наївні Т-клітини у бік регуляторного фенотипу, щоб викликати активну периферичну толерантність, цитокіни IL-10 та TGF-β відіграють важливу роль (18). DC виробляють TGF-β в MLN і разом з ретиноевою кислотою індукують Foxp3 + Tregs (19, 20). Крім того, Tregs секретують TGF-β, а також IL-10 для пригнічення проліферації та активації інших імунних клітин (20). І IL-10, і TGF-β можуть інгібувати розвиток і вироблення цитокінів Т-хелперних клітин та вироблення цитокінів з тучних клітин (21). Для більш повного огляду функцій IL-10 та TGF-β читача посилається на Тейлора та ін. (22) і дю Пре і Самсом (23).
Для встановлення ролі IL-10 та TGF-β у толерантності порівняно з харчовою алергією були проведені різні дослідження. Було показано, що культивовані спленоцити мишей, що переноситься перорально, виробляють значно вищі концентрації IL-10, ніж спленоцити алергічних мишей (24). Крім того, ін'єкція IL-10 перед застосуванням специфічного контактного алергену пригнічувала алергічну реакцію (25). Для TGF-β було показано, що додавання TGF-β до молока формули призводило до корисного імунного профілю T-хелпера 1 в моделі CMA щурів під час вигодовування та навіть після відлучення від грудей під час повторного виклику щурів (26). Крім того, було показано, що перорально введений TGF-β на OVA-алергічній моделі миші активний у кишечнику та посилює індукцію пероральної толерантності (27). Крім того, перорально введений TGF-β після відлучення від грудей може продовжити корисний ефект грудного молока у мишей, які страждають від OVA (28). Отже, існує кілька вказівок на те, що IL-10 і TGF-β важливі для індукції толерантності до частинок їжі.
В даний час невідомо, чи відбувається профілактичний ефект неперетравних олігосахаридів при КМА через опосередковану взаємодію з кишковим мікробіомом, прямі взаємодії клітин з епітеліальними або імунними клітинами або взаємодію через розчинні фактори, такі як IL-10 або TGF-β, локально в кишечник. З попереднього експерименту з використанням GFA в подібній обстановці ми маємо вагомі вказівки на те, що GFA можуть діяти або за допомогою IL-10, або TGF-β (29). В останньому дослідженні вища експресія мРНК Il10 або Tgfb у кишечнику спостерігалася у алергічних мишей, що годували GFA.
Метою поточного дослідження було оцінити внесок IL-10 та TGF-β у захисний ефект дієти GFA при CMA. Отже, TGF-β або рецептор IL-10 (IL-10r) нейтралізували за допомогою специфічного лікування антитілами перед кожною пероральною сенсибілізацією, щоб визначити, чи може це скасувати захисний ефект дієти GFA.
Методи
Напівсинтетична дієта на основі AIN-93G, не містить білків коров’ячого молока (білки молока замінили соєвими білками), була складена і змішана з ізокалорійною добавкою неперетравних олігосахаридів за допомогою дослідницьких дієтичних служб (Wijk bij Duurstede). До раціону був доданий один відсоток суміші коротколанцюгових галакто-олігосахаридів, довголанцюгових фрукто-олігосахаридів та кислотних олігосахаридів, отриманих із пектину (GFA; 75,0%, 16,7% та 8,3%, відповідно) (17).
Тварина модель
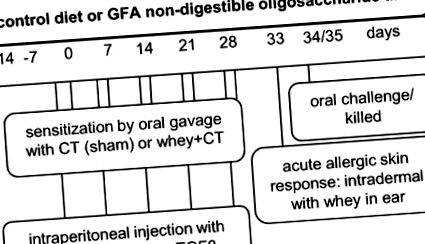
Схематичний огляд експериментальних конструкцій. Перша експериментальна установка (дані, показані в експерименті 1) проводилася без ін'єкцій антитіл, тоді як друга експериментальна установка (дані, показані в експерименті 2 та додатковій фігурі 1) включала ін'єкції антитіл. Протокол внутрішньочеревної ін’єкції вказаний у сірому полі, написаному чорним. КТ, холерний токсин; GFA, коротколанцюговий галакто-, довголанцюговий фрукто- та пектиновий кислотний олігосахарид; αIL10r, рецептор αIL-10.
Проточна цитометрія
MLN видаляли, поміщали на лід в Меморіальному інституті Розуелл Парку 1640/пеніцилін-стрептомізин 1%, обробляли через 70-нм фільтр для утворення одноклітинної суспензії і блокували на 30 хв у PBS, що містить 1% BSA і 5% тепла. інактивована ФБС. Клітини 1x10E6 інкубували при 4 ° С протягом 30 хв з CD8a-APC-Cy7; CD11c-PerCP-Cy5.5 та CD25-Pe-Cy7 використовувались від BD Biosciences та CD4-PerCP-Cy5.5, CD103-APC та Foxp3-APC від eBiosciences або відповідних елементів управління ізотипом. Позаклітинні забарвлені клітини фіксували із застосуванням 2% параформальдегіду, а внутрішньоклітинне фарбування проводили відповідно до інструкцій виробника (eBiosciences). Дані проточної цитометрії відображаються у відсотках від контрольних даних (Sham).
Імуногістохімія
Швейцарські рулони проксимального відділу тонкої кишки фіксували в нейтральному 10% формаліні протягом ≥24 год, а парафінові зрізи вбудовували за допомогою LeicaTP1020, біосистеми Leica, Амстердам, Нідерланди. Обробку тканин та фарбування Foxp3 виконували згідно Van den Elsen та співавт. (31). Клітини Foxp3 + підраховували лише у повністю прикріплених ворсинках та склепах, і розраховували кількість на ворсинки/склеп або одиницю крипти.
Один сантиметр проксимального та дистального відділів тонкої кишки та товстої кишки був зібраний незабаром після вбивства та зберігався у RNAlater (Qiagen GmbH) при 4 ° C до подальшої обробки, яка була описана раніше Kerperien et al. (29). Затверджені праймери для рибосомного білка S13 (Rps13), Foxp3, Tgfb1 та Il10 були придбані у SAbioscience (Qiagen). Рівні мРНК розраховували за допомогою програмного забезпечення CFX Manager (версія 1.6) та коригували на експресію Rps13 зі 100 × 2 (Rps13 - ген, що цікавить), як описано раніше (32).
Статистичний аналіз
Гостра алергічна шкірна реакція у підставних мишей, які годували контрольну дієту, або у мишей, чутливих до сироватки, які годували контрольну дієту або дієту GFA (експеримент 1). Гостру алергічну реакцію шкіри вимірювали через 1 год після внутрішньошкірного введення сироватки у вуха. Значення є середніми ± SEM, n = 5–6. Позначені засоби без загальної букви відрізняються, P Малюнок 4 А). Значно нижчий рівень гострої алергічної шкірної реакції у мишей, які годувались дієтою GFA, запобігали, коли мишей із сироваткою + GFA обробляли або αIL-10r (сироватка + GFA + αIL-10r), або αTGF-β (сироватка + GFA + αTGF-β) ( P Малюнок 4 A). Щодо оцінки анафілактичних симптомів, лише миші із сироваткою сироватки + виявили вищий рівень шоку порівняно з мишами із ізотипом Sham + (P Рисунок 4 B). Оцінка анафілактичних симптомів не відрізнялася між мишами, чутливими до сироватки, які годувались дієтою GFA, що отримувала ізотип (миші сироватки + GFA + ізотип), та мишами Whey + GFA + αIL-10r або Whey + GFA + αTGF-β. У 5 мишей не вдалося виміряти товщину вуха (1 у сироватці, 1 у сироватці + GFA, 2 у сироватці + αTGF-β, 1 у сироватці + GFA + αTGF-β); їх було вилучено з аналізу.
mMCP-1 та сироватковий IgE, виміряний у сироватці крові підставних мишей, які отримували контрольну дієту, та мишей, чутливих до сироватки, годували контрольну або дієту GFA, ін'єктовану контролем ізотипу, або антитілом αIL-10r або αTGFβ (експеримент 2). (A) mMCP-1 (нг/мл) та (B) сироватково-специфічний IgE вимірювали у сироватці крові. Значення є середніми ± SEM, n = 7–10. Дані аналізували за допомогою 1-факторного ANOVA та тесту Bonferroni post hoc із заздалегідь обраними парами, якщо потрібно. Перетворення журналу було використано для нормалізації розподілу даних. Кола представляють викиди. * На відміну від фіктивного (P Рисунок 6 A). Відносний відсоток CD4 + CD25 + Foxp3 + Tregs був значно вищим у изотипа сироватки + GFA + порівняно з мишами Sham + изотипа (P Рисунок 6 B). Популяція Treg у мишей сироватки + αIL-10r або сироватки + GFA + αIL-10r була значно вищою порівняно з мишами Sham + ізотип (P & відрізняється від сироватки + αIL-10r, P% відрізняється від сироватки + GFA + αIL-10r, P Малюнок 7 ). У проксимальній частині тонкої кишки мишей із ізотипом Whey + GFA + кількість Foxp3 + не була значно вищою, ніж у мишей із ізотипом Sham +. Однак значно більша кількість клітин Foxp3 + була підрахована як у групі Whey + αIL-10r, так і в групі Whey + GFA + αIL-10r порівняно з мишами Sham + изотипа (P Рисунок 7).
Клітини Foxp3 + в проксимальній частині тонкої кишки (експеримент 2). (A) IHC фарбування клітин Foxp3 + у першій частині кишечника підроблених мишей, яких годували контрольною дієтою, а мишей, чутливих до сироватки, годували контрольною дієтою або дієтою GFA і обробляли контролем ізотипу або антитілом αIL-10r або αTGF-β у мишей, чутливих до сироватки, годували контрольною дієтою, обробленою ізотипом (B), а у мишей, чутливих до сироватки, годували контрольною дієтою, оброблених αIL-10r (C). Значення є середніми ± SEM, n = 3-4 (представлений як Foxp3 + [n/(ворсинка × крипта)]). * На відміну від бутафорських, P і відмінних від сироватки + αIL-10r, P% відмінних від сироватки + GFA + αIL-10r, P -/- нокаутовані миші не можуть придушити ефекторну активацію Т-клітин (39). Отже, треги, що розвиваються за відсутності ІЛ-10, були фенотипово нормальними, але втратили свою супресивну функцію. Однак також відомо, що Tregs розвиваються за відсутності IL-10, який залежить від TGF-β (40). Дійсно, у мишей, оброблених αIL-10r, популяція CD103 + DC досягла вищого відсотка, і, як відомо, TGF-β сприяє розвитку цих клітин, які беруть участь у генерації Foxp3 + Tregs (19).
На додаток до можливості того, що Tregs втратили свою супресивну функцію під час лікування αIL-10r, він також може блокувати IL-10r на клітинах-ефекторах-мішенях, роблячи їх невідповідними на ефект IL-10. Дійсно, mMCP-1, отриманий із слизових клітин тучних клітин, був вищим у чутливих до сироватки мишей, які годували контрольну дієту з αIL-10r або без неї, а у мишей-алергіків, які годувались дієтою GFA та лікували антитілом αIL-10r (P (577K, docx)
Подяка
Відповідальність авторів полягала в наступному - JK, LMJK та LEMW: розроблено дослідження; JK, DV-G, TW, BCAMvE, GAH та PC: проводили дослідження; LB: надані основні матеріали; JK, DV-G, PVJ, PC та LEMW: аналізували дані або проводили статистичний аналіз; JK, DV-G, JG, LMJK та LEMW: написав або критично прочитав рукопис; JK та LEMW: несли основну відповідальність за остаточний зміст; та всі автори: прочитали та затвердили остаточний рукопис.
Примітки
Розкриття інформації від авторів: JK, GAH, PC та LEMW, відсутні конфлікти інтересів. DV-G, TW та PVJ працюють у Nutricia Research та повідомляють про особисті збори та нефінансову підтримку від Nutricia Research під час проведення дослідження. BCAMvE частково працює в компанії Nutricia Research і звітує про особисті збори та нефінансову підтримку компанії Nutricia Research. LB працює в Bioceros, але конфлікту інтересів не існує. JG частково працевлаштована Nutricia Research і повідомляє про особисті збори та нефінансову підтримку Nutricia Research під час проведення дослідження; крім того, він має патент на неперетравлювані олігосахариди для пероральної індукції толерантності до дієтичних білків до Nutricia Research, Нідерланди. LMJK працює в компанії Nutricia Research і повідомляє про особисті збори та нефінансову підтримку компанії Nutricia Research під час проведення дослідження; крім того, він має патент на неперетравлювані олігосахариди для пероральної індукції толерантності до дієтичних білків до Nutricia Research, Нідерланди.
- Вплив нової нордичної дієти на здоров'я для дорослих із збільшеною окружністю талії 6-місний рандомізований
- Масове мета-дослідження виявило, що більшість вітамінних добавок не впливає на тривалість життя та здоров’я серця
- Як впливає харчування на репродуктивне здоров'я FCNE
- Дізнайтеся більше про посібник з оцінки дієтичного впливу на день тижня
- Дефіцитні рецептори лептину щури-цукери із ожирінням зменшують споживання їжі у відповідь на системну реакцію