Молекулярна основа алергії на арахіс
Джеффрі А. Мюллер
1 Лабораторія структурної біології, Національний інститут наук про здоров'я навколишнього середовища, Дослідницький парк Трикутник, штат Північна Кароліна, США
Солейла Дж. Малекі
2 Міністерство сільського господарства США, Служба сільськогосподарських досліджень, Південний регіональний науковий центр, Новий Орлеан, штат Лос-Анджелес, США
Ларс К. Педерсен
1 Лабораторія структурної біології, Національний інститут наук про здоров'я навколишнього середовища, Дослідницький парк Трикутник, штат Північна Кароліна, США
Анотація
Алергени з арахісу можуть викликати потужну, а часом і небезпечну імунну відповідь у все більшої кількості людей. Молекулярні структури цих алергенів складають основу для розуміння цієї реакції. Цей огляд описує відомі на сьогодні структури арахісового алергену та обговорює, як модифікації як ферментативні, так і неферментативні впливають на травлення, вроджене розпізнавання імунітету та взаємодії IgE. Структури алергенів допомагають пояснити перехресну реактивність серед алергенів з різних джерел, що корисно для покращення діагностики пацієнта. Дивно, але нещодавно було відзначено, що споріднені короткі пептидні послідовності серед арахісових алергенів також можуть бути джерелом перехресної реактивності. Молекулярні особливості алергенів арахісу продовжують інформувати прогнози та забезпечувати нові напрямки досліджень у вивченні алергічних захворювань.
Вступ
Алергія на арахіс є основною проблемою охорони здоров'я. Останні дані свідчать про те, що захворюваність зростає, і в даний час 1-2% американців, або майже 30 мільйонів людей, мають алергію на арахіс [1]. Не дивно, що основа алергії на арахіс була предметом великих досліджень. У цьому огляді ми сподіваємось висвітлити нові дані, зосереджені на молекулярному розпізнаванні арахісових алергенів адаптивною та вродженою імунною системою. Цей огляд розгляне дві останні основні теми: перехресна реактивність серед негомологічних арахісових та горіхових алергенів та молекулярні модифікації арахісу та їх імунологічні наслідки. Ми коротко обговорюємо епітопи IgE загалом, оскільки ця тема нещодавно була добре розглянута [2–4]. Ми починаємо з обговорення молекулярних структур алергенів арахісу, щоб підготувати ці теми.
Білкові структури арахісових алергенів
Більше 50% усіх рослинних харчових алергенів можна розділити лише на чотири сімейні структурні білки; надсімейство проламіну, суперсімейство купінів, профіліни та білки, пов’язані з Bet v-1 [5]. Майже всі вони є або білками, що зберігаються, або рослинами, пов’язаними з захистом рослин [6]. Арахіс містить 12 алергенів та множинні ізоформи, визнані підкомітетом алергенної номенклатури Міжнародного союзу імунологічних товариств, 70% з яких належать до цих сімей. Ці 12 алергенів можна віднести до чотирьох найпоширеніших сімейств харчових алергенів: надсімейство Купінів (Ara h 1, 3), надсімейство Prolamin (Ara h 2, 6, 7, 9), сімейство Profilin (Ara h 5), і Bet v-1-споріднені білки (Ara h 8), а також два додаткові сімейства, Oleosin (Ara h 10,11) та Defensin (Ara h 12, 13). В даний час існують структурні дані для Ara h 1, 2, 3, 5, 6 та 8 [7–13]. Ми поділили ці структурні описи на основні алергени, які мають найвищу поширеність зв'язування IgE, та другорядні алергени, які мають меншу поширеність IgE-зв'язуючого, але значну перехресну реактивність з алергенами з інших джерел.
Основні алергени
Алергени в їжі вважаються основними, якщо вони розпізнаються за вмістом IgE у сироватці крові понад 50% алергічної популяції. Основними алергенами в арахісі зазвичай вважаються Ara h 1 і Ara h 3, які є членами сімейства білків Купіна, та Ara h 2 і Ara h 6, які є членами надсімейства проламіну. Як можна зробити висновок з наведених нижче описів, отримано значну кількість структурної, біофізичної та біоінформатичної інформації про ці алергени.
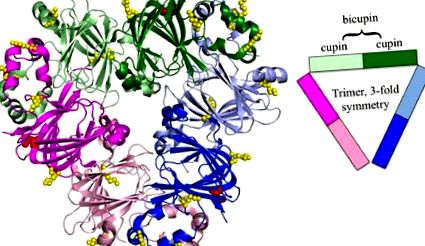
Ara h 1 тример. Ara h 1 суперсімейства купінів являє собою тример бікупінів, забарвлений доменами купіна (PDB: 3SMH). Окремі бікупіни забарвлені в рожевий, зелений та синій кольори, домени Nterminal мають легке затінення, а С-кінцеві домени мають більш темний відтінок. На структурі виділено ідентифіковані ділянки глікозилювання, пофарбовані в червоний колір (47) і глікіровані в жовтий колір. У міру вдосконалення технології може бути виявлено більше місць глікації та модифікації AGE [59]
Ara h 3 є 11S глобуліном або бобовим у суперсімействі купінів і має 21% ідентичності послідовності з Ara h 1. Окрім того, що Ara h 3 є білком для зберігання насіння, він також є інгібітором трипсину [18]. На відміну від Ara h 1, Ara h 3 може кристалізуватися в природному вигляді, очищений від сухих ядер арахісу [13]. Незважаючи на низьку ідентичність послідовності, кристалічна структура Ara h 3 дуже схожа на структуру Ara h 1 із середньоквадратичним значенням. 2,4 Å над 316 залишків ядра. Ara h 3 утворює гексамер, що складається з двох Ara h 1-подібних тримерів, складених один до одного (рис. 2). Ara h 3 модифікується посттрансляційно шляхом протеолітичного розщеплення, яке відбувається між двома доменами купіна на гнучкій петлі. Це розщеплення, як видається, потрібно для формування гексамера, оскільки цю петлю потрібно видалити, щоб два тримери утворили гексамерний інтерфейс. Два домени купіна відомі як кислотна та основна субодиниці, і їх можна легко розділити ізолектричним фокусуванням [19]. Деякі сорти арахісу, у яких відсутня основна субодиниця Ara h 3, були вивчені як потенційно менш алергенні [20].
Ара h 3 гексамер. Ara h 3 - гексамер двох тримерів бікупінів (PDB: 3C3V). Один тример пофарбований у рожевий колір, а для іншого: два бікупіни пофарбовані в сірий колір, а третій - в темно-синій для основного N-кінцевого домену купіна та блакитний для кислого С-кінцевого домену купіна. Гексамер утворюється після розщеплення пептиду між доменами купіна (місце розщеплення обведене червоним кольором). Сайти ідентифікованого глікування забарвлені у жовтий колір [59]
Ара h 2 з сімейства промалінових. На Ara h 2 виділено пептиди, які, як було встановлено, пригнічують зв'язування IgE з Ara h 1 (кольоровий зелений) та Ara h 3 (кольоровий синій). Відсутні залишки в кристалічній структурі позначаються пунктиром. Зв'язок дисульфіду показаний пурпуровими та жовтими паличками (PDB: 3OB4)
Незначні алергени
Незначні алергени розпізнаються в сироватці IgE менше ніж у 50% алергічного населення. До другорядних алергенів арахісу, щодо яких існує структурна інформація, належать Ara h 5 із сімейства білків профілінів та Ara h 8 із суперсімейства Bet v 1. Ці дві структури були визначені нещодавно.
На відміну від вищезазначених алергенів, Ara h 5 не є білком, що зберігає насіння, а належить до сімейства білків профілінів. Профіліни малі,
15-кДа, білки, знайдені у всіх еукаріотичних клітинах, які взаємодіють з актином і беруть участь у ряді клітинних процесів, таких як цитоскелетна динаміка. У рослин вони беруть участь у подовженні клітин, підтримці форми клітин, поляризованому зростанні кореневого волосся та часу цвітіння [29, 30]. На малюнку 4 показано, що кристалічна структура рекомбінантного Ara h 5 складається з канонічного мотиву профаїну α/β з центральним антипаралельним β-листом, фланкированним α-спіралями [11]. Висока послідовність та структурна збереженість для профілінів інших видів, таких як пилковий алерген Bet v 2 та латексний алерген Hev b 8, можуть пояснити, чому палелергени профіліну демонструють перехресну реакційну здатність з різних джерел [31].
Ara h 5 і Ara h 8. Структури Ara h 5 (a) з сімейства профілінів та Ara h 8 (b) із сімейства білків, пов’язаних із Bet v 1. Ліганди, виявлені в активному центрі Ara h 8 з різних структур (кольори MES блакитний та пурпуровий колір епікатецину), отримують із напівпрозорою поверхнею (PDB: 4ESP, 4M9W та 4MA6, відповідно)
Ara h 8 є 17-кДа членом білків класу білків 10 (PR-10), пов'язаних із патогенезом, які належать до суперсімейства Bet v 1. Функціональні ролі білків PR-10 недостатньо зрозумілі, але деякі можуть зіграти роль у реакції на стрес/загальному захисному механізмі, оскільки вони можуть бути викликані атакою патогену [32]. Структури білків PR-10, як правило, складаються з вигнутих семиланцюгових антипаралельних β-листів, оточених трьома α-спіралями з одного боку, створюючи гідрофобну порожнину зі здатністю зв'язувати гідрофобні ліганди [32]. Ara h 8 поділяє ці структурні особливості і було показано, що він зв'язує ряд біологічних сполук, включаючи флавоноїди, що припускає потенційну роль білка-носія флавоноїдів [12]. Різні кристалічні структури рекомбінантно експресованого Ara h 8 демонструють зв'язування епікатехіну, а також лабораторного буфера MES з ліганд-зв'язуючою порожниною (рис. 4). Ці сполуки розташовані в неперекриваються положеннях, що передбачає одночасне зв'язування декількох лігандів, подібно до досліджень зв'язування ліганду з прототипом Bet v 1 [33]. Структурне збереження поверхневих плям між Ara h 8 та пилковим алергеном Bet v 1 може пояснити перехресну реакційну здатність IgE між цими паналергенами [12].
IgE епітопи
Перехресна реактивність серед арахісових алергенів
Однією з найбільших труднощів у діагностиці та виявленні харчової алергії є перехресна реактивність алергенів. Явище перехресної реактивності при алергії може бути клінічно значущим або неактуальним. Зазвичай спостерігають позитивні результати специфічного тесту на IgE (sIgE) (за допомогою ІФА або шкірного тесту) на продукти, які переносяться. Наприклад, особи, які страждають алергією на арахіс, можуть продемонструвати перехресну реакцію sIgE на кілька горіхів та/або бобових культур, але мають клінічні симптоми арахісу і не переносять жодної, однієї або декількох продуктів, що перехресно реагують. Насправді, приблизно 50% хворих на алергію на арахіс мають позитивні проби на шкіру на інші бобові культури, але менше 5% мають клінічну симптоматику після прийому бобових [35]. Без належної історії хвороби та харчової проблеми стає все важче призначити точні дієти, щоб уникати їжі, і часто це призводить до непотрібних дієт для усунення ковдри [36]. Ці типи широко розповсюдженого уникнення дієти дуже важкі для пацієнта та його сімей [36].
Розуміння цієї “негомологічної” перехресної реактивності може бути пов’язане з важкістю реакції пацієнта. Сенсибілізація до одного арахісового алергену корелювала з менш вираженими реакціями на арахіс у порівнянні з пацієнтами, які були сенсибілізовані до множинних арахісових алергенів [41–43]. Ми припускаємо, що пацієнти, сенсибілізовані до кількох арахісових алергенів, розпізнають епітопи IgE, які перехресно реагують серед негомологічних білків, що призводить до більш важкої реакції.
Молекулярні модифікації
Для подальшого розуміння розпізнавання та реакції алерген-імунної системи необхідно розглянути додаткові складності модифікацій алергенів та їх потенційну роль у перехресної реактивності. Раніше були описані дві категорії молекулярних модифікацій алергенів арахісу, ферментативні та неферментативні. Ферментативні модифікації включають глікозилювання, тоді як неферментативні модифікації виникають внаслідок переробки їжі переважно у формі вдосконалених кінцевих продуктів глікування або AGE.
Ферментативні
Дійсно, вуглеводні детермінанти на Ara h 1 мали імуномодулюючі властивості [52]. Глікозилювання Ara h 1 має високий вміст манози, іноді містить ксилозні фрагменти [47]. Ці вуглеводи взаємодіють з різними рецепторами на дендритних клітинах (ДК), які відіграють важливу сторожову роль у вродженій імунній відповіді. Продемонстровано, що стимуляція АР h 1 DC за допомогою лектинових рецепторів MR та DC-SIGN індукує цитокіни, які, як відомо, ухиляють імунну відповідь до алергічної відповіді або відповіді типу Th2 [52, 53]. Отже, стан гікозилювання арахісових алергенів стимулює вроджені імунні клітини сигналізувати про те, що відповідь алергічного типу є необхідною для Т-клітин, що знаходяться нижче за течією. Властивості імунної стимуляції за допомогою рецепторів лектину типу С були широко вивчені у випадку алергенів пилових кліщів, як нещодавно було розглянуто [54].
Неферментативні
Білки також можуть бути модифіковані вуглеводами за допомогою неферментативного механізму, відомого як реакція Майяра. Утворення AGEs відбувається тоді, коли цукри в основному реагують із вільними амінами та зазнають перебудови Амадорі [55]. Модифікації найчастіше зустрічаються на лізинах і рідше спостерігаються на аргінінах, N-кінці та цистеїнах [56]. Крім того, між вищезазначеними залишками можуть утворюватися стабільні ковалентні зшивки. Цей процес прискорюється за рахунок більш високих температур (тобто варіння): сухе обсмажування проти варіння може збільшити кількість модифікацій AGE більш ніж у 10 разів [57]. Важливо зазначити, що ці модифікації є спонтанними і відбуваються при кімнатній температурі, хоча і повільніше порівняно з температурою приготування. Дійсно, модифікації AGE можуть бути виявлені в сирому арахісі різною мірою [58, 59]. Тому може бути більш розумним використання рекомбінантних алергенів у дослідженнях, спрямованих на виділення ефекту AGE, замість порівняння сирого та смаженого арахісу.
Молекулярні модифікації, алергія та імунологія
Пропонується модифікація AGE на арахіс, щоб змінити імунну відповідь на алергію. Було продемонстровано, що механізмом цього є стимуляція таких рецепторів, як RAGE (Receptor for Advanced Glycation End products) та рецептор поглиначів класу A типу I та II (SR-AI/II) [64–66]. Два незалежні дослідження продемонстрували, що стимуляція дендритних клітин модифікованою AGE OVA порівняно з контрольною OVA призводить до активації більшої кількості IL-4- [65] або IL-5 [66] продукуючих Т-клітин, ніж IFN-γ-продукують Т-клітини. Обидва результати свідчать про зсув Th2. Подальші дослідження в клітинах Caco-2, які є моделлю для епітелію кишечника, продемонстрували, що активація RAGE під дією AGE стимулює MAP-кінази [67]. Зовсім недавно було продемонстровано, що модифікований AGE Ara h 1 впливає на проліферацію клітин Caco-2, залежно від часу інкубації та температури, вказуючи на можливість того, що конкретні модифікації AGE можуть бути важливими для впливу на протизапальну мережу [ 68].
Однак малоймовірно, що AGE є головним чином визнаним IgE. Підтвердженням цього припущення є нещодавня стаття, яка порівнювала розпізнавання IgE рекомбінантного Ara h 1 протягом певного періоду нагрівання у присутності цукрів для створення AGE [59]. Зв’язування IgE у п’яти пацієнтів було подібним до загального вмісту білка протягом усього періоду і незначно збільшувалось із більшою кількістю модифікацій AGE. Отже, деякі загальні модифікації, ймовірно, розпізнаються IgE, але сильне розпізнавання немодифікованого rAra h 1 вказує на те, що алерген в першу чергу розпізнається. Коли зв'язування IgE, отримане у трьох пацієнтів, тестувалось на контрольний алерген Bos d 6, який був модифікований AGE за тим самим протоколом, зв'язування IgE не виявлено, що ще раз вказує на те, що алерген є важливішим за AGE модифікацій і що AGE розпізнаються в контексті білка [59]. Оскільки AGE присутні майже у всіх приготованих продуктах харчування, здається надзвичайно небезпечним наявність антитіл IgE, спеціально проти AGE, аналогічно дискусії вище про наявність антитіл проти звичайних рослинних вуглеводів.
Якщо модифікації AGE так поширені у кулінарії, чи є важливі наслідки для здоров'я інших продуктів? Важливість дієтичного віку в цілому широко обговорюється в літературі. На моделях на тваринах існує чіткий зв’язок між дієтами з низьким віком та пригніченням атеросклерозу та профілактикою діабетичної нефропатії [79]. Однак існують суперечливі дослідження щодо наслідків дієтичного віку для людей. Деякі дослідження описують AGE як «глікотоксини» та заохочують зменшення AGE у раціоні людини [57]. На відміну від цього, нещодавній мета-аналіз випробувань на людях, що включають дієти з обмеженим віком, прийшов до висновку, що недостатньо доказів, що стимулюють це обмеження дієти у здорових людей, хворих на цукровий діабет або нирок [80]. Далі в огляді зазначається, що всі дослідження, що вказують на сприятливий ефект дієт з обмеженим віком, вийшли з однієї дослідницької групи, і всі дослідження могли б отримати вигоду від кращого дизайну дослідження та стандартизованих вимірювань для полегшення кращих порівнянь [80].
Причина того, що арахіс викликає такі потужні реакції, навряд чи має один причинний фактор, але, мабуть, це поєднання нещасних подій, які працюють узгоджено. Модифікації AGE та інгібуючі властивості трипсину Ara h 2 та Ara h 3 зменшують протеоліз. Це призводить до того, що більше арахісового білка переживає травлення, а отже, більше цілісного білка надходить у кишечник. Вижилі білки або їх фрагменти, ймовірно, підтримують структурні елементи [81]. Це, ймовірно, стимулює імунну систему як адаптивною імунною системою через зв'язування IgE, так і вродженою нездужаючою реакцією через рецептори лектину та рецептори, такі як RAGE, що розпізнає модифікації глікозилювання та глікування відповідно.
Висновки
Структурні особливості алергенів та сімейств білків дають важливу інформацію про виявлення, діагностику та дизайн терапевтичних засобів при алергії. Недавні дані демонструють, що реактивність IgE у сімействах білків, тобто серед негомологічних білків, також важлива при алергії на арахіс і може корелювати з найважчими симптомами. Глікозилювання арахісових алергенів навряд чи буде важливим для зв'язування антитіл IgE, але швидше може бути важливим для стимуляції вродженого імунітету через рецептори дектину або лектину. Подібним чином, стан глікації (додавання вдосконалених кінцевих продуктів глікування) впливає на вроджену імунну стимуляцію, перетравлення алергенів арахісу та розпізнавання алергенів антитілами.
Подяка
Автори хочуть подякувати доктору. Роберт Лондон, Майкл Фесслер і Джейсон Вільямс за критичне прочитання рукопису. Це дослідження було підтримане Науково-дослідним проектом № Z01-ES102885-01 та ZIA-> ES102645 у Програмі внутрішнього дослідження Національного інституту наук про здоров'я навколишнього середовища, Національних інститутів охорони здоров'я.
Виноски
Дотримання норм етики
Права людини та тварин та інформована згода
Ця стаття не містить жодних досліджень, присвячених предметам людини чи тварини, проведеним будь-яким із авторів.
Конфлікт інтересів
Джеффрі А. Мюллер, Согейла Дж. Малекі та Ларс С. Педерсен заявляють, що у них немає конфлікту інтересів.
- Наука та магія виробництва варення Біохімія та молекулярна біологія The Guardian
- Ці два цільнопродуктові продукти згадують через страх від алергії їдять це не те
- Що таке запитання та відповіді про молекулярну гастрономію, методи та рецепти
- Ваш ніс Найкраща алергія для очищення повітря; Мережа астми
- Запропонована білка, багата їжею на основі вашого знаку зодіаку - Право на білок