Миші з дефіцитом лептину ob/ob та миші з ожирінням, спричинені дієтою, по-різному реагували на операцію шунтування Roux-en-Y
Z Hao
1 Пеннінгтонський центр біомедичних досліджень, Університет штату Луїзіана, Батон-Руж, штат Лос-Анджелес, США
Н Мюнцберг
1 Пеннінгтонський центр біомедичних досліджень, Університет штату Луїзіана, Батон-Руж, штат Лос-Анджелес, США
К Резай-Заде
1 Пеннінгтонський центр біомедичних досліджень, система університету штату Луїзіана, Батон-Руж, штат Лос-Анджелес, США
М Кінан
2 Аграрний центр Університету штату Луїзіана, Батон-Руж, штат Лос-Анджелес, США
Д Кулон
2 Аграрний центр Університету штату Луїзіана, Батон-Руж, штат Лос-Анджелес, США
3 Кафедра ендокринології та метаболізму, П'ята афілійована лікарня університету Сунь Ятсен, Чжухай, Гуандун, Китай
H-R Berthoud
1 Пеннінгтонський центр біомедичних досліджень, Університет штату Луїзіана, Батон-Руж, штат Лос-Анджелес, США
1 Пеннінгтонський центр біомедичних досліджень, Університет штату Луїзіана, Батон-Руж, штат Лос-Анджелес, США
Анотація
МЕТА
Відновлення ваги сприяє терапевтичному збою у 15–20% хворих на цукровий діабет 2 типу після операції шлункового шунтування Roux-en-Y (RYGB), і механізм залишається в основному невідомим. Це дослідження було проведене для вивчення механізму відновлення ваги.
ДИЗАЙН ДИЗАЙН
Мишей ожиріння (DIO), викликаних дієтою, дикого типу (WT) використовували для імітації ожиріння людини, а мишей ob/ob - для ожиріння, спричиненого дефіцитом лептину. Дві групи мишей порівнювали відновлення ваги протягом 10 місяців після RYGB. Втрата ваги, споживання їжі, втрата калової енергії та витрата енергії контролювались при дослідженні відновлення ваги. Інсулін натще, толерантність до інсуліну та оцінка гомеостатичної моделі - резистентність до інсуліну тестували на чутливість до інсуліну при відновленні ваги. Втрату ваги від RYGB та обмеження калорій порівнювали щодо впливу на чутливість до інсуліну.
РЕЗУЛЬТАТИ
У WT-мишей RYGB викликав стійку втрату ваги та сенсибілізацію до інсуліну протягом підробленої операції у цьому 10-місячному дослідженні. Однак RYGB не зумів викликати таких самих ефектів у лептин-дефіцитних ob/ob мишей, які зазнали відновлення ваги за рівень до операції. У мишей об/об вага тіла зменшувалась на RYGB тимчасово протягом першого тижня, відновлювалась на другому тижні та згодом зростала порівняно з вихідним рівнем. Втрата ваги спричинена RYGB порівняно із втратою мишей, однак втрата була недостатньою, щоб утримати масу тіла нижче рівня до операції. Крім того, чутливість до інсуліну не покращилася за рахунок втрати ваги. Реакція на RYGB була покращена у мишей ob/ob за 2 тижні лікування лептином. Втрата ваги через обмеження калорій мала еквівалентний ефект на сенсибілізацію до інсуліну порівняно з RYGB.
ВИСНОВОК
Ці дані демонструють, що миші ob/ob та DIO миші по-різному реагували на операцію RYGB, припускаючи, що лептин може бути одним із факторів, необхідних для RYGB для запобігання відновленню ваги та рецидиву діабету.
ВСТУП
Шлункове шунтування (RYGB) є однією з найефективніших баріатричних операцій для стійкого зменшення маси тіла та ремісії діабету 2 типу. 1,2 Крім того, RYGB покращує більшість шкідливих супутніх захворювань, пов'язаних з важким ожирінням. 2 Незважаючи на інтенсивні зусилля, критичні механізми, що відповідають за ці сприятливі наслідки RYGB, ще не визначені чітко. Зрештою, RYGB повинен змінити схеми гуморальної та нервової передачі сигналів між шлунково-кишковою системою та іншими органами (такими як мозок, печінка, жирова тканина тощо), які беруть участь в регуляції енергії. 3,4 Велика увага приділяється змінам циркулюючих гормонів кишечника, таких як глюкагоноподібний пептид 1 (GLP-1), 5,6 пептид тирозин тирозин (PYY) 7,8 та грелін 9 у механістичних дослідженнях. Однак нещодавні результати різних моделей гризунів забезпечили відносно незначну підтримку їх критичної ролі у наслідках RYGB, 10–14, хоча не виключені синергетичні дії між цими гормонами та іншими факторами.
Також стало ясно, що негативний енергетичний баланс після RYGB не є наслідком неможливості збільшити споживання енергії. Якщо належним чином стимулювати гризунів RYGB, споживання їжі можна легко подвоїти, що призведе до значного відновлення ваги. 10,15,16 Крім того, 15–20% хворих на RYGB повертаються до доопераційного рівня споживання їжі та відновлюють масу тіла, незважаючи на переставлену кишку. 1 Одне з тлумачень цих спостережень полягає в тому, що успішна операція встановлює новий нижчий рівень маси тіла, який активно захищається після RYGB. Ця функція класично приписується гіпоталамусу, де лептин та інші сигнали зворотного зв'язку регулюють енергетичний баланс шляхом організації необхідних змін у споживанні та витраті енергії. Незрозуміло, чи сприяє лептин захисту після операції від низької маси тіла.
Резистентність до лептину сприяє гіперфагії та гіпометаболізму при ожирінні. Лептин у сироватці крові збільшується при ожирінні і знижується на RYGB, 5,18, що свідчить про збільшення чутливості до лептину. Однак майже невідомо, чи лептин відіграє роль у контролі відновлення ваги після RYGB. 4 У двох ранніх дослідженнях щурів із цукером із цукером із дефіцитом рецептора лептину RYGB спричинив втрату ваги та сенсибілізацію до інсуліну відразу після операції. 19,20 Однак довготривалий ефект RYGB не вивчався в цих дослідженнях щодо відновлення ваги.
Це дослідження було розроблено для перевірки впливу лептину на довгострокові ефекти RYGB з акцентом на відновленні ваги та глікемічному контролі. Нещодавно ми встановили дійсну модель миші RYGB, яка характеризується невеликим шлунковим пакетиком, стійким придушенням маси тіла нижче рівня до хірургічного втручання та низькою смертністю. 10,21 Тут ми використовуємо цю модель для вивчення відновлення ваги та контролю рівня глікемії протягом 10 місяців після RYGB у мишей із ожирінням (DIO), що страждають від дієти, та лептин-дефіцитних об/об. Крім того, заміщуючий лептин терапію тестували на мишах ob/ob протягом 2 тижнів через 25 тижнів після RYGB.
МАТЕРІАЛИ І МЕТОДИ
Повні миші
Усі експерименти були схвалені Інституційним комітетом з догляду та використання тварин Пеннінгтонського центру біомедичних досліджень. Тварин поселяли в звичайних умовах у Пеннінгтонському тваринницькому об'єкті. У проекті дослідження мишей дикого типу (WT) самців C57BL/6J використовували в групі DIO та групі, що годувала чау (худий контроль). Мишей DIO генерували, годуючи 6-тижневих мишей з жирною дієтою (HFD,> D12331 дієта, 58% калорій з жиру, Research Diets Inc.) протягом 14 тижнів. Потім мишей DIO розділили на три підгрупи (n = 7): DIO + RYGB, DIO + фіктивний та DIO + відповідна вага. Худих контрольних мишей (n = 7) годували регулярно чау-дієтою (11% калорій з жиру, 5001 LabDiet) за необхідністю. Після операції мишей DIO годували дієтою із середньою жирністю (25% калорій з жиру, 5015 LabDiet), щоб відобразити стан дієти у пацієнтів. Група, що відповідала вазі DIO +, підлягала обмеженню їжі через 14 тижнів годування HFD, щоб спричинити однакову втрату ваги, як у групи DIO + RYGB. Для генерації моделей було використано 40 мишей C57BL/6, а 28 мишей залишили після виключення некваліфікованих мишей DIO та мертвих мишей під час хірургічного втручання. Самців мишей ob/ob (26 мишей) з геновим фоном C57BL/6 купували у лабораторії Джексона у віці 4–7 тижнів та годували звичайною чау-дієтою ad libitum до та після операції.
Хірургічні процедури
Операцію RYGB проводили у мишей DIO через 14 тижнів на HFD з масою тіла 46 ± 5 g. Хірургічне втручання виконувалось на мишах ob/ob у віці 6 тижнів (35 г) та 10 тижнів (50 г). Операція проводилась, як було детально описано раніше. 21 Коротше кажучи, тварини голодували за 4–6 год до операції, а наркоз вводили за допомогою інгаляцій із ізофлураном. У хірургії RYGB передні та задні ліві судини шлунка, а також судини стравоходу були перев’язані та розрізані. Невеликий шлунковий мішечок на 5% від загального обсягу шлунка генерували та анастомозували з тонкою кишкою шляхом 16–18 перерваних швів з 11–10 нейлоновим швом. Кінцівка Ру та біліопанкреатична кінцівка були
5–6 см в довжину. Кишечник був розміщений у положенні «S», щоб уникнути кишкової непрохідності перед закриттям черевної порожнини. Під час фіктивної операції перерізали навколошлункові зв’язки та зробили 3-міліметровий розріз у шлунку, закритому титановою скобою. Тонка кишка була перерізана на 2 см дистальніше зв’язки Трейца, а два посічені кінці проанастомовані. Протягом усього часу застосовували стандартні асептичні процедури. У перші 24 години після операції мишей поміщали у звичайні клітини для взуттєвих коробок на грілку при температурі 35 ° C. Мишам підшкірно вводили 0,8 мл фізіологічного розчину на мишу та карпрофен (5 мг кг - 1, sc) для знеболення відразу після операції. Миші мали доступ до води та твердої дієти відразу після операції. Постопераційна виживаність становила 90% у мишей DIO та 80% у мишей ob/ob.
Фізіологічні показники
У цьому дослідженні вимірювали масу тіла, склад тіла та споживання їжі, як описано в іншому місці. 21 Вагу тіла визначали щодня протягом перших 2 тижнів, а потім щотижня після операції. Склад тіла визначали за допомогою ядерно-магнітного резонансу в кожній когорті в моменти, зазначені на малюнку 1. Споживання їжі визначали в одинарних мишах вручну або за допомогою метаболічної камери протягом 1-2 тижнів.
Калорійність калових речовин
Зразки калу збирали для кожної миші після операції та зберігали при -80 ° C. Калорійність визначали за допомогою бомбового калориметра Parr 1266 Isoperibol (Parr Instrument Company, Moline, IL, США). Приблизно 1 г фекальних зразків сушили ліофілізацією для видалення всієї вологи. Для кожного зразка фекалій 1 г - аликвота
У калориметрі бомби обробляли 0,2–0,3 грама. Гексадекан (Sigma-Aldrich, Сент-Луїс, Міссурі, США), горючий спайковий агент, додавали до кожної проби, щоб забезпечити повне згоряння всієї фекальної проби. Значення теплоти згоряння отримується для кожної проби калу в калоріях на грам через 8 хв. Значення було скориговано на теплоту згоряння спікувального агента автоматично, і остаточне значення загальної теплоти використано для калорій калорій. Кожен зразок проводили у повторних випробуваннях, щоб отримати середнє значення.
Тест на толерантність до інсуліну, лептину та інсуліну
Кров відбирали у мишей шляхом ретрооптичної кровотечі через 6 тижнів після операції після нічного голодування. Інсулін та лептин у сироватці крові тестували за допомогою мультиплексного набору (MMHMAG-44K, Millipore Corporation, 28820 Single Oak Drive, Темекула, Каліфорнія). Толерантність до інсуліну проводили у кожній когорті в періоди, зазначені на малюнку 1. Тест проводили з перитонеальною ін'єкцією інсуліну при 0,7 U Kg -1 через 4 год голодування. MOHA-IR розраховували за формулою: оцінка гомеостатичної моделі - резистентність до інсуліну (мг дл -1) = глюкоза × інсулін/405.
Ін’єкція лептину
Для довготривалого ефекту лептину на мишей R/GB ob/ob, лептин вводили внутрішньочеревно двічі на день протягом 2 тижнів у дозі 1 мг кг -1 на день. Споживання їжі та вага тіла контролювали щодня, використовуючи систему клітин BioDaq.
Статистичний аналіз
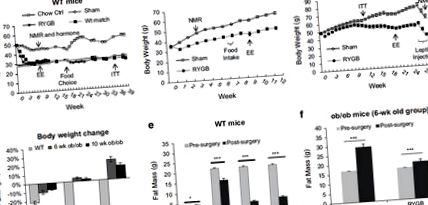
Зниження жиру в організмі пояснює спричинену хірургічним втручанням втрату ваги. Жирову масу вимірювали за допомогою ядерно-магнітного резонансу у мишей WT та ob/ob. Миші DIO демонстрували зниження жирової маси на 40% через 8 тижнів після RYGB (рис. 1г). Частина зниження була результатом переходу від дієти з високим та середнім вмістом жиру після операції, оскільки зменшення ваги приблизно на 9% спостерігалося також у мишей, які підробляли WT. HFD після операції замінено дієтою із середнім вмістом жиру (чау-селекціонером), щоб відобразити перевагу дієти у пацієнтів з RYGB та зберегти ожиріння. миші ob/ob не демонстрували зменшення жирової маси після RYGB, як вказують дані в першій когорті (рис. 1f). Натомість жирова маса була збільшена порівняно з рівнями до операції як у фіктивних, так і у мишей R/GB. Дані свідчать про те, що RYGB не в змозі постійно зменшувати жирову масу нижче рівня до операції у мишей, що не мають хірургічного лікування.
NRYGB збільшив витрати енергії у ВТ, але не об/об мишей
Споживання енергії, фекальні втрати енергії та витрати енергії досліджували через 5-8 тижнів після RYGB, коли вага тіла стабілізувалась на нижчому рівні у мишей DIO. Щоденне споживання їжі на мишу не було суттєво зменшене RYGB у мишей DIO (рис. 2а). Помірне зменшення спостерігалося у мишей ob/ob після RYGB (рис. 2а), але зміна не є суттєвою. Вміст калорій у фекаліях суттєво збільшувався за рахунок RYGB як у мишей, що страждали на ВТ, так і серед мишей (малюнки 2b та c). Лептин в сироватці крові значно зменшився у мишей з ВТ за рахунок RYGB або обмеження калорій у групі, що відповідає вазі (рис. 2г). Витрати енергії на худу масу тіла суттєво збільшились за рахунок RYGB у WT, але не у мишей, що мають загальну/звичайну форму (малюнки 3a та b). Навпаки, витрати енергії зменшувались на RYGB у мишей об/об (Малюнок 3b). Зменшення спостерігалося, коли дані нормалізувались з урахуванням худої маси тіла (рис. 3b) або ваги всього тіла (рис. 3c). Зниження було значним у денний та нічний час, коли воно нормалізувалося з нежирною масою, але лише вночі, коли воно нормалізувалося з масою всього тіла. Різниця між WT та ob/ob мишами свідчить про те, що RYGB не зміг викликати витрати енергії у мишей ob/ob.
Лептин відновлює ефекти RYGB у мишей ob/ob
Для тестування лептину на ефекти RYGB ми вводили лептин у мишей об/об (1 мг кг -1 на день, внутрішньовенно) в 2-тижневому дослідженні. У дослідженні контролювали масу тіла, споживання їжі та чутливість до інсуліну. Зниження маси тіла та споживання їжі спостерігалося як у підставних, так і у мишей RYGB після лікування лептином (малюнки 5а та b). Зменшення ваги було однаковим за масою (г) у двох групах. Однак процентна втрата ваги була значно більшою у групі RYGB через меншу вагу тіла. Зменшення споживання їжі було значно більшим (51%) у групі RYGB порівняно з групою фіктивних (рис. 5в). Чутливість до інсуліну вимірювали за допомогою інсуліну натще і оцінки гомеостатичної моделі - резистентність до інсуліну. Більше поліпшення спостерігалось у мишей RYGB після лікування лептином (малюнки 5d – f). Глюкоза в крові натще не суттєво відрізнялася у двох груп мишей після лікування лептином (рис. 5д). Ці дані свідчать про те, що ін’єкція лептину значно покращує реакцію миші на хірургію RYGB.
Ефект лептину у мишей ob/ob. Лептин вводили мишам ob/ob (9-тижнева група) через 25 тижнів після RYGB. (a) Частота втрати ваги. Зменшення маси тіла розраховували у відсотках щодо рівня до лікування. (b) Швидкість зниження щоденного споживання їжі. Зменшення відбулося у відсотках щодо рівня попередньої обробки. (c) Сукупне споживання їжі. Цифра являє собою суму щоденного споживання їжі протягом 2 тижнів лікування лептином. (d) Інсулін у крові натще після лікування лептином. (e) Глюкоза в крові натще після лікування лептином. (f) MOHA-IR у мишей ob/ob після лікування лептином. Дані виражаються як середнє значення ± s.e. (n = 5–6). * P 1 Систематичний огляд та мета-аналіз великих наборів опублікованих даних свідчить про те, що терапія RYGB не покращує метаболізм глюкози у 15–20% пацієнтів із ожирінням. 1 У світлі цього критерію, наші дані свідчать про те, що сигнал лептину може знадобитися для запобігання відновленню ваги при RYGB.
RYGB не зуміє збільшити витрати енергії у мишей, що працюють на них. Лептин, гормон, що виробляється жировою тканиною, пригнічує споживання їжі та стимулює витрату енергії. Відсутність лептину робить об/об миша чудовою моделлю для тестування лептину на RYGB. Незважаючи на те, що схема гіпоталамусу змінена у мишей ob/ob, 23 реакція нейрону на лептин не зазнає змін через зміну 24, і лептин здатний відновити метаболічні порушення у мишей ob/ob. 25 Витрати енергії були збільшені за рахунок RYGB у мишей DIO, але не у мишей ob/ob, що свідчить про те, що відсутність лептину відповідає за низькі витрати енергії у мишей ob/ob. Чутливість до лептину знижувалася через ожиріння та покращувалась за рахунок RYGB, як пропонувалось зміною сироваткового лептину у мишей DIO у цьому дослідженні. Поліпшення перетворюється на стійку втрату ваги у мишей DIO, але не у мишей ob/ob. RYGB вимагає лептину для збільшення витрат енергії та зменшення маси тіла.
На закінчення, наші дані демонструють різницю мишей ob/ob та DIO у відповідь на операцію RYGB. У мишей DIO RYGB спричиняв стійку втрату ваги та сенсибілізацію до інсуліну, як це повідомлялося у 80–85% пацієнтів із ожирінням у клінічних дослідженнях. У мишей ob/ob, хоча RYGB послаблював збільшення ваги порівняно з підробленою операцією, йому не вдалося утримати масу тіла нижче рівня до операції. Відновлення ваги нагадує те, що повідомлялося у пацієнтів із ожирінням з мутацією MCR4 після RYGB. Наші спостереження свідчать про те, що чутливість до лептину покращується завдяки RYGB. Поліпшення перетворюється на стійку втрату ваги у мишей DIO, але не у мишей ob/ob. Здається, лептин є одним із ендокринних факторів, необхідних для терапевтичного ефекту хірургічного втручання RYGB. Відсутність лептину або порушення функції сигнальних схем лептину може сприяти відновленню ваги та рецидиву діабету у 15–20% пацієнтів із ожирінням після операції RYGB. Це дослідження підтверджує, що втрата ваги суттєво сприяє сенсибілізації інсуліну при RYGB. Ці висновки можуть допомогти передбачити ефективність операції RYGB до операції та пояснити відновлення ваги після операції.
- Моніторинг вмісту сечовини та білка у плазмі крові у мишей із ожирінням (DIO), індукованих дієтою
- KSK19 - Новий ліганд рецептора гістаміну H3 зменшує масу тіла у мишей із ожирінням, індукованих дієтою -
- Миші, які зазнали надмірного материнського андрогену та ожиріння, спричиненого дієтою, змінили фосфорилювання
- Чи є стійкість до лептину причиною або наслідком ожиріння, спричиненого дієтою, Міжнародний журнал
- Лапароскопічний шлунковий шунтування Roux-en-Y для виявлення симптоматичної параезофагеальної грижі у