Метаболізм ліпідів та запалення печінки. II. Жирова хвороба печінки та окислення жирних кислот
Анотація
Рис. 1.Гістопатологічні особливості біоптатів печінки, отриманих у пацієнтів з неалкогольною жировою хворобою печінки (NAFLD). A: макровезикулярний стеатоз печінки з великою вакуоллю ліпідів, що заповнює цитоплазму гепатоцитів, що призводить до периферичного зміщення ядра. B: мікровезикулярний стеатоз зі стеатогепатитом. Маленькі крапельки жиру заповнюють цитоплазму гепатоцитів без центрального розташування ядра. Також спостерігаються невеликі скупчення клітин запалення. C.: Гіалін Меллорі розглядається як езонофільні серпігінозні агрегати при НАЖХП з макровезикулярним стеатозом. Клітини печінки з мінімальним стеатозом у верхній половині цієї фотографії представляють регенеровані клітини печінки, які виявляють стійкість до жирових змін. D: стеатогепатит. Ця фотографія ілюструє велику запальну реакцію з поліморфно-ядерними лейкоцитами та лімфоцитами, що оточують деякі гепатоцити гіаліном Меллорі. Е: трихромова пляма, що ілюструє фіброз при біопсії печінки. Зверніть увагу на макровезикулярний стеатоз та навколоклітинні, а також розширення смуг фіброзних шляхів. F: гепатоцелюлярна карцинома, що ускладнює НАЖХП. У верхньому лівому куті зображена незліченна циротична печінка з регенерованими гепатоцитами з мінімальним вмістом жиру.
Стеатогепатит.
Фіброгенез печінки, гепатоцелюлярна регенерація та прогресування до цирозу.
Цироз до раку печінки: неминуче прогресування.
Кінцева стадія FLD буде прогресувати у напрямку розвитку гепатоцелюлярної карциноми (рис. 1F), і, за різними оцінками, гепатоцелюлярна карцинома розвивається приблизно у 10% циротичної печінки AFLD (5, 6, 10, 25). Характер прогресування та загальна частота розвитку раку печінки при циротичній печінці НАЖХП недостатньо добре задокументована через форму природи цього захворювання. Тим не менше, кілька звітів стосуються розвитку гепатоцелюлярної карциноми при криптогенному цирозі, пов'язаному з NASH. За оцінками, криптогенний цироз становить 5–30% кінцевої стадії захворювання печінки, і було встановлено, що багато з цих випадків цирозу та пов’язаної з ним гепатоцелюлярної карциноми представляють прогресування НАЖХП (1, 5). На підставі цих прогнозів існує нагальна потреба у проспективних дослідженнях, щоб прослідкувати природну історію НАЖХП. Відсутність стеатозу та запальної реакції в кінцевій стадії НАЖХП є основою для позначення криптогенного цирозу, і в цих випадках було б важливо виключити вірусні інфекції гепатиту В і С та зловживання алкоголем.
Печінка є центральним гравцем у енергетичному гомеостазі всього організму завдяки своїй здатності метаболізувати глюкозу та жирні кислоти. Коли енергії достатньо, ссавці переважно спалюють вуглеводи для утворення АТФ, а надлишок глюкози після поповнення запасів глікогену перетворюється на жирні кислоти (ліпогенез) для використання при синтезі та зберіганні ТГ у білій жировій тканині (20). Хоча біла жирова тканина функціонує по суті як безмежний резервуар для накопичення ТГ, печінка також здатна зберігати значну кількість ліпідів в умовах, пов’язаних із тривалим надмірним споживанням енергії або порушенням метаболізму жирних кислот, що проявляється як стеатоз. У стані голодування, коли доступність глюкози та рівень інсуліну низькі, відбувається виснаження запасів печінкового глікогену та зменшення вироблення жирних кислот. За цих умов ТГ, що зберігаються в жировій тканині, гідролізуються до вільних жирних кислот і мобілізуються в плазму для досягнення печінки. У печінці вони окислюються, перетворюючись на кетонові тіла, які використовуються як паливо позапечінковими тканинами (11, 20).
До джерел підвищеного вмісту ліпідів (ТГ) при стеатозі печінки належать 1) надлишок дієтичного ТГ, пов’язаний з переїданням, яке досягає печінки у вигляді частинок хіломікрону з кишечника; 2) підвищений синтез ТГ у печінці з жирних кислот, що утворюються в результаті ліпогенезу de novo; 3) надлишок надходження жирних кислот у печінку внаслідок ліполізу жирової тканини в ожирінні та резистентних до інсуліну станах і подальшого перетворення в ТГ; 4) зменшився експорт ліпідів з печінки в ліпопротеїнах дуже низької щільності; і 5) знижене окислення жирних кислот. Високий рівень інсуліну пригнічує вироблення глюкози в печінці, збільшує поглинання печінки та посилює ліпогенез у печінці (3, 8). По суті, збурення, що впливають на приплив жирних кислот у печінку, їх синтез de novo та перетворення в ТГ та/або окислення для утворення АТФ, сприяють порушенню печінкового ліпідного гомеостазу (3, 8).
Ліпогенез та стеатоз печінки.
Окислення жирних кислот та стеатоз печінки.
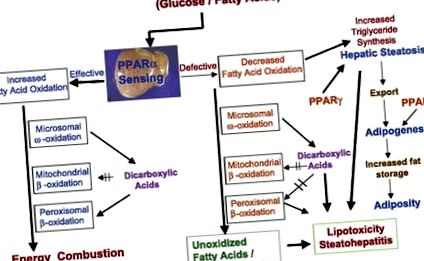
Порушення окислення жирних кислот також пояснюють надмірне накопичення ліпідів у печінці (рис. 2). Окислення жирних кислот приблизно пропорційне плазмовій концентрації вільних жирних кислот, що виділяються з жирової тканини. Мобілізація жирних кислот стимулюється глюкагоном та іншими гормонами та пригнічується інсуліном. Окислення жирних кислот відбувається в трьох субклітинних органелах (рис. 2), причому β-окислення обмежується мітохондріями та пероксисомами та каталізується CYP4A ω-окисленням, що відбувається в ендоплазматичній сітці (19, 20). Деякі ключові ферменти цих трьох систем окислення жирних кислот у печінці регулюються PPAR-α (19, 20).
Рис.2.Перехресні розмови між системами окислення жирних кислот та активованим проліфератором пероксисом рецептором (PPAR) -α в енергетичному обміні в печінці. У печінці мітохондріальні, пероксисомні та мікросомальні системи окислення жирних кислот регулюються PPAR-α і метаболізують енергію. Посилене зондування PPAR-α в печінці та індукція трьох систем окислення жирних кислот призводить до збільшення спалювання енергії та зменшення накопичення жиру. Зниження чутливості до PPAR-α та/або зниження здатності до окислення жирних кислот призводить до зменшення використання енергії та посилення ліпогенезу (опосередкованого PPAR-γ), що призводить до стеатозу та стеатогепатиту. Алкогольний та неалкогольний стеатогепатит виникає внаслідок збурень окисних систем жирних кислот у печінці. Аномалії, пов'язані з різними системами окислення жирних кислот, спричинені генетичними, токсичними (у тому числі пов'язаними з наркотиками) та метаболічними збуреннями, також призводять до зменшення спалення енергії в печінці, що призводить до накопичення ліпідів у клітинах печінки.
Мітохондріальне β-окислення головним чином бере участь у окисленні коротколанцюгових (-/- мишей), що розвивають печінковий стеатоз відразу після народження і гинуть через 6–36 год після народження (20). Старіння мишей, гетерозиготних мутантів до МТР (миші MTP-α +/−), також розвиває печінковий стеатоз і стає резистентним до інсуліну (22). На додаток до генетичних порушень, що впливають на функцію мітохондріальних жирних кислот, декілька препаратів та токсинів, включаючи алкоголь, сильно інгібують ферменти β-окислення мітохондрій, що призводить до стеатозу печінки (20).
Пероксисомне β-окислення спрямоване виключно на метаболізм менш рясних і відносно більш токсичних та біологічно активних дуже довголанцюгових жирних кислот (що містять 20 або більше атомів вуглецю), 2-метил-розгалужених жирних кислот, дикарбонових кислот, простаноїдів та C27 проміжні продукти жовчної кислоти (20). Жирні кислоти з дуже довгим ланцюгом (> C20) не переробляються мітохондріальною системою β-окислення, і вони потребують пероксисомного β-окислення, щоб скоротити довжину ланцюга для подальшого завершення окислення в мітохондріях. Довголанцюгові дикарбонові кислоти, що утворюються в результаті мікросомального ω-окислення жирних кислот, метаболізуються пероксисомною системою β-окислення (19, 20). Дикарбонові кислоти, як правило, більш токсичні, ніж жирні кислоти з дуже довгим ланцюгом, і, як відомо, інгібують систему окислення жирних кислот у мітохондріях (рис. 2). Для мінімізації шкідливих ефектів дикарбонових та інших токсичних жирних кислот для запобігання стеатозу печінки необхідна ефективна система пероксисомного β-окислення.
Порушення прямолінійного гена ацил-КоА-оксидази у миші призводить до розвитку важкого мікровезикулярного стеатозу печінки (9). Ці миші виявляють високий рівень дуже довголанцюгових жирних кислот (> С22) у сироватці крові, затримку росту та гепатомегалію при стеатогепатиті (9). У цих мишей розвиваються загибель і регенерація гепатоцитів, ліпогранульоми та гепатоцелюлярні карциноми, і деякі з цих особливостей імітують спектр печінкових змін печінки.
Жирні кислоти також окислюються мікросомальною системою ω-окислення ферментами CYP4A, здатними гідроксилювати насичені та ненасичені жирні кислоти. Першим етапом мікросомального окислення жирних кислот є ω-гідроксилювання в ендоплазматичному ретикулумі, а отримана ω-гідрокси жирна кислота потім дегідрується до дикарбонової кислоти в цитозолі. Дикарбонові кислоти перетворюються в дикарбоксиліл-КоА для окислення класичним шляхом β-окислення. Хоча ω-окислення є незначним шляхом метаболізму жирних кислот, значна кількість дикарбонових кислот може утворюватися в умовах перевантаження жирних кислот у печінці, наприклад, при ожирінні та цукровому діабеті та в ситуаціях, коли система окислення мітохондрій недостатня для метаболізму жирні кислоти. На додаток до того, що служать субстратами для системи пероксисомного β-окислення, дикарбонові кислоти також функціонують як ліганди PPAR-α для індукції всіх трьох систем окислення жирних кислот, включаючи сімейство генів CYP4A в печінці (20).
PPAR-α при стеатозі печінки.
Перспектива
Цю роботу підтримали Національні інститути охорони здоров'я GM-23750 (J. K. Reddy) та CA-104578 (J. K. Reddy).
Зверніть увагу, що вимоги до простору не дозволяли посилатися на всі розслідування чи слідчих, які брали участь у цій галузі.
- Менопаузальний статус та абдомінальне ожиріння є важливими факторами метаболізму печінкових ліпідів у
- Анатомія і фізіологія метаболізму ліпідів II
- Ліпідний склад печінкових плазматичних мембран, ізольованих від щурів, що годують з високим вмістом глюкози або високим вмістом жиру
- Чи добре червоне вино для жирної печінки
- Як зміна дієти для різних видів спорту впливає на обмін речовин San Marcos Record