Метаболічні наслідки глюкокортикоїдів у складі дієти з високим вмістом жиру та протидія фізичним вправам
Анотація
1. Вступ
Глюкокортикоїди (ГК) - це класифікація стероїдних гормонів, що виробляються природним шляхом шляхом активації осі гіпоталамус-гіпофіз-наднирники (ГПА), які відповідають за опосередкування як імунної системи, так і енергетичного обміну. За останні шість десятиліть синтетичні ГК були створені як невід’ємний компонент гематологічної терапії раку [1], а також використовуються для лікування різних запальних станів та захворювань [2,3]. За оцінками, 1,0% –2,5% населення США у віці ≥20 років (
2 533 259 осіб) прописують пероральні ГК [4,5,6,7]. На жаль, хронічне або високе введення ГК пов’язане з численними побічними ефектами, такими як індукована стероїдами втрата скелетних м’язів (тобто міопатія) [8], периферична резистентність до інсуліну [9], ожиріння вісцеральної системи [10] та розвиток діабету [11]. . ГК часто асоціюються із надмірним збільшенням ваги у людей та тварин [12], що може бути пов'язано, принаймні частково, із підвищеним прагненням до енергетично щільних продуктів "комфорту" (наприклад, з високим вмістом жиру, простих цукрів) [ 13,14]. Ряд останніх досліджень на гризунах почав досліджувати взаємозв'язок між неправильним вибором дієти, таким як дієта з високим вмістом жиру (HFD), у поєднанні з хронічним або високим дозуванням ГК. Не виключено, що пацієнти, які приймають екзогенні ГК, можуть бути більш сприйнятливими до неправильного вибору їжі, але ефект збільшення споживання жиру в поєднанні з підвищеними екзогенними ГК був досліджений лише нещодавно.
У цій роботі буде узагальнено наявну інформацію щодо метаболічних наслідків, пов’язаних із колективними наслідками підвищення рівня ГК та СНЧ (тобто дієти, збагаченої насиченими жирами). Ця інформація є критично важливою та клінічно важливою, оскільки кількість пацієнтів, які приймають екзогенні ГК, зростає і підкреслює важливість дієти з низьким вмістом жиру, коли людям проводять курс лікування ГХ.
2. Огляд ГК у галузі охорони здоров’я та хвороб
Кілька кардіометаболічних захворювань (тобто центральне ожиріння, діабет 2 типу, діабет 1 типу, метаболічний синдром та переддіабет) пов'язані із підвищенням концентрації ГХ [15]. Підвищення рівня ГК, яке може бути результатом самої хвороби або може спричинити прогресування захворювання, впливає на ряд метаболічних та поведінкових елементів [16]. Взаємодія глюкокортикоїдів/глюкокортикоїдних рецепторів (GC/GR) відіграє вирішальну роль у підтримці загального гомеостазу глюкози в ряді тканин, включаючи головний мозок та периферію, оскільки підтримка системного вуглеводного обміну вимагає складної регуляції між різними периферичними органами, крім центральних нервова система. Тонкі зміни як секреції кортизолу, так і/або тканиноспецифічної реактивації менш активних ГХ (тобто кортизону) до більш активної форми (тобто кортизолу), через рецептор ферменту 11β-гідроксистероїддегідрогенази 1 (11β-HSD1), є можливий зв’язок між біологією ГХ та розвитком резистентності до інсуліну [17] та метаболічним синдромом/цукровим діабетом 2 типу (T2DM) [18,19,20].
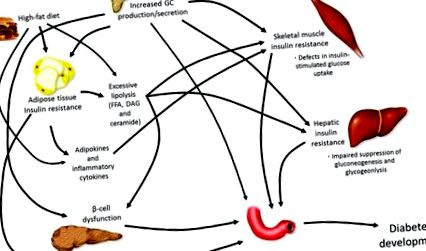
Завдяки своїм системним катаболічним діям, ГХ збільшують вироблення печінкової глюкози [21], деградацію білка скелетних м’язів [22] та ліполіз [23]. Таким чином, або ендогенне перевиробництво (хвороба Кушинга), або екзогенне підвищення ГК за допомогою терапевтичного лікування пов'язані з основними порушеннями обміну речовин, що часто завершується розвитком T2DM, особливо в умовах підвищеного споживання калорій (Рисунок 1).
Патофізіологія розвитку діабету. Розвиток явного діабету відбувається за допомогою ряду механізмів, які працюють разом, щоб вплинути на підвищення рівня глюкози в крові, що в кінцевому підсумку викликає гіперглікемію. Глюкокортикоїди (GC), вільні жирні кислоти (FFA), діацилгліцерин (DAG).
3. Метаболічні дії ГК у скелетних м’язах, печінці та жировій тканині
3.1. ГК викликають дисліпідемію та інгібують білки, що сигналізують про інсулін, у скелетних м’язах
Інсулінорезистентність, яка є порушенням реакції чутливих до інсуліну тканин на інсулінову сигналізацію, є характерною особливістю T2DM і відіграє ключову роль у патогенезі захворювання [34,35]. Системна чутливість до інсуліну в умовах після їжі здебільшого визначається чутливістю до інсуліну скелетних м’язів, хоча печінка також відіграє певну роль [36]. Гіперінсулінемія, навіть на фізіологічному рівні, може насправді стимулювати подальше погіршення чутливості до інсуліну при цукровому діабеті, сприяючи тим самим порочному кругообігу, який вимагає невпинного попиту на функцію β-клітин підшлункової залози [36].
3.2. ГХ викликають печінкову резистентність до інсуліну та дисліпідемію
Печінка є головним органом, відповідальним за регуляцію гомеостазу глюкози та ліпідів. У стані голодування вироблення глюкози в печінці через глюконеогенез (ГНГ) та глікогеноліз (ГГЛ) допомагає підтримувати евглікемію. У годуванні годування посилене надходження глюкози в печінку та зменшення вироблення глюкози є важливими компонентами контролю глюкози після їжі. При підвищеній концентрації глюкози в плазмі інсулін відповідає за придушення ендогенного вироблення глюкози [57], тоді як ГК та глюкагон збільшують печінковий вихід глюкози, що є нормальною реакцією натщесерце або катаболічному стані (наприклад, тривалі фізичні вправи). За наявності підвищення ГК продукція глюкози в печінці підвищується безпосередньо шляхом активації ферментів, відповідальних за вироблення глюкози (див. Нижче), і побічно шляхом сприяння підвищеній печінковій резистентності до інсуліну [58,59].
Індукована GC печінкова резистентність до інсуліну призводить до порушення придушення вироблення печінкової глюкози інсуліном [60]. Як правило, ГК здійснюють свої дії завдяки транскрипційній регуляції ряду генів, що беруть участь у метаболізмі вуглеводів печінки, включаючи глюкозо-6-фосфатазу (G6Pase) та фосфоенолпіруваткарбоксикіназу (PEPCK), ферменти, що обмежують швидкість, що беруть участь у СПГ [61,62] . Обидва ці ферменти містять елемент глюкокортикоїдної відповіді (GRE) у своїх промоторних областях, що дозволяє GCs безпосередньо модифікувати свою експресію генів. Оскільки ГК за своєю суттю є катаболічними, вони також здатні розщеплювати як запаси білка, так і жиру, зрештою збільшуючи доступність субстратів для СПГ. Більше того, подібно до того, що спостерігається в скелетних м'язах, індуковане ГХ підвищення рівня відкладення ліпідів у нутрощах збільшує надходження плазми NEFA та TG до печінки, що опосередковано індукує печінкову резистентність до інсуліну [63]. Це накопичення ліпідів у печінці, також відоме як гепатостеатоз, може призвести до неалкогольної жирової хвороби печінки (НАЖХП) [28] і, можливо, до більш важких захворювань печінки, таких як неалкогольний стеатогепатит, фіброз, цироз та рак [64]. ].
3.3. ГК збільшують розповсюдження жирових тканин та ліполіз
Чітко встановлено, що підвищення ГК у пацієнтів із хворобою Кушинга чи в результаті екзогенної терапії кортикостероїдами спричиняє надмірне ожиріння [65]. Ця знахідка є дещо дивною, оскільки, як видається, ГК здійснюють катаболічні дії у всіх інших метаболічно активних тканинах (тобто скелетних м’язах, печінці та кістках) [66]. Однак у самій жировій тканині було показано, що ГК відіграють суперечливу роль у метаболізмі ліпідів, спричинюючи як посилений ліполіз, так і посилене ожиріння вісцеральної тканини [23]. Як правило, ГК посилюють ліполіз у зрілих адипоцитах за рахунок посиленої транскрипції та експресії білків ліпази, жирової тригліцерид-ліпази (ATGL) та гормоночутливої ліпази (HSL) [67,68], тоді як підвищене центральне ожиріння відбувається за рахунок регуляції проліферації жирових клітин на додаток до збільшене споживання їжі [69]. Чи змінюють ГК зміни в стимульованому катехоламінами ліполізі, дещо неясно [23].
Як згадувалося вище, 11β-HSD1, який переважно експресується в печінці, мозку, скелетних м'язах та жировій тканині, посилює кількість активних ГК у даній тканині, потенційно збільшуючи вплив підвищеної активності ГХ [70]. Підвищений рівень 11β-HSD1 спостерігався в жирових складах людей із ожирінням [71], і подальші дослідження виявили, що як рівні 11β-HSD1 [72], так і GR [73] набагато більші в нутрощах порівняно з підшкірною жировою клітиною. депо. Порівняно з підшкірними адипоцитами, вісцеральні адипоцити мають вищу спорідненість до ГХ [74]. Підвищена експресія 11β-HSD1 в жировій тканині на моделі трансгенних гризунів призвела до підвищення рівня ГК жирової тканини, посиленого споживання їжі та накопичення вісцерального ожиріння, поряд з іншими особливостями метаболічного синдрому [75]. Це свідчить про те, що специфічне для жирової тканини збільшення дії ГХ, можливо, через регуляцію експресії або активності 11β-HSD1, стимулює посилене накопичення вісцерального жиру та погіршує чутливість до інсуліну у всьому тілі через прямі дії в жировій тканині.
4. ГК та споживання їжі
Вплив ГК на мозок та поведінку годування
Катаболічна активність ГХ викликає мобілізацію субстратів з периферійних джерел, таких як скелетні м’язи, печінка та жирова тканина. ГК також здатні діяти на мозок, модулюючи поведінку, вегетативні та симпатичні реакції на додаток до посилення навчання та пам'яті [76]. Встановлено, що споживання їжі, що містить речовини з високим вмістом жиру та високим вмістом цукру (часто їх називають «продуктами комфорту»), пропорційне циркулюючим ГК, а кортикостерон - гормон, який, як відомо, стимулює спонукання до їжі або спонукання [14,77]. ГК також стимулюють секрецію інсуліну, і разом з отриманою гіперінсулінемією ця взаємодія ГК з гіперінсулінемією модулює вибір їжі на користь сахарози та сала у гризунів [5,16].
У двох елегантних дослідженнях на гризунах було вивчено вплив попереднього метаболічного стресу (стриманість або холодний стрес) на перевагу «комфортних продуктів» та подальшу реакцію осі HPA. Обидва дослідження показали, що їжа "комфорту" була переважною перед стандартною чау-їжею, і надання їжі "комфорту" знижувало ступінь стрептогенних симпатичних реакцій і знижувало рівень базального кортикотропін-вивільняючого фактора/гормону (ХНН) в гіпоталамусі [78,79]. Встановлено, що пацієнти з хворобою Кушинга вибирають їжу з високим вмістом жиру порівняно з особами з нормальним рівнем ГК [80]. Більше того, було показано, що підвищення рівня катехоламінів, яке також пов'язане з підвищеною активністю осі ГПА, збільшує активність годування у гризунів [81]. ГХ опосередковано підвищують поведінку годування шляхом модифікації нейропептиду Y (NPY) [82], ключового орексигенного нейромедіатора, пов’язаного з споживанням їжі та відкладенням жирової тканини [83].
5. Поєднання висот в ГК з високожирним годуванням
5.1. Екзогенне лікування дексаметазоном або кортикостероном та годування з високим вмістом жиру
Зі збільшенням кількості людей, які в даний час приймають синтетичні ГК [84], важливо повністю зрозуміти зв'язок між підвищенням концентрації ГК та збільшенням споживання жиру в їжі. Зокрема, тип жиру є критично важливим, оскільки дієти з високим вмістом насичених жирних кислот є більш потужним діабетогенним стимулом, ніж моно- та поліненасичені жирні кислоти [85]. Дивно, але було проведено дуже обмежене дослідження, що вивчало потенційні синергетичні дії двох метаболічних порушень. Більше того, ефекти високоякісного споживання білка на зменшення втрати м’язів, спричиненої ГХ, та чутливості до інсуліну невідомі.
Мікрокомп’ютерна томографія показує, що кортикостерон та дієта з високим вмістом жиру спричиняють збільшення жиру в животі. (A) Наведено зображення черевного жиру від репрезентативного щура з кожної групи; (B) Використана ціла рентгенографія щурів із ROI (регіон інтересу). Стандартна дієта (SD), дієта з високим вмістом жиру (HFD), кортикостерон (Cort).
Як правило, вищезазначені моделі надмірного впливу HFD/GC демонструють послідовне і швидке збільшення як ожиріння вісцеральної системи, так і ектопічного відкладення ліпідів (печінка, м’язи). Можливо, оскільки, як відомо, підвищення рівня IMCL відбувається протягом 2–3 днів після HFD [94], і оскільки як GC, так і HFD спричиняють значне накопичення IMCL, можна припустити, що швидкість метаболічної дисфункції у більшості цих моделей спільного лікування, можна віднести до початкового накопичення в IMCL. У поєднанні з посиленою тканин-специфічною активністю ГХ, оскільки вміст 11β-HSD1 збільшується в жировій тканині з ВЧД, спільне лікування може бути як збільшенням вісцерального ожиріння, так і активним впливом ГХ у жировій тканині, поширюючи шкідливі ефекти підвищеного ГК. Потрібна подальша робота з вивчення механізмів, що сприяють посиленню шкідливих метаболічних ефектів, спричинених поєднанням підвищення рівня ГК, екзогенно чи ендогенно, та СНВ.
5.2. Хронічний стрес і годування з високим вмістом жиру
Іншою методологією, що використовується для активації HPA, є модель хронічного стресу, така як стрес із хронічним соціальним ураженням (CSDS), стриманий стрес або холодний стрес. Як правило, коли ця форма підвищення GC поєднується з HFD, результати напрочуд суперечать тому, що спостерігається, коли Декс або кортикостерон вводять або імплантують екзогенно. У мишей, що зазнали дії як ДІО, так і СПСР, хронічний стрес насправді покращував підвищене ожиріння, масу тіла та непереносимість глюкози, що спостерігалися після ДІО [95]. Подібним чином, щури Wistar, забезпечені HFD і іммобілізовані протягом 1 год, 5 днів/тиждень протягом 15 тижнів, були захищені від ДІО, оскільки ці тварини споживали менше, і в порівнянні з ненапруженими щурами ДІО мали нормальні толерантності до глюкози [ 96]. Клінічно це дуже актуально і потребує подальшого вивчення, оскільки це передбачає, що особи, які приймають екзогенну терапію ГХ, мають набагато більший ризик подальших метаболічних ускладнень, якщо вживають дієту з високим вмістом жиру.
6. Роль вправ у компенсації метаболічних наслідків як підвищених ГК, так і годування з високим вмістом жиру
Добровільні фізичні вправи, які зазвичай вважаються аеробними, добре відомі для поліпшення засвоєння глюкози, стимульованого інсуліном, у скелетних м’язах [109] та резистентності до інсуліну [99], спричиненого впливом ГХ, за рахунок послаблення скорочень специфічних інсулінових сигнальних білків, включаючи Akt та IRS -1 активність та експресія. Вправи також знижують вміст кераміду, одночасно покращуючи чутливість до інсуліну, можливо, направляючи ліпіди в пул тригліцеридів [110, 111, 112]. Однак фізичні вправи зазвичай не можуть покращити екстремальну втрату ваги, яку спостерігають при лікуванні дексаметазоном або кортикостероном [113], або деяких зменшеннях, які спостерігаються при ангіогенезі, зокрема зменшенню експресії судинного ендотеліального фактора росту (VEGF) [100].
Протидія впливу фізичних вправ на порушення обміну речовин, спричинені підвищеним вмістом глюкокортикоїдів та дієтою з високим вмістом жиру. Фізична активність (біг на біговій доріжці або добровільний біг на колесі) здатна покращити деякі метаболічні ефекти, спричинені підвищеними глюкокортикоїдами (ГК) та дієтою з високим вмістом жиру (ХФД), особливо в підшлунковій залозі, скелетних м’язах, жировій тканині та печінці. В даний час скелетні м’язи є найбільш дослідженими, і більшість переваг вправ пов’язані з поліпшенням сигналізації інсуліну. Підвищення рівня ГК у поєднанні з ВЧС викликає значні метаболічні ефекти, і необхідне подальше вивчення фізичних вправ на підшлункову залозу, жирову тканину та печінку.
7. Висновки
Через свої плейотропні наслідки ГК впливають майже на всі тканини організму, що збільшує їх можливі терапевтичні переваги, але також посилює ймовірні побічні ефекти. Синтетичні ГК є переважною формою лікування численних запальних та імунологічних розладів, що робить розуміння впливу дієти та харчування на їх дію головною клінічною проблемою. Існують суттєві взаємозв'язки між екзогенним підвищенням концентрації ГХ, периферичною резистентністю до інсуліну та розвитком діабету; асоціація, яка збільшується з додаванням HFD. На щастя, фізичні вправи, здається, є життєздатним терапевтичним варіантом, щоб компенсувати деякі найважчі побічні ефекти метаболізму, покращуючи загальну толерантність до глюкози, сигналізацію інсуліну скелетних м’язів, секрецію інсуліну та склад тіла. Потрібні подальші дослідження для повного розуміння метаболічних наслідків поєднання підвищення рівня ГК та збільшення жиру в їжі на додаток до ефекту фізичних вправ як можливого протидії.
Подяка
Майкла К. Рідделла та Емілі К. Данфорд підтримала Рада з природничих та технічних досліджень Канади. Ми хотіли б подякувати Софії В. Рамос за заповнення мікро-обчислюваних томографічних зображень.
Внески автора
Емілі К. Данфорд і Майкл К. Ріддел задумали і написали рукопис; Обидва автори прочитали та затвердили остаточний рукопис.
Конфлікт інтересів
Автори не заявляють конфлікту інтересів.
- Дієта проти гепатиту C з високим вмістом жиру щодо участі у випробуванні III фази софосбувіру та GS-5816 для
- Це ваш мозок на смажених яйцях Мозок, мотивація та дієта з високим вмістом жиру - ScienceDaily
- Інуїти генетично пристосовані до дієти з високим вмістом жиру, зазначає дослідження - дієтолог
- Дослідження проблем жирної дієти проти гепатиту С з піснями та ін. Білок тварин проти рослинних білків
- Різноманітність наслідків оральних відчуттів для дієти та здоров'я - PubMed