Метаболічні наслідки цистинурії
Анотація
Передумови
Цистинурія - це спадковий розлад ниркового транспорту амінокислот, який викликає рецидивуючий нефролітіаз та значну захворюваність у людей. Частота захворювання становить 1 на 7000 у всьому світі, що робить його одним з найпоширеніших генетичних розладів у людини. Ми фенотипово охарактеризували модель миші цистинурії типу А, яка є результатом нокауту Slc3a1.
Методи
Нокаут Slc3a1 на рівні РНК і білка оцінювали за допомогою кількісної ПЛР в режимі реального часу та імунофлюоресценції. Slc3a1 нокаутованих мишей розміщували на звичайних дієтах або дієтах для селекціонерів і оцінювали на предмет утворення цистинових каменів з часом за допомогою рентгенологічного аналізу та розвитку пошкодження нирок шляхом вимірювання біомаркерів пошкодження. Пошкодження нирок також оцінювали за допомогою гістологічного аналізу. Рівні амінокислот вимірювали в крові мишей за допомогою високоефективної рідинної хроматографії. Рівні глутатіону в печінці вимірювали за допомогою люмінесцентного аналізу.
Результати
Ми підтвердили нокаут Slc3a1 на рівні РНК, тоді як Slc7a9 РНК, що представляє співтранспортер, була збережена. Як і слід було очікувати, ми спостерігали утворення каменів на сечовому міхурі в Росії Slc3a1 -/- миші. Самець Slc3a1 -/- миші демонстрували меншу вагу порівняно з Slc3a1 +/+ . Slc3a1 -/- миші на регулярній дієті продемонстрували підвищений вміст азоту сечовини в крові (BUN) без підвищення рівня креатиніну в сироватці крові. Однак розміщення тварин-нокаутів на дієті селекціонера, яка містить більш високу концентрацію цистину, призвело до розвитку підвищення BUN та креатиніну, що свідчить про більш важкі хронічні захворювання нирок. Гістологічне дослідження виявило, що ці дієтичні ефекти призвели до погіршення канальцевої обструкції нирок та запалення інтерстиціалу, а також погіршення запалення сечового міхура. Цистин є попередником для молекули антиоксиданта глутатіону, тому ми оцінили рівень глутатіону в печінці Slc3a1 -/- миші. Ми виявили значно знижений рівень як зниженого, так і загального глутатіону у нокаутуючих тварин.
Висновки
Наші результати свідчать про те, що дієта може впливати на розвиток та прогресування хронічної хвороби нирок на тваринній моделі цистинурії, що може мати важливе значення для пацієнтів із цією хворобою. Крім того, знижений рівень глутатіону може схилити людей з цистинурією до травм, спричинених окислювальним стресом.
Передумови
Створено мишачі моделі цистинурії I типу. Петерс та ін. виявив помилкову мутацію в Slc3a1 на екрані мутагенезу N-етил-N-нітрозосечовини (ENU) у мишей C3HeB/FeJ [8]. Автори продемонстрували знижену вагу нирок у гомозиготних чоловіків порівняно з самцями дикого типу та гомозиготними самками. Крім того, рівень плазмової сечовини в плазмі крові був підвищений у гомозиготних чоловіків віком від 13 до 20 тижнів порівняно з тваринами дикого типу. Ліврозет та ін. виявили спонтанну мутацію в Slc3a1 у 129 мишей SvPasCrl, що призводить до цистинурії [9]. Ниркова функція не була суттєво порушена у мишей-мутантів, як вимірювали за допомогою вимірювання рівня креатиніну в сироватці крові. Однак вони спостерігали збільшення макрофагів та інтерстиціальний фіброз у мутантних мишей. Ерколані та ін. продемонстрували перешкоду на виході із сечового міхура у самців мишей цистинурії на змішаному фоні C57Bl/6 та 129/SvJ [10]. Повідомляється про генетичну стратегію генерації цієї лінії миші цистинурії [11]; однак ми прагнули більш повно характеризувати цей штам миші цистинурії.
Методи
Тварини
Slc3a1 -/- та мишей дикого типу (самців та самок) виводили та утримували, як було описано раніше та відповідно до Інституційного комітету з догляду та використання тварин системи охорони здоров’я долини Нешвілла в Теннессі та Медичного центру університету Вандербільта [10, 11]. Звичайні та дієтичні дієти чау були отримані від Lab Diet (Сент-Луїс, Міссурі) з 5L0D, що відповідає нормальному, і 5LJ5 для заводчика. Мишей поселяли у системі охорони здоров’я долини Нешвілла в штаті Теннессі. Вимірювання ваги та довжини проводили на мишах, яких вирощували та утримували на чау-селекціонерах. Для вимірювання довжини мишей знеболювали ізофлураном і вимірювали від кінчика носа до кінчика хвоста. Тварин випадковим чином розподіляли до експериментальних груп. На завершення дослідження тварини були евтаназовані відповідно до Американської ветеринарної медичної асоціації газом СО2 з подальшим вивихом шийки матки.
ПЛР у реальному часі
Тканини миші видаляли і занурювали в РНК-пізніше (Qiagen, Valancia, CA) для досліджень експресії мРНК. РНК екстрагували за допомогою набору Qiagen RNeasy. Пари праймерів були розроблені з використанням програмного забезпечення Primer Express (Applied Biosystems, Фостер Сіті, Каліфорнія), а експресія GAPDH була використана як ендогенний контроль. Рівні експресії мРНК Slc3a1 і Slc7a9 були оцінені за допомогою кількісної ПЛР у реальному часі з використанням SYBR green та ABI 7900HT Sequence Detection System (Applied Biosystems). Грунтовки наведені в таблиці 1.
Вестерн-блот, імунозабарвлення та гістологія
З цілих клітин готували білкові екстракти
Рентгенівська візуалізація
На зображенні зображено чотирнадцятитижневого чоловіка Slc3a1 -/- миші. Для моніторингу утворення каменів з часом мишей доставляли в Інститут зображень Вандербільта, знеболювали ізофлоураном та киснем до нерухомості, а потім поміщали в рентгенівський апарат Faxitron 2000 при встановленні 35 на час експозиції 4 с.
Вимірювання біомаркерів та амінокислот
Для вимірювання BUN та креатиніну кров збирали в пробірку мікроветви CB 300 Z з активатором згустків (Сарстедт, Ньютон, штат Північна Кароліна) шляхом піднижньощелепного кровотечі під анестезією ізофлураном 5,5 мм ланцетом. Зразки згортали при кімнатній температурі протягом> 30 хв і центрифугували при 4500 об/хв протягом 10-20 хв. Сироватку негайно розподіляли і зберігали при - 80 ° C для вимірювання азоту сечовини в крові Лабораторією порівняльної патології медичного центру Університету Вандербільта та вимірювання креатиніну лабораторією Core C Biomarkers University of Alabama-Birmingham O'Brien Center лабораторією LC-MS /РС. Концентрації амінокислот у плазмі крові визначали за допомогою ВЕРХ із зворотною фазою із застосуванням модифікованої версії методів Bidlingmeyer та співавт. [23].
Вимірювання глутатіону
Рівні глутатіону вимірювали за допомогою аналізу глутатіону GSH-GLO (Promega, Madison, WI) відповідно до інструкцій виробника. Концентрацію білка в печінкових лізатах визначали за допомогою BCA і концентрації нормалізували до 400 нг/мкл. Лізати печінки аналізували +/− 500 мкМ TCEP. TCEP зменшує будь-який окислений глутатіон, присутній у зразку. Люмінесценцію вимірювали за допомогою мікропланшету FLUOStar-Omega.
Результати
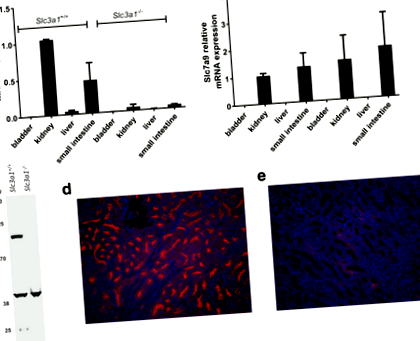
Ми вперше підтвердили нокаут Slc3a1 використання RT-PCR для оцінки рівня експресії в різних тканинах. Як і очікувалося, Slc3a1 Рівні РНК різко знижувались у тканинах, де зазвичай відбувається експресія, таких як нирки та тонкий кишечник (рис. 1а). Додатково, як очікувалося, Slc7a9 Рівень РНК був незмінним шляхом нокауту Slc3a1 (Рис. 1b). Далі ми використовували вестерн-блот та імунофлуоресцентну мікроскопію для оцінки втрати експресії rBAT у нирках Slc3a1 -/- миші. Вестерн-блот демонструє втрату експресії rBAT з лізатів нирок (рис. 1в). Імунофлуоресцентна мікроскопія для rBAT продемонструвала, що нокаут Slc3a1 призвело до втрати експресії rBAT в проксимальних канальцях Slc3a1 -/- мишей у порівнянні з мишами дикого типу (рис. 1d та e).
Slc3a1 транскрипти та експресія білка rBAT втрачаються у чоловіків Slc3a1 нокаутовані миші. Slc3a1 -/- миші демонструють втрату Slc3a1 РНК (a), але збереження Slc7a9 РНК (b) в нирках і тонкому кишечнику. Сечовий міхур і печінка подаються як негативний контроль. Показані середні значення двох незалежних експериментів, виконаних у трьох примірниках (середнє значення ± SD). (c) Представницька вестерн-пляма rBAT від дикого типу і Slc3a1 -/- миші. Імунофлуоресценцію використовували для оцінки експресії rBAT у дикому типі (d) і чоловічий Slc3a1 -/- миші (e). Тварини, що нокаутують, демонструють втрату експресії rBAT в проксимальному канальці
У ноккаутних мишей не розвивались камені в нирках, але у них виникали камені в сечовому міхурі, які можна було виявити рентгенологічно, як повідомлялося раніше (рис. 2а) [10]. Відповідно до попередніх спостережень, ми спостерігали гендерні відмінності між чоловіками та жінками Slc3a1 -/- миші з самками мишей дуже рідко розвивають камені в сечовому міхурі [10]. Ми не спостерігали високого рівня утворення каменів у сечовому міхурі у самців Slc3a1 -/- миші на нормальному чау (0,31% цистину) (табл. 2). Однак коли ми помістили самця Slc3a1 -/- мишей на чау-селекціонері (0,36% цистину) ми спостерігали вищу швидкість утворення каменів у сечовому міхурі. Порівнюючи% мишей з камінням у сечовому міхурі на 28 тижні, 100% Slc3a1 -/- миші на селекційній чау мали камені в сечовому міхурі, тоді як лише 42% Slc3a1 -/- у мишей на регулярній чау спостерігалося утворення каменів на сечовому міхурі (рис. 2б). Швидкість утворення каменів у сечовому міхурі у мишей на селекційному чау зображена на рис. 2в. Ці результати демонструють, що споживання їжі може мати великий вплив на швидкість утворення каменів у Росії Slc3a1 -/- миші.
Самець Slc3a1 -/- миші демонструють різні показники утворення каменів у сечовому міхурі залежно від дієти. a Рентгенівські промені мишей з типовим каменеутворенням на сечовому міхурі. b 42% мишей із звичайною чау мали камені в сечовому міхурі до 28 тижнів, тоді як 100% мишей мали камені в сечовому міхурі до 28 тижнів у селекціонера (N = 12). c Рентген Slc3a1 -/- тварини виявили розвиток утворення каменів у сечовому міхурі на чау-селекціонері, як зображено на ділянці Каплана-Мейєра (N = 8)
Ми спостерігали, що самець Slc3a1 -/- миші мали постійно меншу вагу порівняно з Slc3a1 +/ + миші одного віку (рис. 3а, б). Ця різниця у вазі не була повторена у самок мишей. Усі миші мали однакову довжину від носа до кінчика хвоста, вказуючи на загальний метаболічний фенотип, а не дефіцит поживної речовини, який сприяв різниці у вазі мишей-самців, вирощених та утримуваних на селекційній чау (рис. 3в). Ми оцінили рівень амінокислот у плазмі крові в Slc3a1 -/- мишей та порівняли їх з мишами дикого типу (табл. 3). Відповідно до зниженої ваги у чоловіків Slc3a1 -/- мишей ми спостерігали більш важкий фенотип із різними рівнями амінокислот, різними між диким типом та тваринами, що нокаутують. Оцінка амінокислот як у чоловіків, так і у жінок Slc3a1 -/- у мишей виявлено, що знижуються лише орнітин, лізин та таурин у обох статей. Отже, нокаутування rBAT призвело до зниження рівня орнітину та лізину у плазмі у цих тварин. Цистеїн, який утворює цистин, коли дві молекули з’єднуються, метаболізується до таурину [24], який також був відновлений у статей. Цікаво, що цистин у плазмі крові був знижений лише у чоловіків Slc3a1 -/- незважаючи на те, що як самці, так і самки мишей виявляють цистинурію [11].
Гістологічний аналіз дикого типу та самця Slc3a1 -/- нирки та сечовий міхур у віці 10–12 місяців. Нирки мишей з підвищеним креатиніном (b і d) демонструють більше розширення труб і фіброз у порівнянні з мишами з нормальним креатиніном (a і c) чи регулярно (a і b) або селекціонер чау (c і d). Сечові міхури дикого типу (e), нокаут із нормальним креатиніном (f), і нокаут з підвищеним креатиніном (g) також показані миші. Нокаути демонструють запальний інфільтрат та кристали цистину. Панель (g) демонструє кристали цистину, вбудовані в стінку сечового міхура (стрілки). Показані репрезентативні плями H&E від кожної групи мишей
Рівень глутатіону у чоловіків Slc3a1 -/- миші у віці 8 тижнів. Знижений (GSH) та окислений (GSSG) рівень глутатіону вимірювали у печінці дикого типу та Slc3a1 -/- тварини. GSH, GSSG, загальний вміст та відношення відновлених до окислених форм (GSH: GSSG) були знижені у Slc3a1 -/- миші (N = 6 ± SEM)
Обговорення
Лікування цистинурії кардинально не змінилося за останні 20 років, незважаючи на глибше розуміння генетичної основи [1]. Моделі мишей на цистинурію не тільки підтверджують генетичну основу захворювання, але також надають моделі для тестування та оцінки нових методів лікування [10]. Ймовірно, є гени, які впливають на утворення каменів у пацієнтів з цистинурією, які можна отримати з аналізу пацієнтів, а потім протестувати на мишачих моделях. Ймовірно, є гени, які впливають на утворення каменів у пацієнтів з цистинурією, які можна отримати з аналізу пацієнтів, а потім протестувати на мишачих моделях. Нещодавно Zee et al. продемонстрував, що α-ліпоєва кислота запобігає утворенню цистинових каменів на моделі миші, про яку повідомляється в цій статті [11].
Було створено три моделі миші типу цистинурії миші, включаючи описану тут, яка була створена шляхом делеції екзону 1 [10]. Інші моделі складаються із спонтанної мутації (E383K) [9] або індукованого ENU мутагенезу (D140G) [8]. Модель D140G на фоні 129S2/SvPasCrl продемонструвала зниження виживання на 40% на 15 тижнів із підвищенням рівня BUN в сироватці крові, хоча відсутність збільшення рівня креатиніну в сироватці крові та інтерстиціального фіброзу нирок [9]. Можливі гендерні відмінності в цих спостереженнях не коментувались, хоча камені в основному траплялися у чоловіків [9]. Модель E383K на тлі C3HeB/FeJ показала підвищений рівень BUN у сироватці крові у мишей-самців 20 тижнів та зниження маси нирок у мишей-самців 32–48 тижнів, не спостерігаючи жодного фенотипу у самок мишей [8]. Відмічена гендерна різниця у формуванні каменів між чоловіками та жінками в контексті цистинурії спостерігалась у пацієнтів та розглядалась в інших місцях [27, 28]. Здається, різниця в утворенні каменів зумовлена різницею в рівні цистину в сечі, але це може бути наслідком диференціальної агрегації цистину в чоловічій та жіночій сечах [27, 29]. Тим не менше, наше дослідження демонструє, що ХХН зустрічається у вікових чоловіків Slc3a1 -/- мишей.
Мало відомо про те, які фактори впливають на фенотип цистинурії та прогресування до ХХН. [2] Ми виявили, що дієта харчується Slc3a1 -/- миші драматично вплинули на швидкість утворення каменів. Загальне лікування цистинурії включає обмеження вживання в їжу натрію та білків, збільшення споживання рідини, защеплення сечі та, можливо, навіть тіолові препарати та каптоприл [1]. Попереднє дослідження продемонструвало, що дієта з низьким вмістом білка та більшою кількістю рослинних джерел білка зменшує виведення цистину у пацієнтів із цистинурією [30]. Ми не знайшли жодних досліджень щодо ролі дієти у формуванні цистинових каменів на мишачих моделях цистинурії. Відсутні клінічні дослідження щодо впливу дієти на потенційну модифікацію цистинурії у людини [2]. Подальші дослідження можуть бути спрямовані на оцінку дієтичних змін більш контрольованим чином, щоб розібрати модифікації, які можуть уповільнити прогресування кам'яноутворення при цистинурії.
Неможливість вилучити цистин із сечі, ймовірно, змінює метаболізм цистину у всієї тварини. Нокаут Slc3a1 впливає на його експресію не тільки в нирках, але і кишечнику. Кишковий пептидний транспортер Pept1 (Slc15a1) вважається, що він дозволяє реабсорбувати цистин та інші амінокислоти з кишечника, дещо компенсуючи втрату Slc3a1 в кишечнику [31, 32]. Як це може сприяти загальній різниці статей у цистинурії та спостережуваних нами відмінностях у рівні амінокислот у плазмі, наразі невідомо.
Висновки
Ми продемонстрували, що прийом їжі може впливати на ступінь вираженості фенотипу цистинурії як щодо утворення каменів, так і розвитку ХХН на мишачій моделі цистинурії. Самці мишей виявляли більш важкий фенотип щодо маси тварин та амінокислотного складу плазми. Цистинурія впливала на склад глутатіону в печінці. У майбутніх дослідженнях систематично оцінюватимуть дієтичні компоненти на фенотип цистинурії та те, як впливає результуюча зміна метаболізму глутатіону на фізіологію та патофізіологію.
Наявність даних та матеріалів
Набори даних, використані та/або проаналізовані під час поточного дослідження, доступні у відповідного автора на обґрунтований запит.
- Гіперпротеїчна кореляція харчування BUN до азотного балансу - Повний текст
- Вживання ліпідів, харчування та коліт у пацієнтів з гематологічними злоякісними утвореннями - Повний текст
- Втручання у спосіб життя у жировій печінці (НАЖХП) - Повний текст
- Значення молочнокислих бактерій в азіатських ферментованих продуктах харчування Мікробні клітинні заводи Повний текст
- Молочні продукти при лікуванні гіпофосфатемічного рахіту - Повний текст