Механізми стійких нейробіологічних змін після впливу алкоголю у підлітків: висновки консорціуму NADIA
Фултон Т. Крюс
1 Центр вивчення алкоголю "Боулз", Медичний факультет, Університет Північної Кароліни, Чапел-Гілл, Північна Кароліна,
Доніта Л. Робінзон
1 Центр вивчення алкоголю "Боулз", Медичний факультет, Університет Північної Кароліни, Чапел-Гілл, Північна Кароліна,
Л. Джадсон Чендлер
2 Департамент неврології, Чарльстонський дослідницький центр алкоголю, Чарльстон, Південна Кароліна,
Сінді Л. Елерс
3 Департамент нейронаук, Науково-дослідний інститут Скриппса, Ла-Холла, Каліфорнія,
Патрік Дж. Малхолланд
2 Департамент нейронауки, Чарльстонський дослідницький центр алкоголю, Чарльстон, Південна Кароліна,
Субхаш К. Панді
4 Центр досліджень алкоголю в епігенетиці, кафедра психіатрії, Університет Іллінойсу в Чикаго та Медичний центр Джессі Брауна, Чикаго, штат Іллінойс,
Захарі А. Родд
5 Департамент психіатрії та Інститут психіатричних досліджень Медичної школи Університету Індіани, Індіанаполіс, Індіана,
Лінда П. Спір
6 Центр досліджень впливу алкоголю на розвиток, Програма поведінкової неврології, Департамент психології, Університет Бінгемтон, Бінгемтон, Нью-Йорк,
Х. Скотт Шварцвелдер
7 Департамент психіатрії та поведінкових наук Медичного центру університету Дюка, Дарем, Північна Кароліна,
Райан П. Ветрено
1 Центр вивчення алкоголю "Боулз", Медичний факультет, Університет Північної Кароліни, Чапел-Гілл, Північна Кароліна,
Анотація
Стійкий вплив AIE на поведінку
Експозиція AIE впливає на різноманітні поведінкові заходи, як коротко викладено нижче та більш ретельно задокументовано в останніх цілеспрямованих оглядах NADIA (Crews et al., 2016; Pandey et al., 2017; Spear, 2015, 2016a, 2016b, 2018; Spear and Swartzwelder, 2014; Варлінська та Спір, 2015).
Вживання алкоголю
Тривога
Іншим добре задокументованим ефектом AIE є підвищена соціальна тривожність у зрілому віці (Varlinskaya and Spear, 2015), виміряна за допомогою тесту соціальної взаємодії (File and Seth, 2003). Ця знахідка характерна для чоловіків (Dannenhoffer et al., 2018; Varlinskaya et al., 2014, 2017) та впливу EtOH у ранньому підлітковому віці (P25-45) порівняно з пізнім юнацьким віком (P45-60) (Varlinskaya et al., 2014). Посилена тривожна поведінка у зрілому віці після впливу АІЕ (через ip, пару, ig та самовведення) також повідомляється у підвищеному плюсовому лабіринті (Kokare et al., 2017; Kyzar et al., 2017; Pandey et al ., 2015; Sakharkar et al., 2016), світло-темна скринька (Lee et al., 2017; Pandey et al., 2015; Sakharkar et al., 2016; Slawecki et al., 2004; Vetreno et al., 2016), тест на поховання мармуру (Lee et al., 2017) та тест на відкритому полі (Coleman et al., 2014; Vetreno et al., 2014). Однак ці висновки не є універсальними, можливо, частково через індукцію дезінгібіції, про яку повідомляли у дорослих тварин після випаровування та самостійного введення АІЕ у кількох дослідженнях (Desikan et al., 2014; Ehlers et al., 2019, 2013a; Gass et al., 2014; Gilpin et al., 2012). Зокрема, загальновідомо, що поведінковий вираз тривоги та розлад може конкурувати залежно від особливостей тестової ситуації (Ennaceur, 2014). Таким чином, дані підтверджують як тривогу, так і дезінгібацію, спричинену AIE.
Навчання та гнучкість поведінки
“Блокування” підліткового фенотипу
У сукупності ці поведінкові та когнітивні дослідження показали тривалі зміни, спричинені AIE. Подібний висновок був зроблений з недавнього огляду досліджень на людях та гризунах, що вивчають фактори, що схильні до прогнозування споживання алкоголю підлітками, а також когнітивні, поведінкові та нейробіологічні наслідки впливу алкоголю у підлітків (Spear, 2018). Дані про тварин, зокрема, підтверджують гіпотезу про те, що випивка, подібна до алкоголю, має тривалий вплив на поведінку, яка може взаємодіяти з факторами, схильними до пияцтва у підлітків, але не залежить від них.
Висновок: Вплив AIE достатній для отримання багатьох поведінкових характеристик (тривожність, гнучкість поведінки, збільшення пиття та зміна реакції на алкоголь), які спостерігаються у людей із розладом вживання алкоголю (AUD). Потрібні додаткові дослідження, щоб чітко визначити внесок зловживання алкоголем у підлітків у AUD.
Постійні зміни в молекулярній нейробіології дорослих після Aie
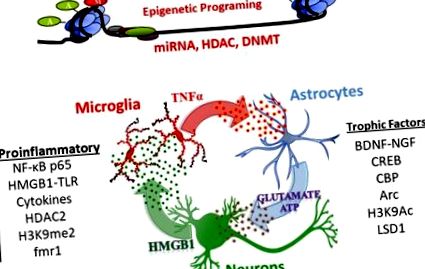
Дослідження NADIA виявили, що AIE постійно змінює нейроімунну, нейротрофічну та епігенетичну регуляцію генів, і що це ключові механізми, що лежать в основі впливу AIE на фізіологію та поведінку дорослих (огляди див. Crews et al., 2017a; Crews and Vetreno, 2016; Crews та ін., 2016; Кизар та ін., 2016; Панді та ін., 2017). Ці механізми, що включають епігенетичну регуляцію експресії генів та некодуючу РНК, особливо мікроРНК, включають передачу сигналів через нейрони, астроцити та мікроглію, що зміщують транскрипцію, із збільшенням транскрипції прозапальних генів та зменшенням транскрипції трофічних факторів.
Нейроімунна сигналізація
Епігенетичні механізми
МікроРНК (міРНК)
Невеликі мікроРНК виділяються у везикулах і передають сигнал через клітини, регулюючи синаптичну пластичність (Cohen et al., 2011). На додаток до участі miRNA у експресії генів шляхом націлювання на стабільність mRNA, miRNA та інші некодуючі РНК беруть участь у нейроімунних сигналах через TLR (Coleman et al., 2017; Crews et al., 2017b). Дослідження, проведені на мигдалинах дорослих, виявляють, що miRNA-494 взаємодіє з факторами транскрипції CREB та CBP/p300 для регулювання поведінки, подібної до тривожності (Teppen et al., 2016). Більше того, антагомір (блокатор miРНК) miRNA ‐ 494, що вводиться в центральну мигдалину, збільшує CBP/p300 та ацетилювання гістону та провокує анксіолітичні ефекти, подібні до гострого впливу EtOH у щурів (Kyzar et al., 2019b; Teppen et al., 2016). Іншим механізмом, опосередкованим miRNA, є нещодавно виявлена активація TLR7 мікроРНК let7. Рівні TLR7 підвищуються під впливом алкоголю, що сприяє нейроімунній активації (Coleman et al., 2017), і стійко підвищуються у дорослих після AIE (Crews et al., 2017b). Таким чином, індуковані AIE зміни в експресії генів включають безліч складних епігенетичних механізмів, що включають зміни прозапальних та трофічних факторів, а також гени, що беруть участь у реконструкції синапсів та нейроциркуляції.
Висновок: Експозиція AIE спричиняє тривале, стійке збільшення прозапальних нейроімунних генів, а також епігенетичних модифікуючих гістоном та ДНК ферментів та miRNA. Ці зміни, в свою чергу, можуть сприяти зниженню експресії гена трофічного фактора, що впливає на синаптичну транскриптому мозку дорослого.
Індуковані Айе зміни клітин мозку дорослих та нейроанатомія
Дослідження NADIA виявили, що вплив AIE змінює регіональну сіру та білу речовину мозку дорослого, нейрогенез мозку, холінергічні, дофамінергічні та серотонінергічні фенотипові маркери, дендритну морфологію, мікроглію, астроцити та експресію різних пептидних передавачів.
Нейронні маркери
Взаємодії глії та гліалу-нейронів
Дендритні хребти
Нейрогенез
Нейрогенез, утворення нових нейронів, триває в гіпокампі головного мозку щурів та субвентрикулярній зоні протягом усього підліткового віку і до молодого дорослого віку, забезпечуючи показник пластичності мозку. У дорослих вплив EtOH зменшує нейрогенез гіпокампа; однак абстиненція призводить до відновлення через кілька тижнів (Crews та Nixon, 2009). Навпаки, у підлітків високий рівень нейрогенезу гіпокампа, який є більш чутливим до інгібування EtOH, ніж дорослий. Дослідження NADIA в лабораторіях, використовуючи різні шляхи введення EtOH та штамів щурів, виявляють, що AIE постійно знижує нейрогенез як у гіпокампі, так і в підшлуночкових зонах (Broadwater et al., 2014; Sakharkar et al., 2016; Vetreno and Crews, 2015). Більше того, індукована AIE втрата нейрогенезу гіпокампа суттєво пов'язана зі збільшенням дезінгібуючої поведінки (Ehlers et al., 2013a). Індукована АІЕ стійка втрата нейрогенезу, швидше за все, відображає підвищену прозапальну та знижену експресію трофічного фактора (рис. 1) в гіпокампі (див. Дослідження профілактики та звороту нижче).
Структура цілого мозку
Висновок: Експозиція AIE індукує стійкі клітинні та анатомічні зміни у мозку дорослого, багато з яких спостерігались у людей з AUD. Ці клітинні та структурні зміни, ймовірно, ляжуть в основу багатьох наслідків впливу АІЕ на нейроциркуляцію та поведінку.
Індуковані Айе зміни у фізіології
Консорціум NADIA вивчав безліч фізіологічних кінцевих точок, включаючи синаптичну фізіологію гіпокампа, синаптичну фізіологію PFC, активність електроенцефалограми (ЕЕГ), параметри сну та зв'язок мозку МРТ у стані спокою та задокументував кілька специфічних та стійких ефектів, викликаних AIE (огляди див. Crews et al., 2016; Ehlers and Criado, 2010; Spear and Swartzwelder, 2014).
Синаптична фізіологія
Дофамін та прийняття рішень
Підключення до ЕЕГ, сну та стану спокою
Відповідно до електрофізіологічної десинхронізації після AIE, дослідження NADIA виявили, що AIE зменшив зв'язок МРТ у стані спокою між субрегіонами PFC, а також між PFC та смуговими регіонами (Broadwater et al., 2018). Висновки на тваринах погоджуються з дослідженнями на людях, які повідомляли про зменшення зв’язку в стані спокою у дорослого AUD (Weiland et al., 2014) та у молодих дорослих з високим ризиком із сімейною історією AUD (Weiland et al., 2013). Цікаво, що Бродуотер та його колеги (2018) також виявили, що AIE притупив гостру реакцію на зв'язок із алкоголем, додатково підтверджуючи інші висновки про зміни, спричинені AIE у реакціях дорослих на алкоголь. Втрата AIE втрати коркового зв’язку у зрілому віці узгоджується з порушенням прийняття рішень та збільшенням ризикованих рішень. Очікується, що майбутні дослідження функціональної зв’язку інтегруватимуть висновки АІЕ щурів Консорціуму NADIA до нових досліджень про підлітковий вік людини, забезпечуючи критичні зв’язки з молекулярними механізмами, які перекладаються на людей.
Висновок: AIE викликає тривалі зміни у фізіології мозку дорослих. Синаптичні маркери гіпокампа, а також ГАМКАР, калієві канали та LTP модифіковані. Зміни PFC та мезолімбічної схеми у дорослих після AIE пов’язані з когнітивними дефіцитами, такими як посилення ризику. Індуковані АІЕ зміни ЕЕГ, ЕРО, сну та функціональних зв'язків у дорослих свідчать про порушення регіональної взаємодії мозку, що може представляти собою притуплений розвиток кіркових кіл.
Попередження та усунення наслідків АНО
Зниження вмісту холінової ацетилтрансферази (ChAT) під впливом переривчастого етанолу (АІЕ) запобігає або скасовує за допомогою декількох стратегій. Кількість клітин з позитивною імунореактивністю (DCX + IR) адаптована з публікацій з нейробіології підліткового пиття у дорослому віці (NADIA), що вивчають вплив АІЕ на холінергічний фенотип. Зверніть увагу на різні шкали ординат. (A) Vetreno і Crews (2018) піддали щурів впливу AIE (післяпологовий день [P] 25-55, наприклад) і оцінили ChAT + IR на рівні P80. Добровільне колесо, що рухається від P24 до P80, одночасно і виходячи за межі експозиції AIE, запобігало індукованій AIE втраті ChAT + IR без значних змін рівнів у контрольних щурів. (B) Vetreno та його колеги (2019) піддали щурів впливу AIE (P25 - 55, наприклад) і оцінили ChAT + IR на рівні P95. Добровільне колесо, що бігало від P56 до P95, після впливу AIE повернуло назад втрату ChAT + IR, спричинену AIE, без значних змін рівнів у контрольних щурів. (C.) Vetreno і Crews (2018) піддали щурів впливу AIE (постнатальний день [P] 25-55, наприклад) і оцінили ChAT + IR на рівні P56, незабаром після AIE. Індометацин, протизапальний препарат, вводили під час АІЕ (4 мг/кг, в/в) і запобігали AIE-індукованій втраті ChAT + IR.
Висновок: Індуковані АІЕ молекулярні, синаптичні, фізіологічні та поведінкові зміни можна запобігти та/або скасувати, блокуючи індукцію прозапальних генів, інгібуючи деацетилювання гістонів та/або цілеспрямоване фармакологічне лікування.
Обговорення та короткий зміст
На закінчення, механістичні дослідження NADIA встановлюють, що запої підлітка може спричинити тривалі зміни в експресії генів мозку, синапсах, електрофізіології та морфології, а також поведінці. Вони визначили декілька відслідковуваних цілей наркотиків, які можуть бути корисними при лікуванні AUD. Нарешті, ці дослідження надають додаткову підтримку важливості для громадського здоров'я зменшення та запобігання вживання алкоголю неповнолітнім.
Фінансування
Консорціум NADIA підтримується NIH (U24AA020022, U24AA020024, U24AA024603, U24AA024605, U01AA019925, U01AA019967, U01AA019969, U01AA019970, U01AA019971, U01AA019901 U01A01A01A01 U01A.
Конфлікт інтересів
Автори не заявляють конфлікту інтересів.
Подяка
Автори дякують Діанті Лавін, MS, CMI, за допомогу з ілюстраціями та Jennie Vaughn, MSW, за допомогу в підготовці рукопису.
- Як алкоголь із нижчим вином означає менше калорій (і, можливо, набагато більше) HuffPost Life
- Як алкоголь впливає на ваш організм; Фітнес; Пісні машини
- Як хлібопекарські підприємства можуть підготуватися до змін на етикетках фактів харчування
- Зміни, пов’язані зі здоров’ям, що надходять на ваші харчові етикетки - The Suffolk Times
- Як я можу розрахувати калорії в алкогольній нутрачеці