L ‐ карнітин запобігає метаболічному стеатогепатиту у мишей з діабетом із ожирінням KK ‐ A
Кафедра гастроентерології Медичної школи університету Джунтендо, Токіо, Японія
Кафедра гастроентерології Медичної школи університету Джунтендо, Токіо, Японія
Листування: доктор Кенічі Ікедзіма, кафедра гастроентерології, Медична школа університету Джунтендо, 2‐1‐1 Хонго, Бункіо-ку, Токіо, 113‐8421, Японія. Електронна адреса: [email protected] Шукайте більше статей цього автора
Кафедра гастроентерології Медичної школи університету Джунтендо, Токіо, Японія
Кафедра гастроентерології Медичної школи університету Джунтендо, Токіо, Японія
Кафедра гастроентерології Медичної школи університету Джунтендо, Токіо, Японія
Кафедра гастроентерології Медичної школи університету Джунтендо, Токіо, Японія
Кафедра гастроентерології Медичної школи університету Джунтендо, Токіо, Японія
Кафедра гастроентерології Медичної школи університету Джунтендо, Токіо, Японія
Кафедра гастроентерології Медичної школи університету Джунтендо, Токіо, Японія
Кафедра гастроентерології Медичної школи університету Джунтендо, Токіо, Японія
Кафедра гастроентерології Медичної школи університету Джунтендо, Токіо, Японія
Листування: доктор Кенічі Ікедзіма, кафедра гастроентерології, Медична школа університету Джунтендо, 2‐1‐1 Хонго, Бункіо-ку, Токіо, 113‐8421, Японія. Електронна адреса: [email protected] Шукайте більше статей цього автора
Кафедра гастроентерології Медичної школи університету Джунтендо, Токіо, Японія
Кафедра гастроентерології Медичної школи університету Джунтендо, Токіо, Японія
Кафедра гастроентерології Медичної школи університету Джунтендо, Токіо, Японія
Кафедра гастроентерології Медичної школи університету Джунтендо, Токіо, Японія
Кафедра гастроентерології Медичної школи університету Джунтендо, Токіо, Японія
Кафедра гастроентерології Медичної школи університету Джунтендо, Токіо, Японія
Кафедра гастроентерології Медичної школи університету Джунтендо, Токіо, Японія
Анотація
Фармакологічне лікування неалкогольного стеатогепатиту, пов’язаного з метаболічним синдромом, не встановлено. Ми досліджували вплив L-карнітину, необхідної речовини для β-окислення, на метаболічний стеатогепатит у мишей.
Методи
Самців мишей KK ‐ A годували протягом 8 тижнів дієтою з високим вмістом жиру (HFD) з додаванням L-карнітину (1,25 мг/мл) у питну воду протягом останніх 4 тижнів.
Результати
Загальний рівень карнітину в сироватці крові знижувався після годування HFD, тоді як рівні практично повністю змінювались добавками L-карнітину. У мишей, яким застосовували L-карнітин, загострення стеатозу печінки та апоптозу гепатоцитів помітно запобігали, навіть незважаючи на продовження годівлі HFD. Збільшення маси тіла, а також гіперліпідемія, гіперглікемія та гіперінсулінемія після годування HFD також суттєво запобігали мишам, яким давали L-карнітин. Дієтичне харчування з високим вмістом жиру підвищеним рівнем експресії в печінці мРНК карнітинпальмітоїлтрансферази 1А; однак на виробництво β-гідроксибутирату в печінці не впливав лише HFD. На відміну від цього, лікування L-карнітином суттєво збільшило вміст β-гідроксибутирату в печінці у мишей, яких годували HFD. L-карнітин також притупляє індукцію HFD в регуляторному елементі стеролу, що зв'язує білок-1c мРНК у печінці. Крім того, L-карнітин інгібував індуковане HFD серинове фосфорилювання субстрату-1 рецептора інсуліну в печінці. L-карнітин знижує вміст вільних жирних кислот у печінці за 1 тиждень, з морфологічним покращенням набряклих мітохондрій у гепатоцитах та збільшенням вмісту аденозину в печінці 5’-трифосфату.
Висновки
L-карнітин покращує стеатогепатит у мишей KK-A, які годували HFD, швидше за все, сприяючи β-окисленню мітохондрій, нормалізуючи сигнали інсуліну та інгібуючи de novo ліпогенез у печінці. Тому передбачається, що добавки L-карнітину є перспективним підходом для профілактики та лікування пов'язаного з метаболічним синдромом неалкогольного стеатогепатиту.
Вступ
Безалкогольна жирова хвороба печінки (НАЖХП) - це широкий спектр печінкових розладів, що характеризується наявністю стеатозу печінки як за допомогою візуалізації, так і за допомогою гістології, а також відповідним виключенням інших етіологій, таких як споживання сильного алкоголю, віруси гепатиту та аутоімунітет. 1 Безалкогольний стеатогепатит (NASH) є прогресуючою формою НАЖХП, що врешті-решт призводить до цирозу печінки та раку. Захворюваність НАСГ зростає у всьому світі 2 і в даний час є третім найбільш поширеним показником для трансплантації печінки. 3 Безалкогольний стеатогепатит визнаний печінковим проявом метаболічного синдрому, оскільки ожиріння, резистентність до інсуліну та дисліпідемія вносять великий внесок у розвиток НАСГ. 4-6 Патогенез NASH все ще залишається повністю з'ясованим, а фармакотерапія NASH, пов'язаного з метаболічним синдромом, не була добре встановлена.
L-карнітин, подібний до вітаміну компонент білка, необхідний для β-окислення мітохондрій, завдяки якому вільні жирні кислоти (ФЖК) катаболізуються. 7 Системний дефіцит первинного карнітину, як правило, характеризується епізодами гіпокетотичної гіпоглікемії та гепатомегалії внаслідок стеатозу печінки з підвищеним рівнем амінотрансфераз сироватки та аміаку у немовлят, які помітно вирішуються при вживанні L-карнітину. 8 Придбаний дефіцит L-карнітину часто спостерігається у пацієнтів, які перебувають на гемодіалізі, в яких, як було доведено, добавки L-карнітину посилюють ефективність еритропоетину при нирковій анемії та покращують внутрішньодіалітичні симптоми. 9, 10 Виснаження L-карнітину також відбувається після тривалого лікування певними препаратами, такими як проліки, що генерують півалат, та вальпроєва кислота, і, як було показано, добавки L-карнітину покращують гіперамонемію у психіатричних пацієнтів, які отримують вальпроєву кислоту. 9, 11 11 Деякі клінічні дослідження нещодавно припустили потенційну ефективність L-карнітину у пацієнтів з НАЖХП. 12, 13 Повідомлялося, що L-карнітин запобігає індукованому стрептозотоцином стеатогепатиту та подальшому гепатокарциногенезу на мишачих моделях (миші STAM); Однак, вплив L-карнітину на НАСГ, пов'язаний з метаболічним синдромом, досі незрозумілий.
KK ‐ A y миші - штам, що генерується з діабетичних KK мишей шляхом введення смертельної жовтої (A y) мутації, що спричиняє абераційну експресію гена агуті в хромосомі 2. Миші KK ‐ A y виявляють фенотип, подібний до метаболічного синдрому людини, включаючи ожиріння, дисліпідемія та інсулінорезистентність у поєднанні зі спонтанним розвитком стеатогепатиту; таким чином ця тварина потенційно корисна як модель NAFLD/NASH. 15 Ми повідомляли, що миші KK ‐ A у виявляють підвищену сприйнятливість до дієтичного дефіциту метіоніну та холіну, викликаного дієтою, стеатогепатит, 16 та пошкодження печінки, спричинені ацетамінофеном. 17 Ми також повідомляли, що у мишей KK ‐ A y спостерігаються пропорційні та функціональні зміни в природних печінкових Т-клітинах-кілерах18 та порушені функції регенерації печінки після часткової гепатектомії. У 19 мишей KK ‐ A, які харчуються дієтою з високим вмістом жиру (HFD), розвивається більш важкий стеатогепатит, 20, 21, що нагадує NASH, пов’язаний з метаболічним синдромом.
Отже, метою нашого дослідження було дослідити вплив L-карнітину на стеатогепатит, пов’язаний із метаболічним синдромом, у мишей KK ‐ A, яких годували HFD.
Методи
Експерименти на тваринах
Експериментальні протоколи були затверджені Комітетом лабораторних тварин відповідно до інституційних вказівок. Самці 7-тижневих мишей KK-A y були придбані у CLEA Japan (Токіо, Японія). Протягом усього дослідження миші були розміщені в кондиціонованих приміщеннях для тварин, не містять специфічних патогенів, з освітленням від 0800 до 2000 р., І протягом 1-тижневого періоду аклімації їм надавали необмежений доступ до стандартної лабораторної чау та води. Після аклімації 8-тижневих мишей KK-A y годували HFD (HFD32; CLEA Japan) (табл. 1) протягом 8 тижнів. Після початкового 4-тижневого періоду годування деяких тварин протягом 4 тижнів лікували розчином L-карнітину гідрохлориду (1,25 мг/мл у питній воді; Otsuka Pharmaceutical Co., Ltd., Токіо, Японія). Як контролів використовували мишей KK ‐ A, яких годували нормальним чау протягом 4 тижнів. Після дієтичного лікування з добавкою L-карнітину та без неї мишей, що голодували протягом ночі, вбивали знекровленням з нижньої порожнистої вени під ефірною анестезією та отримували зразки печінки та сироватки. Зразки сироватки та тканини для приготування РНК зберігали замороженими при -80 ° C до аналізу.
| Молочний казеїн | 24.500 | Лактоза | 6.928 |
| Білок білий сушений | 5.000 | Сахароза | 6.750 |
| L-цистин | 0,430 | Вітамінна суміш | 1.400 |
| Яловичий жир | 15.880 | Мінеральна суміш | 5.000 |
| Сафлорова олія | 20.000 | Бітартрат холіну | 0,360 |
| Целюлоза | 5.500 | Бутилгідрохінон | 0,002 |
| Мальтодекстрин | 8.250 |
Гістологічний аналіз та імуногістохімія
Для гістологічної оцінки тканини печінки фіксували у 10% забуференному формаліні та вбудовували в парафін, а також проводили фарбування гематоксилін-еозином. Продукт розщеплення каспази цитокератину (ccCK) 18 був виявлений за допомогою імуногістохімії з використанням моноклональних антитіл M30 CytoDEATH (Roche, Базель, Швейцарія), як описано раніше. 22 Коротко, депарафінізовані зрізи тканин інкубували з моноклональним антитілом проти M30 та вторинним біотинільованим антимишачим імуноглобуліном G, а специфічне зв’язування візуалізували за допомогою комплексного розчину авідин-біотину з наступною інкубацією з розчином тетрагідрохлориду 3, 3-діамінобензидину з використанням розчину Набір Vectastain Elite ABC (Vector Laboratories, Берлінгейм, Каліфорнія, США). Зразки спостерігали під оптичним мікроскопом (DM7000; Leica, Wetzlar, Німеччина), обладнаному цифровою мікроскопічною камерою (MC120HD; Leica), і цифрові зображення фіксували.
Аналіз електронним мікроскопом
Частину зразка печінки занурювали у фіксатор, що містить 3% глутаральдегіду, у 0,1 моль/л фосфатного буфера (рН 7,4) при 4 ° С на 24 год. Готували надтонкі зрізи печінки та спостерігали за допомогою просвічувальної електронної мікроскопії, як описано раніше. 23
Біохімія крові
Рівні аспартатамінотрансферази, аланінамінотрансферази, тригліцеридів та глюкози в сироватці крові визначали за допомогою системи Fuji DRI-CHEM (Fuji Film Medical Co. Ltd., Токіо, Японія).
Вимірювання карнітину
Загальний вміст сироватки та вільний карнітин вимірювали методом ферментативного циклу, використовуючи комерційні набори (KAINOS Laboratories Inc., Токіо, Японія), дотримуючись інструкцій виробника. Ацил-карнітин розраховували як різницю між загальним та вільним карнітином.
Вимірювання FFA
Вміст FFA у сироватці та печінці вимірювали за допомогою ферментного методу, використовуючи набір для кількісної оцінки вільних жирних кислот (BioVision, Milpitas, CA, USA), дотримуючись інструкцій виробника. Кількість вмісту FFA в печінці нормалізували за вагою зразків тканин.
Вимірювання кетонових тіл
Вимірювали β-гідроксибутират у тканині печінки за допомогою флуорометричного аналізу β-гідроксибутирату (кетонового тіла) (Cayman Chemical Company, Ann Arbor, MI, USA). Коротко кажучи, 50 мг тканини печінки гомогенізували в 300 мл буфера з використанням тефлонового гомогенізатора. Гомогенат змішували з еквівалентним об'ємом 1 моль/л метафосфорної кислоти і центрифугували при 10000 g протягом 5 хв. Гранулу розчиняли в 60 мкл 5 моль/л розчину карбонату калію. Після центрифугування при 10000 g протягом 5 хв супернатант збирали і 25 мкл супернатанту потім змішували з рівним об'ємом розчину β-гідроксибутиратдегідрогенази. Після 30 хв інкубації при 37 ° C флуоресценцію вимірювали за допомогою флуоресцентного спектрофотометра з довжиною хвилі збудження та випромінювання 530–540 нм та 585–595 нм відповідно. Кількість вмісту β-гідроксибутирату в печінці нормалізували за вагою зразків тканин.
Вимірювання аденозину 5’-трифосфату
Вміст аденозину 5’-трифосфату (АТФ) у тканині печінки вимірювали за допомогою аналізу люциферази, використовуючи набір для аналізу АТФ для тканин тварин (TOYO B-Net Co., Ltd., Токіо, Японія), дотримуючись інструкцій виробника.
Імуноферментний аналіз
Рівні інсуліну в сироватці крові вимірювали за допомогою набору імуноферментного аналізу мишачого інсуліну (ELISA) (Інститут біологічних наук Морінага, Інк., Канагава, Японія). Фосфорилювання серинового субстрату рецептора інсуліну (IRS) ‐1 в тканині печінки визначали за допомогою набору PathScan Phospho-IRS ‐ 1 (Ser307) Sandwich ELISA Kit (Cell Signaling Technology, Danvers, MA, USA).
Підготовка РНК та ланцюгова реакція зворотної транскрипції – полімерази в режимі реального часу
Статистичний аналіз
Морфометричний та денситометричний аналізи проводили за допомогою Scion Image (версія Beta 4.0.2; Scion Corp., Фредрік, доктор медичних наук, США). Дані були виражені як середнє значення ± стандартна похибка середнього значення. Статистичні відмінності середніх значень визначали з використанням односторонньої anova або Kruskal – Wallis anova за рангами з подальшою процедурою парного множинного порівняння (метод Стьюдента – Ньюмена – Кельса). P
Результати
L-карнітин пригнічує збільшення маси тіла та підвищує рівень карнітину в сироватці крові у мишей KK ‐ A
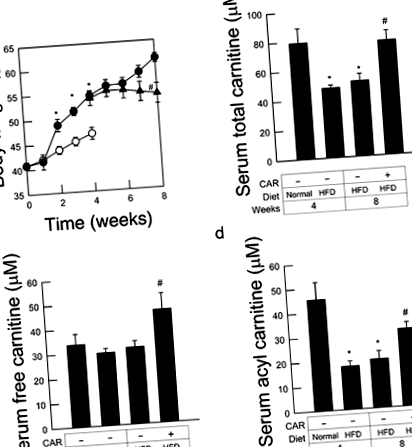
Миші KK ‐ A з високим вмістом жиру, що харчуються дієтою, швидко набирали масу тіла, значення досягали 54,5 ± 0,9 г та 61,4 ± 0,9 г відповідно через 4 та 8 тижнів. Лікування L ‐ карнітином, розпочате після 4 тижнів попереднього вигодовування, суттєво запобігало збільшенню маси тіла майже повністю, а значення через 8 тижнів після годування HFD досягали лише 54,2 ± 2,0 г (P
Для оцінки стану недостатності карнітину ми вимірювали загальний і вільний рівні карнітину в сироватці крові. Загальний рівень карнітину був значно нижчим у мишей KK ‐ A, яких годували HFD протягом 4 тижнів, порівняно з мишами, які отримували контрольну дієту. Однак рівень карнітину без сироватки крові, який відображає кількість споживання та синтезу їжі в печінці/нирках, 9 не знижувався після годування HFD. У свою чергу, рівень ацил-карнітину в сироватці крові був значно нижчим у мишей, що годувались HFD, що вказує на те, що системне споживання карнітину збільшувалося при годуванні HFD. Як і слід було очікувати, загальний рівень карнітину був підвищений майже до базального рівня, коли мишам давали L-карнітин протягом 4 тижнів поспіль. Лікування L-карнітином також суттєво збільшило як ацил, так і вільний карнітин (рис. 1b – d).
L-карнітин покращує стеатоз печінки у мишей KK ‐ A
Як і слід було очікувати, масивне накопичення жиру в гепатоцитах із балонною дегенерацією спостерігалось через 8 тижнів після годування HFD, що було різко запобігнуто введенням L-карнітину (рис. 2а – г). Співвідношення печінка/тіло було збільшено через 8 тижнів після годування HFD, тоді як рівні значно зменшились у мишей, яким давали L-карнітин (P
L-карнітин запобігає індукованому HFD апоптоз гепатоцитів у мишей KK ‐ A
Для оцінки апоптозу гепатоцитів проводили імуногістологічне фарбування на ccCK18 з використанням антитіла M30 CytoDEATH. Дієтичне годування з високим вмістом жиру збільшило кількість позитивних клітин на ccCK18 до 20,9 ± 1,8 на поле через 4 тижні, з подальшим збільшенням до 41,6 ± 0,9% через 8 тижнів (P
L-карнітин запобігає гіперліпідемії після пригнічення de novo ліпогенезу та активації β-окислення
У KK ‐ A у мишей годування HFD протягом 8 тижнів значно підвищувало рівень FFA та тригліцеридів у сироватці до 170,1 ± 14,9 мкмоль/л та 347,0 ± 66,8 мг/дл, які були значно зменшені при обробці L-карнітином до 65,1 ± 7,1 мкмоль/L та 71,0 ± 4,3 мг/дл відповідно (P 25 та оцінювали вироблення β-гідроксибутирату в печінці. Вплив HFD значно збільшив експресію мРНК CPT1A (рис. 4г), але не збільшив β-гідроксибутират у печінці через 8 тижнів. Лікування L-карнітином помітно збільшило β-гідроксибутират до значень більш ніж удвічі більше, ніж у мишей, яких годували HFD протягом 8 тижнів (P
L-карнітин покращує гіперглікемію та гіперінсулінемію у мишей KK-A, що годуються HFD
Дієтичне харчування з високим вмістом жиру суттєво збільшило рівень глюкози та інсуліну в сироватці натще до 468,8 ± 64,5 мг/дл та 37,3 ± 5,5 нг/мл відповідно через 8 тижнів, що було значно зменшено при лікуванні L-карнітином до 217,2 ± 30,0 мг/дл. та 4,4 ± 1,3 нг/мл відповідно (P
L-карнітин зменшує вміст FFA та покращує морфологію мітохондрій та продукцію АТФ у печінці
Через 1 тиждень лікування L-карнітин значно зменшив вміст FFA в печінці, збільшений при годуванні HFD (P
Обговорення
L-карнітин помітно запобігав надмірній експресії мРНК SREBP-1c, індукованій введенням HFD (рис. 4c), що є основним фактором транскрипції, що регулює de novo ліпогенез. 28 Оскільки сигнальний шлях інсуліну за участю IRS-2/фосфоїнозитид 3-кінази позитивно регулює експресію SREBP1c, 29 гіперінсулінемія, швидше за все, сприяє підвищенню регуляції SREBP1c у KK ‐ A у печінці миші. Тому висувається гіпотеза, що L-карнітин знижує експресію SREBP1c, принаймні частково, за рахунок нормалізації гіперінсулінемії (рис. 5b).
На закінчення, L-карнітин значно покращує дієтичний стеатогепатит у мишей KK ‐ A у поєднанні з поліпшенням метаболічних відхилень. Основні механізми, швидше за все, включають збільшення β-окислення мітохондріального L-карнітину, що зменшує надлишковий вміст FFA в печінці, послаблюючи тим самим ліпотоксичність, яка спричиняє метаболічні відхилення та клітинні пошкодження гепатоцитів. Тому передбачається, що добавки L-карнітину є перспективним підходом для профілактики та лікування метаболічного синдрому NASH.
- Метаболічні ефекти комплексу гелю алое вера при ожирінні переддіабеті та діабетику, що не лікувався на ранніх стадіях
- Низькому індексу маси тіла при ендометріозі сприяє метаболічна дисфункція печінки у мишей
- Метаболічна інженерія лактатдегідрогенази рятує мишей від ацидозу Наукові звіти
- MD Medical Group відкриває нову лікарню в Новосибірську 17 лютого 2017 року - MD Medical Group Mother and
- Як допомогти огрядній собаці схуднути