Метаболічна інженерія лактатдегідрогенази рятує мишей від ацидозу
Предмети
Анотація
Ацидоз спричиняє мільйони смертей щороку, і стратегії нормалізації рН крові у хворих на ацидоз дуже потрібні. Шлях лактатдегідрогенази (ЛДГ) має великий потенціал для лікування ацидозу завдяки своїй здатності перетворювати протони та піруват у лактат і тим самим підвищувати рН крові, але складно перерости у терапію, оскільки не існує підходів на основі фармацевтичної інженерії метаболізму шляхи in vivo. У цьому звіті ми демонструємо, що метаболічний потік шляху LDH може бути сконструйований із з'єднанням 5-аміно-2-гідроксиметилфенілборної кислоти (ABA), яка зв'язує лактат і прискорює споживання протонів шляхом перетворення пірувату в лактат і збільшення НАД Відношення +/NADH. Тут ми демонструємо, що ABA може врятувати мишей від індукованого метформіном ацидозу, зв’язуючи лактат і збільшуючи рН крові з 6,7 до 7,2 та співвідношення NAD +/NADH у крові в 5 разів. ABA - це перший клас молекул, який може метаболічно інженерно розвивати шлях LDH і може мати значний вплив на медицину, враховуючи велику кількість пацієнтів, які страждають на ацидоз.
Вступ
Рівень смертності від ацидозу серед критично хворих становить 50%. Ацидоз спричинений дисфункцією мітохондрій при виробленні АТФ, що призводить до накопичення протонів 1. Сучасна терапія молочнокислого ацидозу - лікування бікарбонатом, яке є неефективним через численні токсичні побічні ефекти, такі як зміна артеріального тиску, активація апоптозу та зміна рівня внутрішньоклітинного рН 2,3,4,5. Дихлорацетат є потенційним засобом лікування ацидозу, який посилює активність піруватдегідрогенази та блокує вироблення лактату, проте він також не ефективний, оскільки спричиняє нейропатію 6. Тому існує велика потреба у розробці стратегій, які можуть підвищити рН крові у пацієнтів, які страждають на ацидоз 6,7,8,9 .
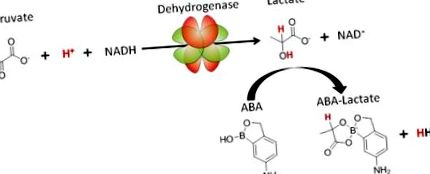
У цьому звіті ми представляємо нову стратегію лікування ацидозу на основі сполуки ABA, яка пов'язує лактат і нормалізує рН крові за рахунок збільшення споживання протонів шляхом LDH. Механізм, за допомогою якого ABA лікує ацидоз, показаний на малюнку 1. ABA утворює двовалентний комплекс з лактатом і тим самим зменшує внутрішньоклітинну концентрацію лактату, зміщуючи рівновагу у бік виробництва більшої кількості лактату, що призводить до споживання протонів шляхом гідрування пірувату. Важливо, що АБК є специфічним для лактату в порівнянні з іншими метаболітами, такими як глюкоза, через його орто-гідроксил, який перешкоджає зв’язуванню цис-діолів 10. Крім того, ABA також збільшує співвідношення NAD +/NADH, що також має численні терапевтичні ефекти, такі як захист від апоптозу та придушення запалення.
5-аміно-2-гідроксиметилфенілборна кислота (ABA) метаболічно формує шлях лактатдегідрогенази і є терапією для лактоацидозу.
ABA пов'язує лактат і нормалізує рН крові, зміщуючи рівновагу шляху LDH у бік споживання протонів (показано червоним), пірувату та генерації NAD + .
Результати
ABA було визначено як терапевтичний засіб для лікування ацидозу через його потенційну здатність зв’язувати лактат. Тому ми провели експерименти, щоб визначити, чи утворює ABA стійкий комплекс з лактатом. Комплекс ABA-лактат утворився змішуванням 100 мкмолей ABA і лактату в 1 мл метанолу протягом 10 хв. Потім ABA-лактатний комплекс виділяли за допомогою препаративної ТШХ, в етилацетаті та проводили мас-спектрометрію ESI на ізольованому ABA-лактатному комплексі. Отримано експериментальну молекулярну масу 220,0786, яка корелювала з прогнозованим m/z 220,0786 і, отже, припускає, що ABA утворює стійкий комплекс з лактатом.
Ми також досліджували, чи може ABA зв’язувати лактат у присутності інших метаболітів, присутніх у сироватці крові, за допомогою ядерно-магнітного резонансу бору (ЯМР). ABA та L-лактат натрію додавали до 500 мкл 10% фетальної бичачої сироватки в модифікованому середовищі орела Дульбекко (DMEM) та аналізували за допомогою ЯМР бору. Малюнок 2B демонструє, що ABA пов'язує лактат у присутності метаболітів, що містяться у бичачій сироватці плода та DMEM. Наприклад, ароматичний бор ABA в сироватці має пік ЯМР при δ = 29, і він зміщується до δ = 9 у присутності лактату та сироватки, демонструючи специфічне комплексоутворення з лактатом. Зсуви піків, отримані в результаті цих експериментів, корелювали із зсувами піків, отриманими від ЯМР бору синтетичного стандарту ABA-лактату (виділеного за допомогою препаративної ТШХ). Ці дані демонструють, що ABA специфічно комплексує з лактатом і не зв'язує жоден з метаболітів, які зазвичай містяться в сироватці крові та DMEM 10 .
ABA пов'язує лактат, збільшує співвідношення NAD +/NADH та споживання пірувату.
(A) ЯМР бору виділеного комплексу ABA-лактату. Вільний ABA має пік бору при δ = 29 (синій пік), який зсувається до δ = 9 для ABA-лактатного комплексу (червоний пік). (B) ABA пов'язує лактат натрію у присутності 10% сироватки, як визначено за допомогою ЯМР бору. Вільний ABA в сироватці має пік бору при δ = 29 (синій пік), який зсувається до δ = 9 у присутності еквімолярного лактату (червоний пік). (C) ABA збільшує співвідношення NAD +/NADH у два рази в клітинах RAW 264,7. Клітини інкубували з 0,1 М PBS або 5 мМ ABA протягом 5 хв, збирали клітинні лізати та вимірювали співвідношення NAD +/NADH у клітинних лізатах. (D) ABA знижує рівень пірувату в два рази в клітинах RAW 264,7. Клітини інкубували з 0,1 М PBS або 5 мМ ABA протягом 5 хв, збирали клітинні лізати та вимірювали рівні пірувату в клітинних лізатах.
Щоб ABA ефективно метаболічно розробляв шлях LDH, він повинен потрапляти в клітини. Тому ми вимірювали Log D ABA, використовуючи вимірювання поглинання при 330 нм в аналізі розподілу октанол/вода. ABA має Log D 0,80 ± 0,03, що свідчить про те, що ABA має бути проникною для клітинної мембрани. Здатність ABA посилювати споживання пірувату та NADH досліджували в клітинах RAW 264,7. 10 6 клітин RAW 264,7 інкубували з 5 мМ ABA протягом 5 хв, і клітини лізували, гомогенізували та відокремлювали від білків для аналізу вмісту пірувату, NAD + та NADH. Рисунок 2C демонструє, що ABA збільшує співвідношення NAD +/NADH удвічі, а малюнок 2D демонструє, що рівні пірувату знижуються в 2 рази, тим самим припускаючи, що ABA може каталізувати детоксикацію протонів.
ABA призначений для зниження рівня лактату під час ацидозу шляхом зв'язування лактату і тим самим спрямовуючи метаболічний шлях ЛДГ на споживання надлишку протонів. Тому ми дослідили, чи може ABA зв’язувати лактат in vivo та зменшувати його концентрацію в крові. 11 мкмолей ABA у 100 мкл фізіологічного розчину вводили мишам через хвостову вену і через 10 хв їх кров аналізували на вміст лактату та порівнювали з контролем. Фігура 3А демонструє, що ABA може знижувати рівень лактату в крові, наприклад, рівень лактату в крові у здорових мишей становив 2 ± 0,5 мМ, однак у мишей, які отримували ABA, рівень лактату в крові зменшився в 3 рази і був знижений до 500 ± 200 мкМ . ABA може знизити рівень позаклітинного лактату в три рази протягом 10 хв. Цей швидкий ефект є важливим для лікування ацидозу через швидкі часові рамки, коли підвищений рівень протону в крові спричинює смерть. Важливо, що при цій дозі ABA не спричиняла втрати ваги у мишей протягом трьох днів, і ми не спостерігали змін у рівні лактату/пірувату мозку, рівні NAD +/NADH або рН крові (цифри 3B, 4C).
ABA знижує рівень лактату in vivo і має мінімальну токсичність.
(A) ABA знижує рівень лактату в крові у здорових мишей. 11 мкмолей ABA в PBS або PBS вводили мишам внутрішньовенно, а через 10 хв виділяли плазму та визначали рівень лактату. (B) ABA має мінімальну токсичність для мишей. Мишам вводили 100 мг/кг ABA у 100 мкл PBS або 100 мкл PBS через хвостову вену, і їх втрату ваги вивчали протягом трьох днів. Стандартне відхилення представлене як середнє значення ± с.д.д. n = 3. n.s. = не значуще.
ABA рятує мишей від індукованого метформіном ацидозу.
Обговорення
Лікування молочнокислого ацидозу є основною проблемою в медицині, а медичне навантаження, спричинене молочнокислим ацидозом, порівнянне з раком та ВІЛ, проте в даний час відсутні ліки для лікування ацидозу. Традиційні фармацевтичні підходи до лікування ацидозу були зосереджені на пригніченні швидкості вироблення лактату через пригнічення циклу Кребса і мали проблеми з токсичністю через центральну роль циклу Кребса в обміні речовин. Крім того, буферизація рН крові шляхом введення бікарбонатів була невдалою через токсичні побічні ефекти. Тому дуже необхідна розробка фармацевтичних стратегій, які можуть підвищити рН крові у пацієнтів, які страждають на ацидоз.
У цьому звіті ми демонструємо, що молочнокислий ацидоз можна лікувати за допомогою інженерних метаболічних потоків протонів та пірувату шляхом комплексування лактату з похідним фенілборної кислоти ABA. Введений внутрішньовенно ABA зміг врятувати мишей від індукованого метформіном ацидозу шляхом підвищення рівня рН та співвідношення NAD +/NADH у крові. Тому ABA може запропонувати потенційне лікування лактатного ацидозу завдяки своїй унікальній здатності зв’язувати лактат і відновлювати рН крові. ABA - це перший клас молекул, який може метаболічно інженерно розвивати шлях LDH і може мати значний вплив на медицину, враховуючи велику кількість пацієнтів, які страждають на ацидоз.
Методи
ABA специфічно пов'язує лактат
Здатність ABA зв'язувати лактат і утворювати стабільний комплекс визначали за допомогою ЯМР бору та мас-спектрометрії. 100 мкмолей ABA і L-лактату натрію змішували в 1 мл метанолу і проводили підготовчу ТШХ в етилацетаті. Кремнеземну смугу, що містить ABA-лактатний комплекс (Rf = 0,1), видаляли і комплекс екстрагували у воду та концентрували за допомогою роторного випарника. Електророзпилювальну іонізацію в режимі негативних іонів проводили на ізольованому комплексі для отримання його маси (QB3/Chemistry Mass Spectrometry Facility, Університет Каліфорнії, Берклі). Ми також провели ЯМР бору на ізольованому комплексі ABA-лактат, щоб отримати еталонні спектри ЯМР бору (фігура 2А). Препаративний TLC-виділений ABA-лактатний комплекс повторно суспендували в 500 мкл води. Потім цей розчин додавали в кварцову ЯМР-пробірку (Fisher Scientific) і проводили ЯМР бору, використовуючи ЯМР Брукера 400 МГц (n = 8 сканувань).
Здатність ABA зв'язувати лактат у присутності інших метаболітів визначали за допомогою ЯМР бору. 11 мкмоль ABA та 11 мкмоль L-лактату натрію розчиняли у 500 мкл 10% фетальної бичачої сироватки у модифікованому середовищі орлиного дубля (DMEM) Дульбекко. Потім цей розчин додавали в кварцову ЯМР-пробірку (Fisher Scientific) і проводили ЯМР бору, використовуючи ЯМР Bruker на 400 МГц (n = 8 сканувань). В якості контролю 11 мкмолей ABA розчиняли в 500 мкл 10% фетальної бичачої сироватки в модифікованому середовищі орел Дульбекко (DMEM), і ЯМР бору проводили на ЯМР Bruker на 400 МГц (n = 8 сканувань).
ABA - проникна клітинна мембрана
Журнал D ABA вимірювали за допомогою аналізу розподілу октанол/вода. 500 мкл ABA в 0,1 М PBS при концентрації 1 мг/мл додавали до 500 мкл октанолу (Sigma Aldrich) в епендорфській пробірці і обробляли ультразвуком в обробці ультразвуком протягом 1 години. Потім пробірку центрифугували протягом 5 хв при 1000xGs та інкубували протягом 16 годин при кімнатній температурі. 100 мкл PBS та октанолу піпетували в окремі лунки 96-лункової пластини (VWR), поглинання вимірювали при 330 нм за допомогою зчитувача планшетів Tecan i4 і визначали log D (n = 3).
Загальна клітинна культура
Клітини RAW 264,7 культивували в колбах Т-25 в середовищах для культивування клітин, що складаються з DMEM і 10% фетальної бичачої сироватки. Клітини пасували кожні 3-і день шляхом ресуспендування клітин за допомогою скребка для клітин (Fisher Scientific) та центрифугування клітин при 300XGs протягом 5 хв. Надосадову рідину видаляли, а клітини потім ресуспендували в культуральних середовищах клітин. Клітини підраховували за допомогою гемоцитометра (Fisher Scientific) і використовували для подальших експериментів, описаних нижче.
ABA споживає піруват і збільшує співвідношення NAD +/NADH
Здатність ABA споживати піруват і збільшувати співвідношення NAD +/NADH визначали інкубацією ABA з клітинами RAW 264,7. 5 мМ ABA в 200 мкл середовища культури клітин додавали до 10 6 клітин RAW 264,7 і інкубували протягом 5 хв. Потім клітини центрифугували при 300XGs протягом 5 хв і супернатант відкидали. Клітини лізували, використовуючи 500 мкл буфера лізису клітин, забезпеченого набором для кількісного визначення NAD +/NADH (Sigma Aldrich). Потім клітини фільтрували через центрифужний фільтр на 10 кДа (Millipore) шляхом центрифугування при 10000XGs протягом 5 хв. Кількісно визначали піруват у фільтраті за допомогою набору для кількісного визначення пірувату (Abcam Inc.), а співвідношення NAD +/NADH визначали за допомогою набору для кількісного визначення NAD +/NADH згідно з протоколом виробника. Для вимірювання показань поглинання та флуоресценції використовували зчитувач пластин Tecan i4.
ABA знижує рівень лактату in vivo
6–8 тижнів самок мишей C57BL6/j використовували для всіх досліджень відповідно до протоколу R348 на тваринах, затвердженого Каліфорнійським університетом. 100 мкл PBS, що містить 11 мкмоль ABA, вводили мишам через хвостову вену. Через 10 хв на мишах проводили серцеву пункцію, їх кров екстрагували та центрифугували при 10000XG протягом 10 хв для виділення плазми. Для вимірювання концентрації лактату в плазмі використовували набір для аналізу лактату (Abcam Inc.).
ABA знижує рівень лактату в крові при лактоацидозі, викликаному метформіном
Статистичний аналіз
Статистичний аналіз проводили за допомогою t-критерію студента, а значення p для кожного експерименту визначали за допомогою програмного пакету Excel (Microsoft Office 2010). Статистично значущі дані (с
Список літератури
Гочачка, П. В. і Моммзен, Т. П. Протони та анаеробіоз. Наука 219, 1391–1397 (1983).
Козені, Г. А. та ін. In vivo ефекти гострих змін осмоляльності та концентрації натрію на скоротливість міокарда. Am Heart J. 109, 290–296 (1985).
Cooper, D. J., Walley, K. R., Wiggs, B. R. & Russell, J. A. Бікарбонат не покращує гемодинаміку у критично хворих пацієнтів з лактоацидозом. Проспективне, контрольоване клінічне дослідження. Ann Intern Med. 112, 492–498 (1990).
Grundler, W., Weil, M. H. & Rackow, E. C. Артеріовенозний діоксид вуглецю та градієнти рН під час зупинки серця. Тираж 74, 1071–1074 (1986).
Kette, F., Weil, M. H., von Planta, M., Gazmuri, R. J. & Rackow, E. C. Буферні агенти не зворотять інтраміокардіальний ацидоз під час серцевої реанімації. Тираж 81, 1660–1666 (1990).
Кауфманн, П. та ін. Дихлорацетат викликає токсичну нейропатію при MELAS: рандомізоване, контрольоване клінічне дослідження. Неврологія 66, 324–330 (2006).
Fall, P. J. & Szerlip, H. M. Лактоацидоз: від кислого молока до септичного шоку. J Інтенсивна терапія Med. 20, 255–271 (2005).
Luft, D., Deichsel, G., Schmulling, R. M., Stein, W. & Eggstein, M. Визначення клінічно значущого лактатного ацидозу у пацієнтів із внутрішніми захворюваннями. Am J Clin Pathol. 80, 484–489 (1983).
Ренда, Ф. та ін. Метформін-асоційований молочнокислий ацидоз, що вимагає госпіталізації. Національне 10-річне опитування та систематичний огляд літератури. Eur Rev Med Pharmacol Sci., 45–49 (2013).
Sartain, F. K., Yang, X. & Lowe, C. R. Комплексування L-лактату з борними кислотами: розчин та голографічний аналіз. Хімія 14, 4060–4067 (2008).
Петерс, Н. та співавт. Метформін-асоційований молочнокислий ацидоз у відділенні інтенсивної терапії. Crit Care 12, R149 (2008).
Місбін, Р. І. та ін. Лактоацидоз у пацієнтів з діабетом, які отримують метформін. N Engl J Med. 338, 265–266 (1998).
Снелл, А. М. і Рот, Г. М. Молочна кислота крові при печінковій хворобі. J Clin Invest. 11, 957–971 (1932).
Fendt, S. M. та співавт. Метформін зменшує окислення глюкози та збільшує залежність клітин раку простати від відновного метаболізму глютаміну. Рак Res. 73, 4429–4438 (2013).
Подяка
Ця робота була підтримана такими грантами для NM від NIH, 1R01HL096796-02, U01 268201000043C-0-0-1, 1R01HL090601-02, 1R21AI098799-01, R01 AI088023-03.
Інформація про автора
Приналежності
306 Стенлі Холл, Департамент біоінженерії, Каліфорнійський університет, 306 Стенлі Холл, Берклі, Каліфорнія, 94720
Абхінав П. Ачарія, Мохаммад Рафі, Елліот К. Вудс, Остін Б. Гарднер та Нірен Мурті
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Ви також можете шукати цього автора в PubMed Google Scholar
Внески
А.П.А. проводив дослідження зв'язування, експерименти in vitro, експерименти in vivo та підготовку рукописів. М.Р. проводили експерименти in vivo. А.Б.Г. та E.C.W. виконували дослідження зв’язування. Н.М. керував дослідженнями та сприяв підготовці рукописів. Усі автори обговорили результати та прокоментували рукопис.
Декларації про етику
Конкуруючі інтереси
Автори заявляють про відсутність конкуруючих фінансових інтересів.
- L ‐ карнітин запобігає метаболічному стеатогепатиту у хворих на діабетичних мишей KK ‐ Ay - Kon - 2017 -
- Низькому індексу маси тіла при ендометріозі сприяє метаболічна дисфункція печінки у мишей
- Ось; s Як риб’ячий жир змушує мишей худнути
- Hill s® Diet Diet® Metabolic Feline - консерви
- Дієтичне регулювання ваги за рецептом Hill's за допомогою сухих кормів для котів океанської риби - Відгуки покупців