Короткотермінові результати для живих донорів нирок із ожирінням та їх реципієнтів 1, 2, 3, 4, 5, 6
Пітер П. Різ
Університет Пенсільванії, відділ нирок, Медичний факультет, 3400 Spruce Street, Філадельфія, Пенсільванія, 19104
b Університет Пенсільванії; Центр клінічної епідеміології та біостатистики, 3461 Locust Walk, Філадельфія, Пенсильванія, 19104
c Університет Пенсільванії, Інститут економіки здоров'я ім. Леонарда Девіса, 3900 Вудленд-авеню, Філадельфія, Пенсільванія, 19104
Гарольд І. Фельдман
Університет Пенсільванії, відділ нирок, Медичний факультет, 3400 Spruce Street, Філадельфія, Пенсільванія, 19104
b Університет Пенсільванії; Центр клінічної епідеміології та біостатистики, 3461 Locust Walk, Філадельфія, Пенсильванія, 19104
c Університет Пенсільванії, Інститут економіки здоров'я ім. Леонарда Девіса, 3900 Вудленд-авеню, Філадельфія, Пенсільванія, 19104
Девід А. Еш
b Університет Пенсільванії; Центр клінічної епідеміології та біостатистики, 3461 Locust Walk, Філадельфія, Пенсильванія, 19104
c Університет Пенсільванії, Інститут економіки здоров'я ім. Леонарда Девіса, 3900 Вудленд-авеню, Філадельфія, Пенсільванія, 19104
Арвін Томассон
b Університет Пенсільванії; Центр клінічної епідеміології та біостатистики, 3461 Locust Walk, Філадельфія, Пенсильванія, 19104
Джастін Шультс
b Університет Пенсільванії; Центр клінічної епідеміології та біостатистики, 3461 Locust Walk, Філадельфія, Пенсильванія, 19104
Рой Д. Блум
Університет Пенсільванії, відділ нирок, Медичний факультет, 3400 Spruce Street, Філадельфія, Пенсільванія, 19104
Анотація
Передумови
Враховуючи зв'язок між ожирінням та захворюваннями нирок, фахівці з трансплантації обговорювали доцільність прийому живих донорів нирок із ожирінням. Ми висунули гіпотезу, що у порівнянні з донорами нормальної ваги донори з підвищеним індексом маси тіла (ІМТ) матимуть 1) більше повторних операційних повторних прийому та повторних операцій та 2) більший ріст артеріального тиску, більший відсоток підвищення рівня креатиніну в сироватці крові, а також більшу втрату передбачуваної швидкості клубочкової фільтрації (eGFR) після нефректомії.
Методи
Ретроспективне когортне дослідження з використанням даних Мережі заготівлі та трансплантації органів на живих донорах, які здали нирки з 01.07.2004 р. По 31.12.2005 р.
Результати
Проведено 9319 трансплантацій нирок живим донорам. Після усунення донорів з відсутніми даними про ІМТ було проаналізовано 5304 донорів, серед яких 2108 (40,0%) мали надлишкову вагу (25 ≤ ІМТ = 35). Показники повторного прийому та повторної операції не відрізнялись у різних категоріях ІМТ донорів. На початковому етапі та через 6 місяців після нефректомії вищий ІМТ був пов’язаний із вищим артеріальним тиском (p Ключові слова: живий донор, ожиріння, трансплантація нирки
Передумови
Збільшення часу очікування на трансплантацію померлої донорської нирки та найкращі результати трансплантації живих донорів призвели до збільшення обсягів трансплантації живих донорів у Сполучених Штатах (США) за останнє десятиліття (1). Однак визнання зростаючого індексу маси тіла (ІМТ) фактором ризику хронічної хвороби нирок (ХХН) викликало занепокоєння щодо доцільності прийому живих донорів нирок із ожирінням (2–4). Відображаючи цю невизначеність щодо живих донорів нирок із ожирінням, існує велика різниця у політиці центру трансплантації щодо виключення донорів на основі ІМТ (5).
Ожиріння давно визнано причиною протеїнурії та гломерулярних захворювань, а також може спричинити захворювання нирок опосередковано через гіпертонію або діабет (6, 7). Дослідження серед загальної популяції також продемонстрували підвищений ризик розвитку ХХН із ожирінням навіть після корекції артеріального тиску та діабету (8–11). Біопсії пацієнтів із ожирінням зазвичай виявляють клубочкові зміни, такі як гломеруломегалія та збільшення мезангіального матриксу (7, 12). Крім того, фізіологічні дослідження показали, що у пацієнтів із ожирінням спостерігається клубочкова гіперфільтрація та підвищення вимірюваної швидкості клубочкової фільтрації (mGFR) (13, 14). Примітно, що після нефректомії, як відомо, живі донори нирок мають компенсаторну гіперфільтрацію в іншій нирці (15). Отже, живий донор із уже існуючою гіперфільтрацією, пов’язаною з ожирінням, може мати зменшену здатність проходити подальшу адаптивну гіперфільтрацію після нефректомії порівняно з донором із нормальною вагою.
Хоча довгострокові дослідження показують, що донорська нефректомія не збільшує ризик смертності або термінальної стадії ниркової хвороби (ESRD), мало що відомо про результати лікування донорів нирок із надмірною вагою та ожирінням (16–21). Звіти одного центру свідчать, що живі донори з ожирінням мають вищий рівень перопераційних ускладнень, таких як ранні інфекції (2, 3). Дослідження переважно живих донорів із Кавказу в клініці Мейо показало, що підвищення ІМТ було пов’язане з підвищенням артеріального тиску до і після нефректомії порівняно з донорами нормальної ваги (2). Мета-аналіз, який вивчав результати для живих донорів із ожирінням, виявив, що зміна ШКФ після нефректомії не була більшою, ніж серед донорів, які не страждають ожирінням (22–24).
Основною метою цього дослідження було порівняння короткотермінових результатів для живих донорів за категорією ІМТ у центрах трансплантації нирок у США. Ми висунули гіпотезу, що у порівнянні з донорами нормальної ваги донори з підвищеним ІМТ мали б 1) більш високі показники перипераційного повторного прийому та повторної операції, та 2) більший ріст артеріального тиску, більший ріст креатиніну в сироватці крові та більший втрата передбачуваної швидкості клубочкової фільтрації (eGFR) після нефректомії.
Вторинною метою дослідження було порівняння короткострокових результатів для реципієнтів трансплантації нирок живим донорам за категоріями ІМТ донорів. Ми висунули гіпотезу про відсутність зв'язку між результатом реципієнта та категорією ІМТ донора.
Методи
Дані реєстру OPTN були використані для проведення ретроспективного когортного дослідження живих донорів нирок в США протягом 18 місяців з липня 2004 року по грудень 2005 року. Центри трансплантації нирок вперше почали повідомляти OPTN про вагу та зріст донорів в липні 2004 року.
Покоління когорти
Ми обмежили наш аналіз донорами з повними даними, що стосуються ІМТ на момент нефректомії (первинного опромінення). Ми поділили індекс маси тіла на 4 групи: нормальна вага (ІМТ = 25 & = 30 & = 35), як визначено Всесвітньою організацією охорони здоров’я. (25) Ми також вивчили результати для реципієнтів нирок, пожертвованих цією групою живих донорів із повні дані ІМТ.
Результати первинного та вторинного донорів
Первинними результатами були зміни артеріального тиску, оцінка швидкості клубочкової фільтрації (eGFR) та процентна зміна сироваткового креатиніну (розраховане як: [6-місячний креатинін - базовий креатинін]/базовий рівень креатиніну) через 6 місяців порівняно зі значеннями до нефректомії. Референтною групою були донори з нормальною вагою.
eGFR розраховували за допомогою рівняння модифікації дієти при нирковій хворобі (MDRD) із 4 змінними, яке використовує вік, расу, стать та сироватковий креатинін (26). Відомо, що рівняння MDRD недооцінює mGFR у осіб без ХХН (27). Попереднє дослідження функції нирок у пацієнтів із ожирінням та без ожиріння без ХХН показало, що заниження функції нирок при використанні рівняння MDRD узгоджується серед категорій ІМТ (28). Для нашого аналізу ми використовували внутрішньо-індивідуальні зміни показника eGFR для порівняння функції нирок за категоріями ІМТ донорів.
Основними перипераційними ускладненнями, що викликали інтерес серед донорів, були повторна операція та повторний прийом протягом 6 тижнів. Ми також оцінили, в другу чергу, швидкість переходу від лапароскопічної до відкритої хірургії, тривалість перебування та судинні та несудинні ускладнення. Судинні та несудинні ускладнення не трактувались як первинні результати, оскільки форма живого донора OPTN не визначає детально діапазон ускладнень, про які слід повідомляти.
Крім того, ми порівняли донорів через 6 місяців після нефректомії щодо наступних вторинних кінцевих точок: креатинін у сироватці крові; eGFR; відсоток залишкового ШКФР (розрахований як: 6 місяців ШКФР/вихідний рівень СКФР), систолічний та діастолічний артеріальний тиск; та наявність гіпертонії. Ми класифікували донорів як гіпертоніків, якщо у них систолічний артеріальний тиск> = 140 мм рт. Ст., Діастолічний артеріальний тиск> = 90 мм рт. Ст., Або якщо повідомлялося про клінічну історію гіпертонії (29). Артеріальний тиск донорів, креатинін та 1/Cr також порівнювали за категоріями ІМТ за допомогою лінійної регресії з урахуванням віку донора, раси та статі.
Крім того, ми повідомляли аналізи донорського РКФР та артеріального тиску через рік після нефректомії. Ці однорічні результати трактувались як вторинні, оскільки набагато більша кількість донорів бракувала даних на той момент порівняно з шістьма місяцями після нефректомії.
Результати одержувача
Ми порівняли уповільнену функцію трансплантата (DGF, визначену як потребу в діалізі протягом першого тижня після трансплантації), первинну нефункцію (PNF, визначену як виживання алотрансплантата 10 мл/хв/м2 від вихідного рівня. Менше 1,5% точок даних для будь-якого змінні були перекодовані як відсутні.
Статистичний аналіз
Аналіз проводили за допомогою програмного забезпечення Stata (Stata 10.0, Stata Corporation, College Station, Техас). Були проведені двосторонні тести гіпотез із значенням р = 20%), використанням індукційної терапії антитілами, базовим режимом імуносупресії, невідповідністю людського лейкоцитарного антигену (порядкова змінна, визначена як 0 = нульова невідповідність, 1 = одна невідповідність і 2 = більше одного невідповідності); вік донора, раса, стать та категорія ІМТ. Тест Хосмера-Лемешоу не відкинув гіпотезу про придатність цих моделей.
Невдача алотрансплантата та смертність пацієнтів
Ми оцінили припущення про пропорційну небезпеку та відповідність моделі, оцінивши лог-лог-графіки на однорічну недостатність алотрансплантата та однорічну смертність пацієнтів. Багатовимірна модель регресії Кокса для виживання алотрансплантата включала ті самі незалежні змінні, перераховані вище для логістичного регресійного аналізу. Модель смертності пацієнтів включала вік донора та реципієнта, стать та расу, але не інші змінні через обмежену кількість смертей та відсутність сили.
Результати
Протягом 18-місячного періоду дослідження у США було проведено 9319 трансплантацій живих донорів нирок. Значна кількість донорів - 4015 (43%) - не мала даних, пов’язаних з ІМТ. Після усунення тих, у кого відсутні дані ІМТ, було проаналізовано 5304 донори з 207 центрів трансплантації. Серед проаналізованих донорів дві тисячі два (37,8%) мали нормальну вагу (ІМТ = 25 та = 30 та 35).
Таблиця 1
Демографічні та клінічні характеристики живих донорів та їх реципієнтів
ІМТ: індекс маси тіла; eGFR: Розрахункова швидкість клубочкової фільтрації; ШОЕ: термінальна стадія ниркової хвороби; PRA: панельне реактивне антитіло
Таблиця 2
Периперативні результати для живих донорів за категорією ІМТ
Таблиця 3
Шість місяців результатів для живих донорів за категорією ІМТ *
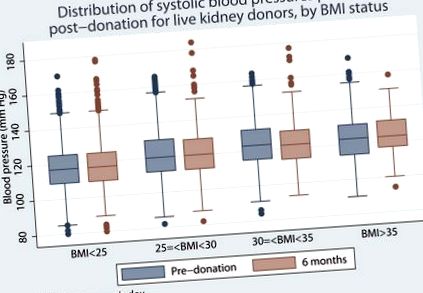
Через шість місяців середній систолічний та діастолічний артеріальний тиск постійно підвищувався у категоріях ІМТ донорів, але не було значних або клінічно значущих відмінностей у величині змін від вихідного рівня, що свідчить про те, що різниця в подальшому артеріальному тиску відображала різницю в базовому артеріальному тиску. Графік розподілу систолічного артеріального тиску до і після нефректомії показаний на малюнку 1 .
Відсоток залишкового РКФР (р = 0,17) та відсоток зростання креатиніну (р = 0,11) також не відрізнялися між групами. Багатоваріантний лінійний регресійний аналіз відсотка підвищення рівня креатиніну в сироватці крові (з урахуванням віку донора, раси та статі) показав, що донори з ожирінням мали значно більший ріст (коефіцієнт = 3%) порівняно з донорами нормальної ваги (р = 0,04), але жодного значного виявлено відмінності серед донорів із надмірною вагою (p = 0,07) або донорами з дуже ожирінням (p = 0,45) (Таблиця 4).
Таблиця 4
Багатовимірно скориговані результати для живих донорів за категоріями ІМТ *
Існувала зворотна залежність між вагою до нефректомії та 6-місячною зміною ваги, така що донори нормальної ваги за 6 місяців набирали в середньому 1,3 кг, тоді як донори із надмірною вагою не мали середніх змін у вазі, донори з ожирінням втрачали в середньому 0,7 кг і донори з дуже ожирінням втратили в середньому 3,8 кг (таблиця 3).
Вторинний аналіз однорічних результатів донорів
Два донори померли до одного року; одна була нормальної ваги, а інша - надмірної. Кількість донорів, у яких відсутні дані, пов’язані з артеріальним тиском або функцією нирок, значно зросла за один рік, але не було різниці у частці відсутніх даних за категоріями ІМТ. З 5304 донорів 1816 (34,2%) донорів повідомили про показники креатиніну за 12 місяців, а у 1546 (29,1%) донорів повідомили про значення артеріального тиску.
Подібно до наших висновків через 6 місяців, зміни до показників показника eGFR до нефректомії (p = 0,79), відсотка підвищення рівня креатиніну (0,82), систолічного артеріального тиску (p = 0,09) та діастолічного артеріального тиску (p = 0,42) не були статистично статистичними різні за категоріями ІМТ донорів через рік після нефректомії. (Дані не представлені в таблицях).
Аналіз одержувачів (таблиця 1)
Таблиця 5
Результати для реципієнтів нирок живих донорів за категорією ІМТ донора
Обговорення
Незважаючи на побоювання щодо підвищеного ризику для здоров’я живих донорів нирок із ожирінням, існують обмежені дані щодо порівняльних результатів для донорів за категоріями ІМТ (22, 30). Використовуючи національний набір даних із різноманітною расовою популяцією, це дослідження показало, що донори з підвищеним ІМТ мають вищий середній артеріальний тиск на початковому рівні та після нефректомії, але зміни артеріального тиску не пов’язані з ІМТ. Більш високий ІМТ донора не збільшував ризик повторної операції чи повторного прийому або збільшення тривалості перебування донора. Через шість місяців відносні зміни донорського креатиніну та eGFR були подібними для категорій ІМТ, а відмінності в абсолютному рівні креатиніну та eGFR не мали клінічного значення. Однорічна виживаність алотрансплантата та смертність пацієнтів також не відрізнялись у групах ІМТ. У сукупності ці висновки свідчать про те, що саме ожиріння не повинно обмежувати прийнятність донорства органів; проте необхідні подальші дослідження, щоб гарантувати, що результати для донорів з підвищеним ІМТ не погіршуватимуться в довгостроковій перспективі.
Рішення прийняти або відхилити донора, що страждає ожирінням, є частою та складною дилемою для фахівців з трансплантації (30). Хоча тенденції середньої ваги серед живих донорів нирок не опубліковані, наше клінічне враження полягає в тому, що популяція потенційних донорів стала більш ожирінням - подібно до тенденцій серед населення США (25). Наша група раніше повідомляла, що використання донорів нирок із ожирінням є поширеним явищем серед центрів трансплантації США (31). Але оскільки накопичились докази того, що ожиріння є незалежним фактором ризику подальших захворювань нирок, доступні обмежені дослідження для консультантів донорів із ожирінням та їх реципієнтів щодо результатів після нефректомії.
Зміни в стандартах між центрами прийому живих донорів із ожирінням відображають відсутність консенсусу щодо відповідної клінічної практики для цих донорів (5). Анкета 2007 року, на яку відповіли 53% американських програм трансплантації нирки, показала, що 12% не мали політики щодо виключення донорів на основі ІМТ, 10% - донорів з ІМТ> 30, 52% - донорів з ІМТ> 35, 20% - донорів з ІМТ> 40, а 6% виключали донорів на основі ІМТ, лише якщо також були наявні інші серцево-судинні ризики (5). Крім того, в ресурсному документі Об’єднаної мережі з питань спільного використання органів для програм трансплантації перелічено „патологічне ожиріння” як критерій „можливого виключення” для донорства живої нирки. (32)
Наші висновки про те, що смерть донорів, повторний прийом, повторна операція та тривалість перебування не були пов’язані з підвищеним ІМТ, як правило, підтверджуються попередніми дослідженнями. У мета-аналізі, який вивчав дослідження донорів із ожирінням, Янг та співавт. повідомили, що живі донори з ожирінням не мали збільшення хірургічних ускладнень (22). Дослідження Янга виявило незначне збільшення тривалості перебування, пов'язане з ожирінням, але збільшення було незначним і ледь відповідало статистичній значущості (22). Heimbach та ін. повідомили, що лише 0,2% донорів у клініці Мейо потребують повторної операції. Донори з вищим ІМТ у Mayo не мали більшої ймовірності повторної операції та не мали збільшеного терміну перебування (2). Ми вважаємо, що більшість серйозних ускладнень буде усунуто різницею в рівнях смертності донорів, повторного прийому, повторної операції або тривалості перебування; всі ці результати в нашому дослідженні були подібними для категорій ІМТ.
З іншого боку, набір даних OPTN повідомляє про значно нижчий рівень загальних ускладнень, ніж попередні дослідження (33, 34). Наприклад, рівень загальних ускладнень становив 12,8% у дослідженні Heimbach та 16,8% у дослідженні Pesavento, тоді як 1 доктор Різ підтримується премією NIH Career Development Award, K23 - DK078688-01. Він брав участь у розробці досліджень, аналізі даних та написанні статті
2 Доктора Фельдмана підтримує премія NIH Midcareer за дослідження, орієнтоване на пацієнта, K24 -> DK002651. Він брав участь у дослідницькому розробленні та написанні статті
3 Доктор Аш брав участь у розробці досліджень та написанні статті
4 Доктор Шульц брав участь в аналізі даних та написанні статті
5 Доктор Томассон брав участь в аналізі даних та написанні статті
6 Доктор Блум брав участь у розробці досліджень та написанні статті
Автори не мають заявляти про конфлікт інтересів.
- Надмірна вага, але готовий до боротьби; Люди, що страждають ожирінням, висувають свої упереджені претензії до суду - Нью-Йорк
- Надмірна вага, легке ожиріння збільшується у живих донорів нирок - новини про нирки та урологію
- Майже третина дітей Корнуолу залишають початкову школу із зайвою вагою або ожирінням - Cornwall Live
- Результати вагітності жінок із зайвою вагою та ожирінням у віці 35 років і старше - Дослідження на основі реєстру в
- Фармакологічно прискорене спорожнення шлунка може зменшити споживання калорій людьми з ожирінням