Координований збудливий вплив ГАМК-ергічних інтернейронів на три моторні програми годування молюсків Clione limacina
Анотація
Будь-яка складна поведінка вимагає конкретної координації між різними нейронними мережами, що контролює різні її аспекти, для досягнення значущого поведінкового результату. Така координація забезпечує впорядковане вироблення складної поведінки та представляє універсальний принцип функціонування ЦНС як у хребетних, так і у безхребетних тварин. Основним завданням поточного дослідження є поведінка живлення хижого молюска-птеропода Clione limacina та нейронні механізми координації між основними елементами цієї складної поведінки.
Ми описуємо в цьому дослідженні та обговорюємо роль двосторонньо симетричного церебрального інтернейрону, позначеного клітиною Cr-BM, який справляє помітний збудливий вплив на всі нейронні мережі, які контролюють три основні живильні структури в Кліон: щічні шишки, хітинові гачки та радула. Попередній загальний опис деяких з цих ефектів був раніше опублікований (Norekian 1995). Загальний сильний збудливий вплив, що виробляється нейроном Cr-BM на всі виявлені нейронні мережі, що живляться, є, мабуть, важливим під час періоду «видобутку здобичі» під час годування після захоплення здобичі. На додаток до загальної активації, нейрон Cr-BM має сильний координаційний вплив на окремі елементи кожної нейронної мережі, що сприяє фазової залежності координації їх ритмічної діяльності. Очевидно, що інтернейрон Cr-BM використовує ГАМК як збудливий передавач на основі експериментів подвійного маркування, імітуючи ефект екзогенного ГАМК та блокуючий ефект антагоністів ГАМК. Це представляє ще один цікавий приклад збудливої ролі ГАМК в поведінці годування Кліон (Аршавський та ін., 1993; Норекян, 1999).
Дорослі екземпляри C. limacina були зібрані в лабораторіях П’ятницької гавані Вашингтонського університету (П’ятниця Харбор, Вашингтон) у весняно-літній сезон та в Біломорській морській лабораторії Зоологічного інституту (Біле море, Росія) у літньо-осінній сезон. Тварин утримували в 1-галонних банках у холодильнику при температурі 5–7 ° C. Перед розтином тваринам знеболювали суміш морської води та ізотонічного MgCl2 у співвідношенні 1: 1, а потім щільно прикріплювали до чашки Петрі з силіконовим еластомером (Sylgard). Електрофізіологічні експерименти проводили на редукованих препаратах, що складалися з ЦНС, голови та крил. Всі центральні нерви, що іннервують голову, були цілими. До електрофізіологічного запису оболонку центральних гангліїв пом'якшували, купаючи препарат у розчині протеази 1 мг/мл (Sigma, тип XIV) протягом 5 хв, після чого 30-хвилинним промиванням у фільтрованій морській воді.
Внутрішньоклітинні записи з окремих нейронів проводили за допомогою скляних мікроелектродів (опори: 10–30 МОм), наповнених 2 М ацетатом калію. Електрофізіологічні сигнали посилювались, відображались та реєструвались за допомогою звичайних електрофізіологічних методів. Внутрішньоклітинна стимуляція була досягнута за допомогою мостової схеми підсилювача. Для тестування на моносинаптичні сполуки використовували високодивалентний розчин катіону [що містить (в мМ) 110 MgCl2, 25 CaCl2, 400 NaCl, 10 KCl та 3 NaHCO3, рН 7,4]. Для морфологічного дослідження зареєстрованих нейронів 5% розчин 5 (6) -карбоксифлуоресцеїну (Sigma), приготовлений у 2 М ацетаті калію, іонофорували через реєструючі електроди (опори, 20–40 МОм) з негативним струмом від 1 до 10 нА імпульси протягом 5–30 хв. Ін’єкційні клітини спостерігали в прямому ефірі в фіксуючому мікроскопі з епіфлуоресцентним мікроскопом Nikon та конфокальним мікроскопом BioRad (Геркулес, Каліфорнія) MRC 600.
ГАМК застосовували локально до соми ідентифікованих нейронів за допомогою викиду тиску або іонофоретичного застосування. Для викиду тиску скляні мікропіпетки заповнювали 5 мМ розчином ГАМК у відфільтрованій морській воді і підключали до системи тиску повітря (PV830 Pneumatic PicoPump, WPI), яка подавала імпульси тиску 40–60 п.с.і. і тривалістю 200 мс. Фарба Fast Green (0,02%) була додана в розчин для контролю доставки препарату. Для іонофоретичного застосування ми використовували скляні мікропіпетки діаметром кінчика 1–2 мкм, наповнені 1 М розчином ГАМК (pH 4). Іонофоретичні струми мали амплітуду від 50 до 100 нА і застосовувались як короткі імпульси тривалістю від 50 до 100 мс (стимулятор S4KR та модуль ізоляції стимулу SIU 4678, інструменти Grass). Антагоністи ГАМК застосовували за допомогою градуйованої піпетки об’ємом 1 мл. Кінцеву концентрацію оцінювали з відомого об'єму введеного розчину та відомого об'єму сольового розчину у фіксуючу тарілку.
Для експериментів з подвійним маркуванням інтернейронам вводили нейробіотин (Vector Laboratories). Потім препарати фіксували у 4% параформальдегіду та 0,1% глутаральдегіду в PBS та інкубували 12 год у червоно міченому авідині Техасу (Vector Laboratories) для візуалізації інтернейронів, наповнених нейробіотином. Потім препарати обробляли для імуноцитохімічної реакції, описаної в попередньому тексті. Змінивши фільтри у флуоресцентному мікроскопі або лазерному скануючому конфокальному мікроскопі для червоного Техасу та флуоресцеїну, інтернейрони були визначені як ГАМК-імунореактивні. Техаський червоний не видно з флуоресцеїновими фільтрами, а флуоресцеїн не видно з фільтрами техаського червоного, що забезпечує чітке порівняння під час перемикання фільтрів.
Морфологія Cr-BM інтернейрону та загальний вплив на нейронні мережі
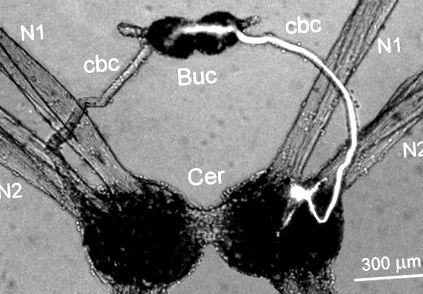
Двосторонній симетричний інтернейрон Cr-BM знаходився на вентральній поверхні мозкових гангліїв у передній області між головними нервами N1 та N2, що іннервують голову тварини (рис. 1). Розміри клітинного тіла становили 25–30 мкм у діаметрі. Один великий аксон нейрону Cr-BM вийшов з мозкових гангліїв в іпсилатеральний церебро-щічний сполучний матеріал та іннервував нейропілу обох щічних гангліїв (рис. 1). Кілька дрібних відростків також розгалужуються в нейропілі іпсилатерального мозкового ганглія. Морфологічну структуру 16 інтернейронів Cr-BM вивчали у 12 препаратах після внутрішньоклітинного введення флуоресцентного барвника карбоксифлуоресцеїну.
Фіг. 1.Морфологічна структура правого інтернейрону Cr-BM, що вводиться карбоксифлуоресцеїном. Клітинне тіло розташоване в мозкових гангліях (Cer) поблизу основи головних нервів N1 і N2 і проектує один великий аксон на щічні ганглії (Buc) за допомогою церебро-щічного сполучного (cbc). Мікрофотографію отримували за допомогою епіфлуоресцентного мікроскопа.
Фіг. 2.A: стимуляція інтернейрону Cr-BM призвела до тривалої ритмічної активності в мережі контролю радули, яка простежується шляхом реєстрації інтернейрону Bc-PIN, активного у фазі затягування радули. B: індукований сплеск шипів нейрону Cr-BM викликав ритмічну активність в мережі контролю гачків, що простежується за допомогою запису гачкового транспортира Bc-HP мотонейрона. C.: інтернейрон Cr-BM також активував нейрони Cr-A, які контролюють розкриття шкірних складок та затягування щічного конуса. Індукована нейроном Cr-BM частота стрільби в цих експериментах становила від 20 до 40 Гц.
Специфічні синаптичні зв’язки, утворені інтернейронами Cr-BM
Інтернейрон Cr-BM індукував ритмічну активність у щічній нейронній мережі, що керує рухами радули. Мотонейрони транспортера Radula отримали видатні збудливі постсинаптичні потенціали (PSP) від нейронів Cr-BM. Кожен індукований спайк нейрону Cr-BM продукував єдиний збудливий PSP нейрона Bc-RP (EPSP), який зберігався у високодивалентному розчині, що свідчить про моносинаптичний зв’язок (n = 14; Рис.3A). Інтернейрон Bc-PIN, який активний у фазі затягування радули, також отримав помітні збудливі входи від інтернейрона Cr-BM. Кожен спайк Cr-BM генерував EPSP великої амплітуди в комірці Bc-PIN, який зберігався у високодивалентному розчині (n = 26; Рис.3A). Мотонейрони Bc-RR редуктора Radula отримували інгібуючі входи від інтернейронів Cr-BM. Кожен індукований спайк нейрону Cr-BM викликав одиничний нейрон Bc-RR IPSP, який зберігався у високодивалентному розчині, що свідчить про моносинаптичний зв’язок (n = 12; Рис.3B). Таким чином, маючи загальний збудливий ефект на нервову систему, що контролює радулу, нейрони Cr-BM також виробляють координаційні входи до конкретних елементів цієї системи, забезпечуючи активність нейтралів радули-ретрактора та ретракторів радули в протилежних фазах їхнього ритмічного циклу.
Фіг. 3.A: кожен індукований стрибок в інтернейроні Cr-BM продукував індивідуальний EPSP в мотонейроні радули (Bc-RP) та інтернейроні Bc-PIN, який активний у фазі затягування радули. B: кожен окремий стрибок в інтернейроні Cr-BM також індукував єдиний інгібуючий постсинаптичний потенціал (IPSP) у мотонейроні ретрактора радули (Bc-RR). Експерименти проводили у високодивалентному розчині.
Фіг. 4.Індукований сплеск шипів в інтернейроні Cr-BM спричинив загальну активацію мотонейрона гака-ретрактора (Bc-HR) із помітною затримкою (A). Ця затримка пояснювалася швидкими IPSP малої амплітуди, отриманими нейроном Bc-HR від інтернейрона Cr-BM (B). На додаток до цих швидких IPSP, реакція нейрону Bc-HR на активацію нейрону Cr-BM включала повільну тривалу деполяризацію, яка відповідала за загальну активацію мотонейрона Bc-HR. C.: мотонейрон гачок транспортера (Bc-HP) був інгібований інтернейроном Cr-BM, реагуючи швидкими IPSP при співвідношенні IPSP 1 пік: 1.
Фіг. 5.A: збудливі входи від інтернейрону Cr-BM до нейронів Cr-A зникли після розрізу мозково-щічного сполучного. B: кожен індукований стрибок в інтернейроні Bc-PIN, що продукується в нейроні Cr-A1 нейрону EPSP, який зберігався у високодивалентному розчині. C.: EPSP у нейроні Cr-Ai (*) з’явився лише тоді, коли індукований нейроном Cr-BM моносинаптичний EPSP у нейроні Bc-PIN досягнув порогу та сформував потенціал дії.
Помітною характеристикою всіх індукованих Cr-BM нейронами PSP в щічних нейронах було їх помітне полегшення при повторному випалюванні нейрону Cr-BM (рис. 6, A і B). Фасилітація залежала від частоти з найвищими значеннями, зафіксованими під час спайкової частоти нейрону Cr-BM 20 Гц, і майже зникала при частоті 1 Гц (рис. 6, A – C). Малюнок 6A забезпечує кількісну оцінку цього полегшення шляхом порівняння співвідношення між амплітудою другого та першого EPSP в нейроні Bc-PIN при різних частотах випалу вибуху, спричиненого нейроном Cr-BM. Інший приклад - порівняння першої та максимальної PSP у поїзді. Таке збільшення амплітуди EPSP, розраховане для нейрона Bc-PIN під час випромінювання нейроном Cr-BM при частоті від 3 до 8 Гц, становило 502 ± 59% (n = 20).
Фіг. 6.Фасилітація індукованих нейронами Cr-BM нейронів у нейроні Bc-PIN залежала від частоти. A: вертикальна шкала показує співвідношення між амплітудою 2-го та 1-го EPSP, тоді як горизонтальна шкала показує тривалість між 1-м та 2-м спайками нейрона Cr-BM. Коефіцієнт кореляції склав 0,71. B: На частоті вистрілення нейрону Cr-BM із частотою 6 Гц EPSP нейронів Bc-PIN продемонстрували помітне сприяння. C.: частота стрільби ≤1 Гц не зумовила значного збільшення амплітуди EPSP.
Інтернейрони Cr-BM є GABAergic
Фіг. 7.A: Імунореактивність ГАМК в мозкових гангліях. Стрілки ідентифікують GABAergic Cr-Ai нейрон, описаний раніше (Norekian 1999). Стрілки вказують на 2 симетричні імунореактивні клітинні тіла біля основи головних нервів N1 і N2, які, здавалося, були клітинами тіл нейронів Cr-BM. Наступні експерименти з подвійним маркуванням підтвердили це. B: зображення правого мозкового ганглію, отримане за допомогою фільтрів Texas Red. Один інтернейрон Cr-BM був заповнений нейробіотином і візуалізований Texas Red. C.: зображення того самого мозкового ганглію, отримане за допомогою флуоресцеїнових фільтрів. Це зображення показує імунореактивність GABA (антисироватки GABA були позначені флуоресцеїном). Зверніть увагу, що на обох зображеннях нейрон Cr-BM проектує великий аксон в церебро-щічний сполучний елемент (cbc) і має кілька дрібних відростків, що іннервують мозковий нейропіл. Всі зображення представляють собою композитний реконструкційний конфокальний мікроскоп з декількох оптичних зрізів.
Екзогенний ГАМК імітував вплив, який виробляє інтернейрон Cr-BM на всі постсинаптичні щічні клітини. Місцеве застосування ГАМК за допомогою викиду тиску або іонофорезу призвело до деполяризації нейронів Bc-RP транспортера радули (n = 4; Рис.8A) та гіперполяризація нейронів Bc-RR-ретрактора радули (n = 6; Рис.8B). Інтернейрон Bc-PIN також відповів помітною деполяризацією на додаток GABA (n = 9; Рис.8C.). Локально застосований ГАМК також проводив деполяризацію нейронів Bc-HR, що втягують гачок (n = 5; Рис.8D) та гіперполяризація нейронів Bc-HP гак-транспортира (n = 10; Рис.8Е). Не було ознак гіперполяризації в нейроні Bc-HR, хоча нейрон Cr-BM продукував у цій клітині швидку комбінацію IPSP/повільний EPSP, що можна пояснити ефектом маскування потужнішої деполяризації або наявністю лише одного типу рецептора на поверхні сомати.
Фіг. 8.Вплив екзогенного ГАМК на радульний транспортер Bc-RP мотонейрон (A), ретрактор радули Bc-RR мотонейрон (B), Bc-PIN інтернейрон (C.), втягувач гачка Bc-HR мотонейрон (D), а гачок транспортир Bc-HP мотонейрон (Е). ГАМК застосовували локально за допомогою викиду тиску, позначеного товстою лінією в A або нефоретичний імпульс струму в B – E. Зверніть увагу, що нейрони, активні у протилежних фазах буккального ритму живлення, мають протилежний тип відповіді ГАМК - деполяризація проти гіперполяризації. Індукована GABA гіперполяризація нейрону Bc-HP була оборотно заблокована 2 мМ бікукуліном (Е).
Фіг. 9.Антагоніст GABA, бікукулін, оборотно блокував індуковані нейроном Cr-BM IPSP в нейроні гачка Bc-HP (A). Пікротоксин блокував лише швидкі IPSP у нейроні Bc-HR, що втягує гачок (B). Зверніть увагу, що деполяризуюча реакція, індукована нейроном Cr-BM, все ще залишалася недоторканою. Індуковані нейроном Cr-BM EPSP в нейроні Bc-PIN були лише частково заблоковані бікукуліном (C.).
Додаткові постсинаптичні ефекти інтернейронів Cr-BM
Фіг. 10.A: схематичний малюнок, що показує морфологічну структуру нещодавно виявленого нейрона Bc-L, який викликає закриття та ущільнення шкірних складок. Тіло її клітини розташоване в щічних гангліях. Один великий аксон через гачковий нерв виходить з щічних гангліїв, перетинає весь лівий мішок гачка без будь-якого розгалуження і потрапляє в тканину іпсилатеральних шкірних складок. B: індукований сплеск шипів в інтернейроні Cr-BM спричинив помітне пригнічення спонтанно активного нейрона Bc-L. C.: кожен індукований спайк нейрону Cr-BM продукував індивідуальний IPSP в нейроні Bc-L у високодивалентному розчині. D: інтернейрон Cr-BM також виробляв збудливі входи до серотонінергічного церебрального нейрону MCC.
Можливо, найвідомішою клітиною, яка бере участь у контролі поведінки годування черевоногих молюсків, є церебральний гігантський серотонінергічний нейрон МСС. Ми виявили, що інтернейрон Cr-BM виробляв збудливі входи до нейронів MCC (n = 8; Рис.10D). Ці входи мали відносно слабкий і полісинаптичний характер.
Координація між трьома основними структурами живлення та нейронними мережами
Збудлива роль ГАМК в харчовій поведінці
Церебро-щічні інтернейрони у черевоногих молюсків
Цю роботу підтримали грант Національного наукового фонду IBN-0235107, грант Організації Північноатлантичного договору 979205 та спільний грант Російського фонду фундаментальних досліджень.
- Вплив тривалого годування сирою морквою на вміст вітаміну А в печінці та нирках у собаки - R
- Вплив дієтичного вмісту енергії на окраду морського ляща (Sparus aurata) на поведінку годування та
- Вплив сульфату цинку на живлення та ріст Spodoptera littoralis Boisd
- Вплив годівлі мускусних каченят різними джерелами білка Продуктивність, вміст θ-3 жирних кислот
- Вплив різних стратегій годівлі на попит на ореда (Sparus aurata)