Коли менше може бути більше: обмеження калорій та відповідь на терапію раку
Анотація
Обмеження калорій (CR) продовжує тривалість життя і, як було показано, зменшує вікові захворювання, включаючи рак, діабет, а також серцево-судинні та нейродегенеративні захворювання на експериментальних моделях. Нещодавні трансляційні дослідження перевірили потенціал CR або CR-міметиків як допоміжної терапії для підвищення ефективності хіміотерапії, променевої терапії та нових імунотерапій. Хронічний CR важко застосовувати у хворих на рак, і тому періодичне голодування, міметичні препарати CR або альтернативні дієти (наприклад, кетогенна дієта) можуть бути більш придатними. Показано, що періодичне голодування посилює лікування як хіміотерапією, так і променевою терапією. CR та голодування викликають різні реакції у нормальних та ракових клітинах та зменшують певні побічні ефекти цитотоксичної терапії. Результати доклінічних досліджень міметичних препаратів CR та інших дієтичних втручань, таких як кетогенна дієта, є перспективними для поліпшення ефективності протипухлинної терапії та зменшення побічних ефектів цитотоксичного лікування. Поточні та майбутні клінічні дослідження повідомлять про те, які види раку та на якій стадії ракового процесу, схеми CR, голодування або CR міметичні виявляться найбільш ефективними.
Передумови
Обмеження калорій (CR) та рак
Вісь AMPK/mTOR також контролює аутофагію - процес, завдяки якому білки, макроелементи та органели огортаються двомімбранними пухирцями та розкладаються у будівельні блоки, які потім можна перенести на синтетичні шляхи. В умовах CR активація AMPK стимулює підвищену аутофагію для переробки клітинних компонентів та забезпечення необхідних субстратів для метаболізму та гомеостазу [4, 15]. Автофагія може виступати як двосічний меч при раку - вважається, що він пригнічує пухлину, оскільки дефекти аутофагії викликають окислювальний стрес, дефекти мітохондрій, пошкодження ДНК, нестабільність геному та ріст пухлини [25]. І навпаки, вважається, що це сприяє розвитку пухлини, оскільки встановлені пухлини можуть використовувати аутофагію для зменшення окисного стресу та підвищення функції мітохондрій та метаболізму для сприяння виживанню та подолання стресу та низького рівня поживних речовин [25, 26]. Завдяки подвійній ролі аутофагії у раку, індуктори та інгібітори аутофагії стали мішенями для терапії раку [27]. Недавні дослідження в нашій лабораторії показали, що поєднання інгібування аутофагії зі схемою CR зменшує ріст пухлини більше, ніж одне лише лікування [20].
CR та терапевтична відповідь
Елегантна робота Рафагелло та співавт. [40] продемонстрували, що короткочасне голодування викликає різну реакцію на хіміотерапію в нормальних та ракових клітинах, при цьому нормальні клітини інактивують сигнали росту, такі як Ras, Akt та IGF-1, у відповідь на короткочасне голодування, захищаючи їх від терапевтичної токсичності. На противагу цьому ракові клітини, що виникли внаслідок активації цих сигналів та ухилення від сигналів, що викликають старіння, не зазнають цієї інактивації, залишаючись вразливими до цитотоксичного лікування за допомогою хіміотерапії або променевої терапії. Індукція цих специфічних для раку реакцій на стрес може впливати на механізми, пов’язані з хіміорезистентністю, включаючи стійкість до різних препаратів [46].
Незважаючи на те, що доклінічні дослідження посилюють вплив переривчастої КР у поєднанні з хіміотерапією та променевою терапією, клінічні дослідження проводяться повільно, ймовірно, через перелічені вище проблеми. Короткий зміст минулих та поточних клінічних випробувань періодичної КР, дієт, що імітують голодування та кетогенних дієт у поєднанні з протипухлинною терапією, наведено в таблиці 1. Невелике дослідження, яке включало десять пацієнтів із діагнозом злоякісних новоутворень, включаючи молочну залозу, стравохід, простату та легені, котрий пройшов 48–140 год. до та 56 год. після хіміотерапії, виявив значне поліпшення побічних ефектів терапії, включаючи нудоту, блювоту, діарею, слабкість та втому [51, 52].
В даний час проводяться більші випробування, щоб визначити потенціал короткочасного голодування у зменшенні побічних ефектів та ефективності хіміотерапії, і, ймовірно, буде відправною точкою для майбутніх клінічних випробувань з періодичним КР як потенційною допоміжною терапією.
CR-міметики
Беручи до уваги харчові проблеми CR та голодування у деяких онкологічних хворих, міметики CR, а саме фармакологічні засоби, спрямовані на шляхи ураження CR, такі як рапаміцин, метформін, ресвератрол та гідроксицитрат, є привабливими стратегіями для імітації захисних ефектів CR як для раку профілактика та як допоміжна терапія без дієтичних обмежень. Ці CR-міметики впливають на системне та специфічне для пухлини запалення та метаболізм, і цільові шляхи можуть спричинити ракові захворювання до традиційних та нових протиракових методів лікування, зменшуючи асоційоване з пухлиною запалення або викликаючи метаболічний стрес у раковій клітині.
Введення CR-міметичного рапаміцину (сиролімусу), імунодепресанта та встановленого інгібітора mTOR, продовжує тривалість життя та затримує рак у мишей [53]. Наша лабораторія показала, що рапаміцин або його аналог Afinitor® (еверолімус) можуть імітувати протиракові ефекти CR на мишачих моделях раку підшлункової залози та молочної залози [54, 55]. Сигналізація через шлях mTOR була задіяна в широкому діапазоні хіміорезистентних ракових захворювань [56], і було показано, що рапаміцин повертає резистентність до різних лікарських засобів [57]. Перспективні доклінічні дослідження демонструють, що рапаміцин може сенсибілізувати певні види раку до хіміо- та променевої терапії. Тривають активні клінічні випробування фази I та II для визначення ефекту поєднання рапаміцину з хіміотерапевтичними схемами, включаючи гемцитабін при остеосаркомі, циклофосфамід, дексаметазон при мієломі та мітоксантрон, етопозид та цитарабін при лейкемії.
Інший CR-міметик, метформін, - бігуанід, який зазвичай використовується для лікування діабету 2 типу шляхом інгібування глюконеогенезу шляхом непрямої активації AMPK, таким чином знижуючи рівень глюкози в крові та інсуліну до рівнів, що спостерігаються у мишей CR [58]. Метформін як монотерапія пригнічує розвиток та/або ріст пухлини на багатьох експериментальних моделях, включаючи моделі раку товстої кишки, молочної залози та гемопоетичного типу [59]. Метформін показав перспективність як у доклінічних, так і в клінічних дослідженнях, покращуючи лікування раку товстої кишки, молочної залози, яєчників, простати та легенів [60, 61]. В даний час проводяться кілька досліджень фази II для оцінки метформіну як потенційної комбінованої терапії, включаючи одне дослідження недрібноклітинного раку легенів, яке включає дієтичну групу з низьким вмістом вуглеводів.
Ресвератрол, поліфенольна сполука, що міститься у винограді, ягодах і, що найвідоміше, у червоному вині, також розглядався як міметик CR. Вважається, що ресвератрол лежить в основі «французького парадоксу», коли споживання червоного вина, як вважають, знижує рівень смертності від серцево-судинних захворювань та деяких видів раку [62]. Ресвератрол виявляє протизапальні, антиоксидантні та антиангіогенні властивості [63] та пригнічує розвиток та ріст багатьох видів раку на доклінічних моделях, включаючи молочну залозу, простату, товсту кишку та печінку. Хоча кілька досліджень in vitro та in vivo показали, що ресвератрол може посилити протипухлинне лікування [64], Fukui et al. [65] припустив, що ресвератрол може насправді знизити ефективність лікування паклітакселом при раку молочної залози. Отже, перед переходом до клінічних випробувань, що вивчають ресвератрол як допоміжну протипухлинну терапію, слід провести більше доклінічних досліджень.
Новим CR-міметиком є гідроксицитрат, похідне лимонної кислоти та ліки для зниження ваги без рецепта, яке інгібує АТФ-цитрат-ліазу, фермент, який каталізує перетворення цитрату в оксалоацетат та ацетил-КоА. Ракові клітини використовують ацетил КоА як синтетичний попередник для проліферації та росту палива [66]; таким чином, блокування синтезу ацетил-КоА є раціональним підходом для конкретного націлювання на метаболізм раку. Крім того, гідроксицитрат є потужним індуктором аутофагії. Тим не менше, одне лише введення гідроксицитрату не впливає на системну глюкозу чи інсулін [67]. Далі, хоча Pietrocola et al. [41] показав посилення протипухлинних ефектів, поєднуючи гідроксицитрат з доксорубіцином та циклофосфамідом, невелике випробування не виявило жодної додаткової переваги гідроксицитрату при введенні з α-ліпоєвою кислотою поряд зі стандартом догляду [68].
Альтернативні дієтичні підходи
IER, наприклад, дієта 5–2, при якій людина дотримується суворого обмеження (на 75% менше калорій) протягом 2 днів не поспіль, харчуючись нормальною, здоровою дієтою протягом решти 5 днів, є вдалим підходом до схуднення в дослідженнях на людях і призводить до подібних поліпшень метаболічних параметрів, таких як чутливість до інсуліну [3]. В даний час проводиться рандомізоване дослідження, в якому порівнюються ІЕР та хронічна ХР у поєднанні з лікуванням таксанів у хворих на рак молочної залози. Попередні результати цього дослідження свідчать про те, що ІЕР є допустимим у пацієнтів, які отримують хіміотерапію, і результат цього випробування додасть доказів щодо ХР як допоміжного лікування та оцінить ІЕР як можливу альтернативу ХР як протипухлинну терапію.
Висновки
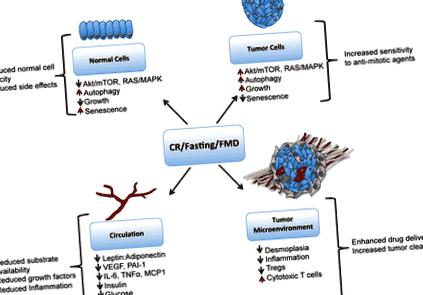
Механізми, за допомогою яких обмеження калорій (CR) впливає на реакцію на протипухлинну терапію. CR, дієти, що імітують голодування або ягід, що імітують голодування (FMD), спричиняють зниження сигналів Akt/mTOR та Ras у нормальних клітинах, що призводить до старіння, зниження росту та захисту від цитотоксичного лікування, тоді як у пухлинних клітинах онкогенні сигнали залишаються, а клітини чутливі до антимітотична терапія. CR, голодування та ящур також зменшують прозапальні цитокіни в циркуляції та в ніші мікросередовища пухлини, а також знижують лептин, інсулін, IGF-1 та глюкозу. CR може зменшити десмоплазію, що оточує пухлинні тканини, що може сприяти кращій терапевтичній доставці ліків до клітин пухлини. CR також може допомогти в імуноспостереженні за пухлинами, зменшуючи популяції Treg, які інгібують цитотоксичні CD8 + Т-клітини. Ця цифра ніде не опублікована
- Дивовижні переваги обмеження калорій Медична група Південної Флориди
- Дві цікаві статті щодо обмеження калорій; Боротьба зі старінням!
- Ультразвукова оцінка ановуляторних розладів у худорлявих жінок із надмірною вагою - Повний текст
- Музичне дослідження перекладу схуднення - Повний текст
- Оновлення щодо обмеження калорій та втрати кісток; Боротьба зі старінням!