Кетогенна дієта покращує прогноз на мишачій моделі дисемінації очеревини без регресії пухлини
Ейдзі Касумі
1 EN Otsuka Pharmaceutical Co., Ltd., R&D Laboratories, 4-3-5 Nimaibashi, Hanamaki, Iwate 025-0312, Японія
Норіфумі Сато
1 EN Otsuka Pharmaceutical Co., Ltd., R&D Laboratories, 4-3-5 Nimaibashi, Hanamaki, Iwate 025-0312, Японія
Анотація
Вступ
Перитонеальний карциноматоз являє собою важку форму метастатичного прогресування раку, яка спостерігається у 10–35% хворих на рак прямої кишки та у 50% хворих на рак шлунка. (1) Отримана перитонеальна дисемінація є найпоширенішим і найважчим клінічним симптомом, що призводить до поганого прогнозу. (2) Перитонеальна дисемінація спостерігається приблизно у 10% хворих на колоректальний рак, і це викликає асцит, сильну втому, дискомфорт у животі, біль у животі та непрохідність кишечника, при 5-річному рівні виживання менше 10%. (3,4) Слід зазначити, що пацієнти з непрохідністю кишечника, спричиненою дисемінацією очеревини, що походить від раку прямої кишки як первинного ураження, мають гірший прогноз із середнім значенням виживання приблизно 3 місяці, навіть після хірургічного лікування. (5)
Нещодавно повідомлялося, що загальна медіана виживання хворих на дисемінацію очеревини, які отримували гіпертермічну внутрішньоочеревинну хіміотерапію, яка поєднує циторедукційну хірургію та нагріту хіміотерапію в очеревинній порожнині, становила 19,2 місяця, а 3-річна та 5-річна виживаність становили 39% і 19% відповідно. (6) Хоча прогноз у пацієнтів з перитонеальною дисемінацією, отриманою від колоректального раку, покращився завдяки розробці нових методів лікування, все ще необхідні більш ефективні методи лікування.
Зосередившись на вищезазначених механізмах метаболізму раку, ми висунули гіпотезу, що кетогенна дієта покращить стан захворювання при перитонеальному розповсюдженні шляхом постачання кетонових тіл як джерела енергії та зменшення надходження глюкози до ракових клітин. Крім того, оскільки кетонові тіла інгібують гістондеацетилазу, (13) вони можуть чинити подібний ефект, як Вориностат, (14) протираковий засіб. Незважаючи на те, що попередні дослідження продемонстрували ефективність кетогенної дієти проти раку в експериментах на тваринах або невеликих клінічних випробуваннях, про її використання не повідомлялося для рефрактерних видів раку, зокрема перитонеального поширення.
Тут ми демонструємо, що кетогенна дієта продовжувала виживаність моделі поширення очеревини миші. Несподівано кетогенна дієта не мала протиракового ефекту проти пухлин очеревини in vivo, незважаючи на зниження рівня глюкози та підвищення рівня кетонових тіл у крові. Крім того, кетонові тіла не впливали на ріст клітин раку товстої кишки in vitro. Хоча ми не підтвердили свою гіпотезу, ми виявили, що кетогенна дієта різко зменшила затримку асциту, пов'язану з дисемінацією в очеревині. Отримані нами дані вказують на те, що кетогенна дієта може бути новою потенційною терапією для поширення очеревини.
Матеріали і методи
Тварини
Самці 5-тижневих мишей BALB/c (CLEA Japan, Inc., Токіо, Японія) утримувались у дротяних клітках при контрольованій температурі (23 ± 3 ° C) та вологості (50 ± 20%) з 12-годинний цикл світло-темрява. Мишей годували комерційною лабораторною чау, і їм дозволяли пити воду ad libitum приблизно за тиждень до початку експериментів. Усі експерименти на тваринах відповідали рекомендаціям з догляду та використання лабораторних тварин, встановлених Комітетом з використання та догляду за тваринами EN Otsuka Pharmaceutical Co., Ltd.
Культура клітин та експериментальна модель миші для дисемінації в очеревині
Клітинна лінія ободової кишки 26 була придбана у RIKEN BioResource Center (Цукуба, Японія). Клітини ободової кишки культивували в середовищі RPMI-1640, доповненій 10% фетальної бичачої сироватки, 2 мМ 1 -глутаміну, 100 ОД/мл пеніциліну та 100 мкг/мл стрептоміцину під 5% СО2 на повітрі при температурі 37 ° C. Культивовані клітини товстої кишки 26 збирали за допомогою Accutase (Nacalai Tesque, Inc., Кіото, Японія) і готували у вигляді суспензії клітин у концентрації 5 × 10 6 клітин/мл у солі, забуференному фосфатом (PBS). Мишам внутрішньочеревно інокулювали 0,1 мл суспензії клітин за допомогою голки 26 G.
Експериментальний дизайн
Після щеплення пухлини мишей випадковим чином розподіляли на дві групи і годували кетогенною дієтою або звичайною дієтою (табл. 1) за бажанням. Проводили аналіз виживання та реєстрували показники здоров’я мишей за такими параметрами: зовнішність 0–2, природна поведінка 0–3, спровокована поведінка 0–3 та стан тіла 1–5 згідно з методом Пастера та ін. . (15) Мишей із загальним балом 3 або менше було евтаназовано гуманно і реєстрували час їх виживання.
Таблиця 1
Склад регулярних та кетогенних дієт, що використовуються у цьому дослідженні
| Казеїн | 20.3 | 14.4 |
| Соєва олія | 7,0 | 72.4 |
| Декстрин | 63.2 | 3.7 |
| Мінеральна суміш AIN-93G | 3.5 | 3.5 |
| Вітамінна суміш AIN-93 | 1.0 | 1.0 |
| Целюлоза | 5.0 | 5.0 |
Звичайна дієта грунтувалася на складі AIN-93G. Кетогенна дієта складалася з порошкоподібної олії, отриманої сублімаційною сушкою емульсії казеїну та соєвої олії, яку могли їсти тварини. Всі інгредієнти були придбані у Oriental Yeast Co., Ltd. (Токіо, Японія).
Щоб детально дослідити вплив кетогенної дієти на умови захворювання перитонеальної моделі поширення, мишей, що несуть пухлинні клітини, годували експериментальною дієтою ще 15 днів як окремий експеримент. Нарешті, всіх мишей евтаназували, а пухлини, асцитну рідину та тканини збирали та зважували.
Вимірювання крові
У день розтину з порожнистої вени брали зразки крові під наркозом із ізофлураном. Для клінічного хімічного аналізу всі зразки крові центрифугували при 1500 × g протягом 15 хв при 4 ° C, після чого збирали сироватку. β-OHB вимірювали за допомогою Precision Xceed (Abbott Japan Co., Ltd., Токіо, Японія). Гематологічний аналізатор XT-1800iV (SYSMEX Corp., Hyogo, Японія) та аналізатор клінічної хімії (Fuji Drichem 3500V, FUJIFILM Medical Co. Ltd., Токіо, Японія) використовувались для гематологічної оцінки та хімічної сироватки крові відповідно до інструкцій виробника.
Кількісне визначення фактору росту судинного ендотелію A (VEGF-A)
VEGF-A у сироватці та асцитній рідині визначали кількісно за допомогою набору Quantikine (R&D Systems, Inc, Міннеаполіс, Міннесота) відповідно до інструкцій виробника.
Кількісне визначення RT-PCR та мРНК
Для приготування РНК використовували Isogen (Wako Pure Chemical Industries, Ltd., Осака, Японія) відповідно до інструкцій виробника. Синтез кДНК проводили з використанням Prime Script Transcriptase (Takara Bio, Inc., Shiga, Японія). Для напівкількісної RT-PCR генетично специфічні фрагменти отримували шляхом лінійно-фазової ампліфікації ПЛР та нормалізували за рівнем β-актину. Конкретними парами праймерів були: VEGF-A 5'-AGACACACCCACCCACATACA-3 '(вперед), 5'-ACATCCTCCTCCCAACACAAG-3' (реверс); індукований гіпоксією фактор (Hif) -1α 5'-GGGTACAAGAAACCACCCAT-3 '(вперед), 5'-GAGGCTGTGTCGACTGAGAA-3' (зворотний); вилка коробки O 3A (FoxO3A) 5'-CTGGGGGAACCTGTCCTATG-3 '(вперед), 5'-CTTCATGCGCGTTCAGAATGA-3' (реверс); β-актин 5'-AGTGTGACGTTGACATCCGT-3 '(вперед), 5'-TGCTAGGAG CCAGAGCAGTA-3' (реверс).
Аналіз WST-8
Для підрахунку клітин ми використовували набір для аналізу WST-8 (Dojindo, Кумамото, Японія) відповідно до інструкцій виробника. Клітини культивували β-OHB (Sigma, Сент-Луїс, Міссурі) при кожній концентрації протягом 48 год, а потім додавали живильне середовище, що містить розчин WST-8. Після 1-годинної інкубації при температурі 37 ° C поглинання в кожній лунці вимірювали на довжинах хвиль 450 нм (довжина хвилі тесту) та 700 нм (контрольна довжина хвилі) за допомогою мікропланшетного зчитувача SH-1000 (CORONA, Ніігата, Японія).
Аналіз розведення карбоксифлуоресцеїну діацетату сукцинімідилового ефіру (CFSE)
Вимірювання поділу клітин проводили методом розведення CFSE, як описано раніше. (16) Коротко, клітини товстої кишки 26 інкубували з CFSE (Wako Pure Chemical Industries, Ltd.) у PBS при 37 ° C протягом 1 години для нанесення флуоресцентної мітки, а потім висівали в 6-лункові планшети щільністю 2 × 10 5 клітин/мл з β-OHB. Через 2 дні інкубації зібрані клітини збуджували лазером при довжині хвилі 488 нм, а інтенсивність флуоресценції CFSE на клітину визначали за допомогою проточного цитометра FACSVerse (BD Biosciences, Сан-Дієго, Каліфорнія).
Статистичний аналіз
Результати виражаються як середнє значення ± SD. Статистичний аналіз проводили за допомогою t-критерію Стьюдента або t-тесту Welch за результатами F-тесту. Для аналізу коефіцієнта виживання використовували метод Каплана-Мейєра, а для порівняння кривої виживання застосовували log-rank тест. Значення Р менше 0,05 вважали статистично значущими.
Результати
Кетогенна дієта продовжує виживання та покращує показники стану здоров’я у мишей з дисемінацією в очеревині
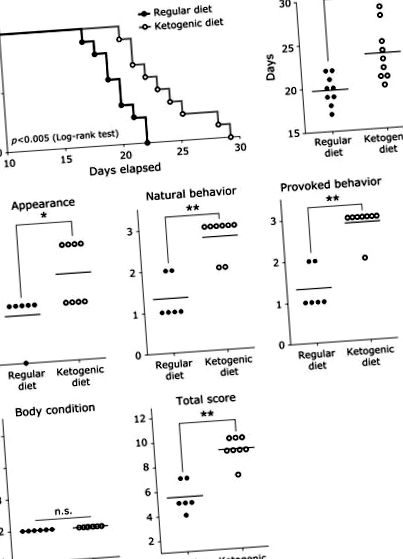
Ми досліджували вплив кетогенної дієти на час виживання та стан здоров'я на мишачій моделі дисемінації очеревини. Миші, які харчувались кетогенною дієтою, мали статистично збільшений час виживання порівняно з мишами, які годувались звичайною дієтою (рис. 1 А). Кетогенна дієтична група значно збільшила середній час виживання в порівнянні зі звичайною дієтичною групою (рис. 1 Б). Оцінки стану здоров’я, зовнішнього вигляду, природної поведінки та спровокованої поведінки були значно вищими в групі кетогенної дієти порівняно з групою звичайних дієт, тоді як показники стану тіла (оцінка 2) не відрізнялися між групами. Загальний бал був вищим у групі кетогенної дієти порівняно з групою звичайної дієти (рис. 1 С). Слід зазначити, що показники природної поведінки та спровокованої поведінки в групі кетогенної дієти були дуже високими.
Вплив кетогенної дієти на час виживання та стан здоров'я у мишей з дисемінацією в очеревині. (A) Крива виживання Каплана-Мейєра мишей, що несуть 26 товстої кишки, годували звичайною дієтою або кетогенною дієтою. Було проведено тест Log-rank для розподілу виживання (р 2). Примітно, що не було значної різниці у вазі пухлини очеревини між цими двома групами, але миші, які отримували звичайну дієту, мали велику кількість геморагічного асциту, тоді як у мишей, які годувались кетогенною дієтою, накопичення асциту майже не накопичувалось. Ці результати свідчать про те, що маса тіла звичайної дієтичної групи була збільшена через збільшення накопичення асциту і що подовження часу виживання в групі кетогенних дієт відбулося не через зменшення пухлини очеревини, а покращення накопичення асциту.
Кетогенна дієта зменшує вироблення VEGF-A з клітин пухлини in vivo
Далі ми зупинились на ефекті зменшення затримки асцитної рідини кетогенною дієтою. Формування асциту включає посилення мікрососудів очеревини, проникність ендотеліальних клітин, інвазію та метастазування пухлинних клітин та аноксичне середовище порожнини очеревини, які пов’язані з VEGF-A. (17–20) Тому ми перевірили, чи впливала кетогенна дієта на вироблення VEGF-A, який бере участь у накопиченні асциту. (21) Миші в групі кетогенної дієти продемонстрували значне зниження рівня VEGF-A в сироватці крові та асциті порівняно з групою звичайних дієт (рис. 4 A та B). Крім того, рівні мРНК VEGF-A в пухлині очеревини були низькими в групі кетогенної дієти. Ген VEGF індукується Hif-1, фактором транскрипції, а активність транскрипції Hif-1 залежить від експресії субодиниці Hif-1α. (22) Отже, ми вимірювали рівні мРНК Hif-1α у пухлинах, але не було суттєвої різниці між цими двома групами (рис. 4 C та D). Хоча задіяний механізм незрозумілий, ці дані свідчать про те, що кетогенна дієта зменшує накопичення асциту, пригнічуючи вироблення VEGF-A з пухлин на рівні транскрипції.
Вплив β-OHB на проліферацію товстої кишки 26 та продукцію VEGF-A in vitro. (А) Репрезентативні мікрофотографії клітин товстої кишки 26 за відсутності або присутності β-OHB у зазначених концентраціях через 48 годин. Мікрофотографії були зроблені зі збільшенням × 40. (B) Підрахунок клітин проводили за допомогою аналізу WST-8. Наведені результати є середнім значенням ± SD. (C) Проліферація клітин, оцінена методом розведення CFSE. Помічені CFSE клітини ободової кишки 26 обробляли різними дозами β-OHB. Через 48 год інтенсивність флуоресценції CFSE визначали кількісно за допомогою аналізів проточної цитометрії. (D) Оптичні щільності рівнів мРНК FoxO3A та β-актину в клітинах товстої кишки при кожній концентрації β-OHB після 48 годин інкубації. Результати аналізували за допомогою напівкількісного RT-RCR. (E) Експресія FoxO3A нормалізувалася за допомогою β-актину. (F) Клітини товстої кишки 26 обробляли різними дозами β-OHB. Через 48 годин VEGF-A в супернатанті культури вимірювали методом ІФА. Наведені результати є середнім значенням ± SD. 5-FU, 5-фторурацил.
Обговорення
У цьому дослідженні ми продемонстрували, що кетогенна дієта продовжила час виживання та покращила накопичення асциту, харчових маркерів та симптомів анемії, не пригнічуючи прогресування пухлини на мишачій моделі дисемінації очеревини. Недавні дослідження повідомили, що кетогенна дієта пригнічувала прогресування пухлини, а кетонові тіла безпосередньо знижували життєздатність пухлинних клітин. (25,26) Тут ми виявили, що кетогенна дієта збільшувала концентрацію кетонового тіла в крові мишей з перитонеальною дисемінацією, хоча in vivo зміни ваги пухлини не спостерігалося. Крім того, β-OHB, кетонове тіло, не змінює ріст пухлинних клітин in vitro. Інші дослідження повідомляли, що кетонові тіла сприяли розвитку клітин раку молочної залози людини. (27) Не всі пухлини беруть участь в аеробному гліколізі, «ефект Варбурга», і ракові клітини використовують як гліколіз, так і окисне фосфорилювання мітохондріями для задоволення своїх метаболічних потреб. (28) Відмінності між цими звітами можуть бути пов’язані з різними шляхами виробництва енергії, специфічними для кожної ракової клітини. Отже, це свідчить про те, що β-OHB не мав протипухлинної активності, оскільки клітини товстої кишки, 26, використані в цьому дослідженні, можуть не залежати від аеробного гліколізу.
Підводячи підсумок, кетогенна дієта продовжила час виживання та покращила моторні показники та накопичення асциту, не пригнічуючи ріст пухлини на мишачій моделі дисемінації очеревини. Поліпшення стану асциту може бути пов’язане із загасанням VEGF-A в пухлині, але детальний механізм незрозумілий. Кетогенна дієта може посилити ефективне вироблення АТФ у м’язах. Клінічно кетогенна дієта може бути одним із підходів до поліпшення якості життя у пацієнтів з перитонеальною дисемінацією.
Внески автора
Е. Касумі провів усі досліди і написав рукопис. Н. Сато керував загальним дослідницьким проектом.
Подяка
Ми дякуємо пані Ю. Кузумакі за догляд за тваринами; Пані Н. Йошида для культури клітин; Пан К. Сугімура, С. Чийокава, С. Шинохара та К. Шигемі за допомогу в підготовці експериментальних дієт на тваринах. Ми також дякуємо пану М. Садакаті та Х. Кудзуоці за корисну дискусію.
- Кетогенна дієта є потужним засобом проти раку - лікування КК
- Гіпокалорійна дієта на основі бобових знижує прозапальний статус та покращує метаболічні особливості в
- Будь-яка інформація про Фонд кетогенної дієтичної епілепсії
- Проста модель дієти та хімічних препаратів мишачого NASH із швидким прогресуванням стеатогепатиту,
- Яблучна оцтова дієта для схуднення, що вживає до їжі, покращує травлення, здоров’я кишок