Калорійне обмеження досвіду перепрограмує стресові та орексигенні шляхи та сприяє харчуванню
Діана Є. Панькевич
Кафедра біології тварин, Університет Пенсільванії, Філадельфія, Пенсильванія 19104
Сара Л. Тігарден
Кафедра біології тварин, Університет Пенсільванії, Філадельфія, Пенсильванія 19104
Андрій Д. Хедін
Кафедра біології тварин, Університет Пенсільванії, Філадельфія, Пенсильванія 19104
Кетрін Л. Дженсен
Кафедра біології тварин, Університет Пенсільванії, Філадельфія, Пенсильванія 19104
Трейсі Л. Бейл
Кафедра біології тварин, Університет Пенсільванії, Філадельфія, Пенсільванія 19104
Анотація
Вступ
Дієта як спосіб поведінкової модифікації в управлінні вагою виявилася мало успішною в довгостроковій перспективі з частотою відмов> 80% (Wing and Phelan, 2005). Підвищений рівень відновлення ваги та підвищений ризик діабету та пов’язаних із цим метаболічних захворювань після дієти роблять визначення нових терапевтичних цілей критичним (Lissner et al., 1991; Brownell and Rodin, 1994; Guagnano et al., 2000). Сучасні методи лікування переважно зосереджені на зниженні апетиту, хоча менше відомо про центральні механізми, що сприяють стійкості та відмові від лікування, особливо щодо залучення стресових шляхів.
Оскільки стрес і гормон стресу кортикотропін-вивільняючий фактор (ХНН) є відомими промоторами збільшення споживання калорійно щільної їжі, перепрограмування схеми стресу може бути центральним механізмом, що приводить до повторних дієт, або ефекту "йо-йо", що призводить до збільшення ризик збільшення ваги та пізніше ожиріння (Epel et al., 2001; Dallman et al., 2006; Amigo and Fernández, 2007; Teegarden and Bale, 2008). Індукована стресом активація осі стресу гіпоталамус-гіпофіз – наднирники (ГПА) та вивільнення ХНН збільшує поведінку, що прагне винагороди (Dallman et al., 2005; Ghitza et al., 2006). Антагонізм ХНН в ядрі ліжка stria terminalis (BNST) зменшує спричинене стресом відновлення ліків, тоді як ін’єкція ХНН сприяє пошуку наркотиків, демонструючи перетин шляхів стресу та винагороди (Erb and Stewart, 1999; Koob, 2009). Докази цих та інших досліджень свідчать про те, що стрес відіграє вирішальну роль у підвищенні споживчої поведінки корисних речовин, включаючи калорійну їжу (Shaham et al., 2000; Sinha, 2001; Wang et al., 2005; Dallman et al., 2006; Teegarden and Bale, 2008).
Ми припустили, що попередній досвід обмежень призведе до змін у нейроциркуляції стресу, що призведе до подальшої підвищеної чутливості до стресу та тенденції до надмірного споживання їжі з високим вмістом жиру. Для вивчення цієї гіпотези ми порівняли фізіологічні та поведінкові стресові реакції на мишій моделі обмеження калорій, яка забезпечує зниження маси тіла на 10–15%, рівні, характерні для схуднення людини під час дієти (Redman et al., 2007; Sarwer et al. ., 2009). Визначено довгостроковий вплив та програмний ефект цього помірного обмеження на поведінкові заходи та реагування на стрес. Механічно досліджували експресію ХНН та метилювання промотору. На додаток до зменшення калорійності, головним компонентом дієти людини є зменшення вмісту жиру та смаку дієти. Раніше ми показали на мишах, що вихід з дієти з високим вмістом жиру збільшує відносний стрес і сприяє відновленню поведінки, при якій миші вибирають неприємне середовище, щоб отримати доступ до бажаної дієти з високим вмістом жиру (Teegarden and Bale, 2007). Тому ми аналогічним чином порівняли моделі експресії та метилювання ХНН до 8 тижнів після відмови від дієти з високим вмістом жиру, демонструючи довгострокове програмування, яке відбувається.
Щоб дослідити поведінковий вплив епігенетичних модифікацій схем стресу на споживання їжі, ми дослідили переїдання їжі з високим вмістом жиру після хронічного стресу у раніше обмежених мишей. Крім того, оцінювали чутливість до антагоніста рецептора-1 до концентрації меланіну (МСН) щодо цієї поведінки. Разом ці результати можуть забезпечити нові терапевтичні напрямки, за допомогою яких розробляються більш ефективні та тривалі методи лікування ваги.
Матеріали і методи
Тварини
Усі миші в цих дослідженнях були самцями (C57BL/6J; віком 7–8 тижнів), отриманих з лабораторії Джексона та розміщених індивідуально за графіком 12 годин світло/темно з наявністю їжі та води за бажанням, за винятком випадків, коли зазначено інше. Домашня чау містила 28% білка, 60% вуглеводів і 12% жиру за калоріями та 4,00 ккал/г (дієта Purina Lab). Дієта з високим вмістом жиру містила 20% білка, 35% вуглеводів і 45% жиру за калоріями та 4,73 ккал/г (Дієти досліджень). Цю дієту вкрай бажано використовувати у домашніх умовах на мишах C57BL/6J (Teegarden and Bale, 2007). Всі дослідження проводились відповідно до Університету Пенсільванії, Університетської лабораторії тваринних ресурсів та інституційних стандартів та рекомендацій Комітету з догляду та використання тварин.
Обмеження калорійності
Середньодобове споживання їжі було встановлено протягом 10 днів. Миші були випадковим чином призначені для обмеження калорій (Rstr), 75% середнього споживання калорій або груп лікування ad libitum (Rstr, n = 41; ad libitum, n = 37). Це зниження було обрано з метою зниження маси тіла на 10–15% для імітації типових режимів харчування у людей. Для обмежених груп попередньо зважені гранули домашнього чау поміщали в клітини за 2,5 год до вимкнення світла на 21 день. Цей графік використовувався для того, щоб забезпечити доступ мишей до їжі до і після вимкнення світла, коли відбувається більша частина споживання їжі, та щоб уникнути захоплених їжею осциляторів, дозволяючи споживання в темну фазу (Mendoza, 2007). Вагу тіла реєстрували кожні 2–3 дні.
Лептин
Щоб визначити вплив обмеження калорій та дієтичного харчування чау-чау чи жирного харчування на рівень лептину, під час вбивства підгрупи мишей (ad libitum, n = 11; Rstr, n = 12) отримували зразок крові. Зразки центрифугували, плазму збирали і заморожували при -80 ° C до аналізу. Рівні плазми вимірювали за допомогою радіоімунологічного аналізу лептину (LINCO Research). Протокол був модифікований з використанням 50 мкл плазми для кожного аналізу, і кожна проба оцінювалась у двох примірниках. Коефіцієнт варіації внутрішнього аналізу становив (−ΔCT) для кожної проби і нормалізував кожне значення до середнього для контрольної чау.
Аналіз метилювання ДНК.
Було проаналізовано вплив обмеження калорійності, годування чау або відмови з високим вмістом жиру на статус метилювання специфічних динуклеотидів CpG у промоторній області миші ХНН (McGill et al., 2006). Геномна ДНК із CeA та BNST була виділена з мікропробивачів. Коротко кажучи, тканину додавали безпосередньо до високомолекулярного буфера для екстракції ДНК (1 м Tris-HCl, EDTA, SDS та води) плюс РНКазу А та інкубували протягом 1 год при 37 ° С з подальшим додаванням протеїнази К та інкубацією протягом ночі при 55 ° C. Далі проводили екстракцію хлороформом/ізоаміловим спиртом перед тим, як ДНК осаджували ацетатом натрію та глікогеном при -80 ° C протягом 1 год з наступним центрифугуванням (10 хв, 12000 об/хв, кімнатна температура). Гранулу зберігали і ресуспендували в буфері ТЕ. Піросеквенування проводили EpigenDx, як описано раніше (Kim et al., 2007; Liu et al., 2007). Коротко, проводили модифікацію бісульфату, перетворюючи неметильований цитозин в урацил. Послідовність промотора для гена CRF ампліфікували ПЛР і біотинільований продукт очищали для піросеквенування. Специфічні для праймера праймери були розроблені для визначення статусу метилювання динуклеотиду CpG.
Стресове переїдання
Скасування дієти з високим вмістом жиру, спричинене запоєм
Статистичний аналіз
Відмінності у вазі та рівнях лептину в плазмі крові аналізували або за допомогою t-критерію Стьюдента, або одностороннього ANOVA. Дані про кортикостерон аналізували за допомогою двостороннього повторного вимірювання ANOVA для обмеження та часу. Для TST дані аналізували за допомогою t-критерію Стьюдента. Для експресії гена ХНН після обмеження калорійності або відмови з високим вмістом жиру дані аналізували за допомогою односторонньої ANOVA за допомогою пост-хост-тестів PLSD Фішера. Дані метилювання аналізували за допомогою одностороннього ANOVA, щоб визначити різницю між групами в межах кожного сайту GpC та загальне метилювання у промоторі. Для 10-денного запою, спричиненого стресом, дані аналізували за допомогою одностороннього повторного вимірювання ANOVA з контрольною та CVS-групами, проаналізованими окремо. Дані про загальне споживання калорій під час запою були проаналізовані за допомогою критерію t Стьюдента. Для аналізу експресії генів орексигенних гормонів обчислювали складчасті зміни відносно контролю ad libitum chow, а двосторонній ANOVA використовували з пост-тестами PLSD Fisher. Для скасування запою, спричиненого виведенням жиру, дані перших 3 днів аналізували за допомогою одноразового повторного вимірювання ANOVA, а дані четвертого дня аналізували за допомогою двостороннього ANOVA за допомогою пост-хост-тестів PLSD Фішера . Весь статистичний аналіз проводився за допомогою SigmaStat (програмне забезпечення Systat).
Результати
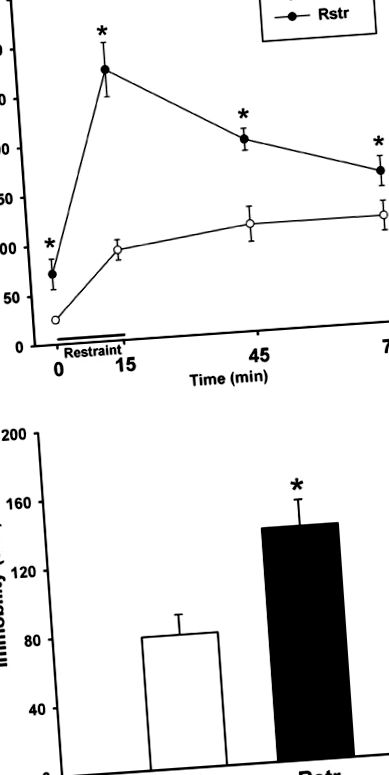
Обмеження калорій, спричинене стресовою чутливістю
Вага тіла та лептин
Самці мишей, які калорійно обмежують до 75% норми споживання чау, демонструють значну втрату ваги наприкінці 3 тижнів обмеження. За 3 тижневі періоди контрольні миші набрали вагу (t (20) = -4,294; p ≤ 0,001), тоді як обмежені миші втратили вагу (t (22) = 8,214; p ≤ 0,001); таким чином, наприкінці обмеження ваги були суттєво різними (t (21) = 11,815; p ≤ 0,001). Рівні лептину в плазмі крові вимірювали на підгрупі мишей, убитих наприкінці 3-тижневого періоду обмеження. Калорійно обмежені миші мали значно нижчий рівень лептину (t (8) = 2,715; p = 0,03) (Таблиця 1).
Таблиця 1.
Вага тіла та рівень лептину після обмеження калорій
| Ad libitum | 25,7 ± 0,2 | 27,3 ± 0,3 | 10,4 ± 1,1 |
| Вул | 26,3 ± 0,3 | 22,7 ± 0,3 * | 7,0 ± 0,5 * |
Вираз ХНН
Перепрограмування шляхів стресу з відміною жиру
Вираз ХНН
Стресове переїдання
Ваги тіла
Після обмеження калорійності контрольні миші важили значно більше, ніж миші з обмеженою калорійністю (t (34) = 6,971; p ≤ 0,001). Після 3-тижневого обмеження мишей знову поміщали на чаші ad libitum (повторне вигодовування), поки суттєва різниця у вазі між контрольними та обмеженими мишами більше не була присутньою до початку обмеженого доступу, щоб переконатися, що різниця в споживанні не пов'язана з різницею у вазі. Ваги постійно контролювались і під час обмеженого доступу, і не було значних відмінностей під час або в кінці цих випробувань (Таблиця 2).
Таблиця 2.
Вага тіла після переїдання з високим вмістом жиру
| Ad libitum | 24,5 ± 0,3 | 26,9 ± 0,4 | 27,4 ± 0,3 |
| Вул | 23,0 ± 0,3 * | 26,6 ± 0,4 | 27,1 ± 0,4 |
* Вплив обмеження калорій (p ≤ 0,001).
Обмежений доступ
Таблиця 3.
Вага тіла через 1 тиждень ad libitum з високим вмістом жиру
| Ad libitum | 24,9 ± 0,4 | 26,7 ± 1,1 |
| Вул | 23,8 ± 0,2 * | 27,5 ± 0,5 |
* Вплив обмеження калорій (p Рис. 5 A). Аналіз експресії гена орексину виявив взаємодію між обмеженням та дієтою (F (1,12) = 16,577; p Рис. 5 B).
Попереднє зниження калорій значно посилює реакцію орексигенних гормонів на дієту з високим вмістом жиру. A, Рівні MCH в ЛГ були значно збільшені у калорійно обмежених мишей, які отримували дієту з високим вмістом жиру, порівняно з мишами ad libitum, які отримували їжу з високим вмістом жиру (n = 4–5) (* p Рис. 6). Попереднє обмеження калорій не збільшувало споживання чау (рис. 6 С) або загальне споживання калорій (рис. 6 Д). Четвертого дня обмеженого доступу жоден препарат не впливав на споживання калорій з високим вмістом жиру; однак ефект обмеження зберігався у мишей, які раніше мали обмежену калорійність, і мали більшу калорійність споживання жиру в гранулах порівняно з контролем (F (1,41) = 9,072; p Рис. 6 B). Двадцятичотиригодинне споживання чау було суттєво змінено внаслідок лікування наркотиками (F (2,41) = 3,678; p Рис. 6 D). Загальне споживання калорій за двадцять чотири години суттєво змінилося внаслідок лікування наркотиками (F (2,41) = 4,128; p Рис. 6 F).
- Обмеження калорій та регенерація м’язів Гарвардський інститут стовбурових клітин (HSCI)
- Обмеження калорій зменшує спричинене ожирінням запалення молочних залоз у мишей - PubMed
- Випивка та таємне харчування; Нутрі Низький
- Обмеження калорій менше їсть змушує мавп жити довше
- Наркоманія в соціальних мережах - це як запої