Інфільтруючі лейкоцити оточують ранні ураження виразки Бурулі, але не можуть досягти міколактону, що продукує мікобактерії
Марі-Терез Руф
швейцарський Інститут тропічного та громадського здоров'я, Базель, Швейцарія
b Базельський університет, Базель, Швейцарія
Крістіна Штеффен
c Хірургічне відділення лікарні Кернс, Кернс, QLD, Австралія
Міріам Болц
швейцарський Інститут тропічного та громадського здоров'я, Базель, Швейцарія
b Базельський університет, Базель, Швейцарія
Пітер Шмід
швейцарський Інститут тропічного та громадського здоров'я, Базель, Швейцарія
b Базельський університет, Базель, Швейцарія
Герд Плюшке
швейцарський Інститут тропічного та громадського здоров'я, Базель, Швейцарія
b Базельський університет, Базель, Швейцарія
Таблиця 1.
| Номер пацієнта | Вік (роки) | Стать | Розміщення тіла ураження | Наявність ураження (тижні) |
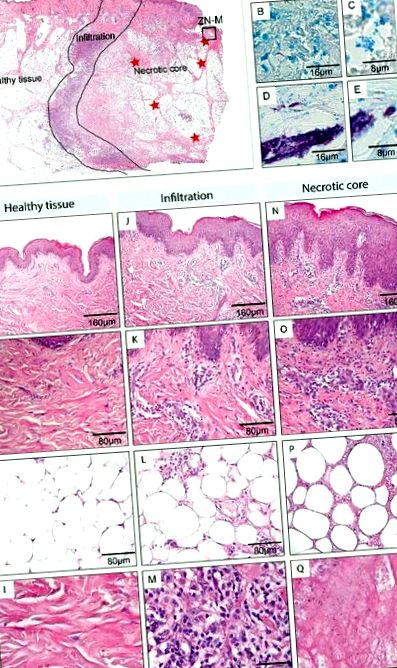
| 1 | 7 | F | Ліва нога | 1 Знімки були зроблені або за допомогою камери Leica DFC 420C, або за допомогою Aperio ScanScope XT. Межа ділянки тканини, ураженої цим захворюванням, позначається чорною лінією на фарбуванні ВІН (A, D, G, J, M). Для пацієнтів показано один і 2 поперечні зрізи через цілі ураження (A, D), ураження пацієнтів від 3 до 5 (G, J, M) були занадто великими, щоб бути повністю обробленими, і тому лише половина ураження показана з ядро некротичного ураження у верхньому правому куті. Фарбування ZN (B, E, H, K, N) виявило, що AFB були виявлені виключно в некротичних зонах (червоні зірки). Переважали скупчення позаклітинних бактерій (C, I, O), проте поблизу поясу інфільтрації спостерігались поза-, а також внутрішньоклітинні бактерії (F, L). Подібні висновки були зроблені для всіх 12 аналізованих уражень. |
Фарбування TUNEL. Протокол TUNEL дозволяє фарбувати фрагменти ДНК з низькою молекулярною масою, які зазвичай трапляються під час апоптозу (фарбування в коричневий колір). Зрізи пацієнтів від 1 до 5 фарбували за допомогою “In Situ Cell Death Detection Kit, POD” (Кат. № 11684817910) від Roche згідно з протоколом виробника (протокол застосовувався для зрізів тканин з високим неспецифічним фоном). Зустрічне фарбування проводили гематоксиліном. Знімки були зроблені або на камеру Leica DFC 420C, або на Aperio ScanScope XT. Огляд зрізів тканин виявляє дифузне фарбування серцевини некротичного ураження (А1-А4, В1) та відсутність фарбування здорової ділянки тканини. Збільшене збільшення (B2, B3) показало чітке фарбування поодиноких клітин у поясі інфільтруючих клітин (B1 зелена зірка, B2), що представляють клітини, що в даний час переживають апоптоз, і більш дисперсне фарбування всередині некротичного ядра (B1 червона зірка, B3), що представляє залишки Фрагменти ДНК від початкової інфільтрації. Подібні висновки були зроблені для всіх 12 аналізованих уражень.
Склад імунного інфільтрату, який оточує некротичне ядро. Серійні зрізи з ураження пацієнта 5 фарбували за допомогою імуногістохімії. За протоколом виробника використовувались наступні антитіла: Еластаза (поліморфноядерні нейтрофіли, NP57, Dako, M0752), CD3 (Т-лімфоцити, Dako, A0452), CD68 (макрофаги/моноцити, KP1, Dako, M0814) та CD20 (B лімфоцити, 7D1, Novocastra, NCL - CD20–7D1). Знімки були зроблені або на камеру Leica DFC 420C, або на Aperio ScanScope XT. CD20-позитивні В-клітини (А1, В1) були присутніми в кластерах, тоді як CD3-позитивні Т-клітини (А2, В2), N-еластаза-позитивні нейтрофіли (А3, В3) та CD68-позитивні макрофаги (А4, В4) були присутніми протягом всієї інфільтрації ремінь шарувато. Скупчення нейтрофілів додатково були присутні поблизу вторинної інфекції (А3, червоне пунктирне коло).
Ранні імунні реакції у багатьох випадках можуть допомогти стримати інфекції M. ulcerans та запобігти клінічному захворюванню на БО, на що вказує розвиток серологічної відповіді на М. ulcerans у багатьох здорових людей, які проживають в африканських ендемічних районах БО. 38–40 Ми припускаємо, що для розвитку хронічної інфекції після щеплення M. ulcerans може бути критично важливим, що може розвинутися досить великий бактеріальний кластер, який генерує захисну хмару міколактону. Після внутрішньоклітинного розмноження та вбивства клітини-хазяїна скупчення бактерій, подібних глобі, можуть бути відправною точкою для розвитку великих позаклітинних скупчень M. ulcerans. 41–43 На ранніх, але тим не менше встановлених ураженнях, як аналізували тут, інфільтруючі імунні клітини вже не можуть досягти позаклітинних мікобактерій у некротичному центрі, незважаючи на масивну екстравазацію лейкоцитів. З іншого боку, шар інфільтруючих клітин навколо ядра ураження може, разом з іншими факторами, такими як утворення рясного позаклітинного матриксу 44, перешкоджати поширенню мікобактерій в лімфу та кров. Це може сприяти тому, що більшість пацієнтів з БО мають єдине ураження. 2
В даний час спосіб передачі M. ulcerans не ясний. 45 Зачеплені як укуси комах, так і пряме посів бактерій у шкіру з водоймища навколишнього середовища після травми шкіри. Після щеплення рання внутрішньомакрофагальна фаза росту може зіграти певну роль у розвитку захворювання. 15, 46 У ранніх ураженнях, проаналізованих тут, AFB були виявлені виключно в некротичному ядрі уражень (червоні зірки на рис. 1B, E, H, K, N) і виглядали головним чином у вигляді позаклітинного скупчення (рис. 1I, O) . Однак, коли присутні поблизу пояса інфільтрації, деякі мікобактерії виявилися внутрішньоклітинними (рис. 1C, F, L). Як і при більш запущених ураженнях, 47 AFB, як правило, виявляються в підшкірній клітковині і лише рідко в дермі. Переважне розташування M. ulcerans у глибших підшкірних ділянках може або відображати шлях щеплення, або тропізм, пов’язаний з харчовими потребами, що забезпечуються лише зруйнованою жировою тканиною. 47
Коли ранні імунні відповіді не усувають інокулят M. ulcerans, може розвинутися хронічна інфекція, і клітини, що проникають, позаклітинних скупчень мікобактерій більше не можуть досягти. Однак утворення поясу інфільтрації навколо некротичного ядра ураження, описаного тут, швидше за все, допомагає запобігти системному поширенню інфекції; але це не може запобігти локальному розмноженню бактерій з подальшим прогресуючим виразковим процесом.
Розкриття потенційних конфліктів інтересів
Жодного потенційного конфлікту інтересів не розкрито.
Подяка
Ми хотіли б подякувати доктору Ліндсі Віндхем, Патологія Квінсленд, Кернс та доктору Яну Кенціану, Салліван і Ніколаїдес Патологія Пті Лтд за підготовку та перевірку слайдів. Крім того, ми дякуємо Вінсенту Романе, Кароліні Сторк, Ернесті Даммасі та Патрісії Барзагі Рінаудо з Novartis Basel за чудову технічну підтримку та надання доступу до лабораторного обладнання для гістопатології.
Фінансування
Цю роботу підтримав Фонд Медикора.
- Норми кривої росту та оцінка раннього надлишку ваги у грудному віці - PubMed
- Як безпечно досягти оптимального гоночного тренувального піку
- Як подавати здорові вегетаріанські страви в дитячій кімнаті Унікальна дитина вчить ранні роки
- Журнал «Харчування людини та дієтологія»
- Дженніфер Еністон наказала схуднути на 30 фунтів на початку своєї кар'єри, стверджує книга Fox News