Харчовий шлях у дослідженні резекції стравоходу II (NUTRIENT II): протокол дослідження для багатоцентрового відкритого рандомізованого контрольованого дослідження
Гійс Х К Беркельманс
1 відділення хірургії лікарні Катаріни, Ейндговен, Нідерланди
Bas J W Wilts
1 відділення хірургії лікарні Катаріни, Ейндговен, Нідерланди
Ewout A Kouwenhoven
2 Кафедра хірургії, лікарняна група Твенте, Алмело, Твенте, Нідерланди
Коші Кумагай
3 відділення хірургії, CLINTEC, Інститут Каролінської та Центр хвороб травлення, Університетська лікарня Каролінської, Стокгольм, Швеція
4 Кафедра гастроентерологічної хірургії, лікарня Інституту раку, Японський фонд дослідження раку, Токіо, Японія
Магнус Нільссон
3 відділення хірургії, CLINTEC, Інститут Каролінської та Центр хвороб травлення, Університетська лікарня Каролінської, Стокгольм, Швеція
Теус Дж. Вейс
1 відділення хірургії лікарні Катаріни, Ейндговен, Нідерланди
Grard A P Nieuwenhuijzen
1 відділення хірургії лікарні Катаріни, Ейндговен, Нідерланди
Марк Дж ван Дет
2 Кафедра хірургії, лікарняна група Твенте, Алмело, Твенте, Нідерланди
Міша Д П Луєр
1 відділення хірургії лікарні Катаріни, Ейндговен, Нідерланди
Анотація
Вступ
Ранній початок прийому оральної дієти є безпечним та корисним для більшості типів шлунково-кишкових хірургічних втручань і є важливою частиною швидких та вдосконалених протоколів відновлення. Однак доцільність та безпечність прийому всередину безпосередньо після езофагектомії залишаються незрозумілими. Метою цього дослідження є дослідження наслідків раннього та відстроченого початку прийому всередину на післяопераційне відновлення після езофагектомії.
Методи та аналіз
Сильні сторони та обмеження цього дослідження
Відкрите багатоцентрове рандомізоване контрольоване дослідження.
Велика кількість учасників (n = 148).
Результати, які повідомляють пацієнти щодо якості життя та економіки здоров’я.
Післяопераційний протокол у цьому дослідженні може бути не застосовним до інших лікарень, враховуючи величезну різноманітність протоколів післяопераційної допомоги.
Включені лише пацієнти, які проходять малоінвазивну езофагектомію з внутрішньогрудним анастомозом.
Вступ
Програми посиленого відновлення після операції (ERAS) все частіше застосовуються після езофагектомії, що призводить до скорочення тривалості перебування, періопераційної захворюваності та лікарняних. 1 Ранній початок прийому оральної дієти є важливою частиною протоколів ERAS і, як було показано, є безпечним та корисним для більшості видів шлунково-кишкових операцій. 2–6 Однак доцільність та безпечність прийому всередину безпосередньо після езофагектомії залишаються незрозумілими. 7
Здебільшого, режим першого прийому через рот застосовують протягом першого післяопераційного тижня, а для обходу анастомозу ставлять носоеюнальну трубку або трубку єюностомії. 8 9 Вважається, що це зменшує частоту та тяжкість післяопераційної пневмонії та витоку анастомозу, хоча причинно-наслідкових зв'язків встановлено не було. З іншого боку, назоєюнальна трубка або єюностомія можуть спричинити дискомфорт у пацієнта та пов’язані з ускладненнями, які можуть заважати одужанню. 7 10
Найкращий час для початку прийому всередину після езофагектомії невідомий. В двох ретроспективних когортних дослідженнях було виявлено, що затримка початку пероральної дієти на 4 тижні після езофагектомії була корисною. 11 12 В обох дослідженнях було виявлено значне зменшення витоку анастомозів із тривалою затримкою перорального харчування після езофагектомії в порівнянні із звичайним 5-7-денним режимом прийому всередину. Однак ці дослідження мали ризик упередженості, і екстраполяція цих результатів на клінічну ситуацію може бути недійсною. 11 12
З іншого боку, раннє розпочинання перорального харчування виявилося можливим у багатьох типах хірургічних втручань верхніх відділів шлунково-кишкового тракту. 4 13 Крім того, дослідження техніко-економічного обґрунтування показало, що прямий прийом всередину після езофагектомії є здійсненним і не призводить до збільшення основних ускладнень. Легеневі ускладнення не мали суттєвих відмінностей у пацієнтів, яких годували перорально безпосередньо після операції, у порівнянні з історичною когортою, при якій пероральний прийом затримувався. Цікаво, що прямий прийом всередину навіть призвів до менших післяопераційних легеневих ускладнень. Залишається незрозумілим, яка найкраща стратегія для протоколів післяопераційної дієти на ранній післяопераційній фазі після езофагектомії.
Метою цього дослідження є дослідження наслідків раннього початку та відстроченого початку прийому всередину на післяопераційне відновлення після езофагектомії.
Методи та аналіз
Дизайн
Дизайн цього дослідження - багатоцентрове перспективне відкрите рандомізоване контрольоване дослідження, проведене в лікарні Катаріни Ейндговен та лікарняній групі Твенте. Обидві лікарні знаходяться в Нідерландах. Для збільшення рівня включеності будуть звертатися до додаткових центрів. Метою цього дослідження переваги є дослідження наслідків раннього початку та відстроченого початку прийому всередину на післяопераційне функціональне відновлення після езофагектомії. Очікується, що пацієнти будуть включені протягом 2 років. На підставі попереднього дослідження очікується, що 80–90% пацієнтів, які мають право на участь, можуть бути включені. Періопераційні протоколи стандартизовані.
Навчання населення
Пацієнти, які проходять елективну малоінвазивну або гібридну (лапароскопію та торакотомію) езофагектомію при раку з внутрішньогрудним анастомозом, мають право на включення. Вони повинні бути віком не менше 18 років. Критеріями виключення є неможливість прийому всередину (вроджені або травматичні анатомічні відхилення), неможливість розміщення їюностомії, що не годує, неможливість надати письмову згоду, розлад ковтання, ахалазія, втрата ваги Карнофського на 15% перед початком операції. Слідчий та відповідальний хірург перевіряють відповідність вимогам. Пацієнт отримає письмову та усну інформацію про це дослідження під час призначеного прийому. Запропоновано достатньо часу, щоб дізнатись про деталі цього судового розгляду.
Розрахунок обсягу вибірки та статистичний аналіз
Розрахунок обсягу вибірки базується на функціональному відновленні як основному результаті. Функціональне відновлення - це час хірургічного відновлення згідно з визначенням, описаним раніше. 15–17 На підставі історичних контрольних досліджень, пацієнти, які отримували відстрочене пероральне годування, принаймні вважалися функціонально відновленими середньо 12 днів після операції. Пацієнти, яких годували перорально безпосередньо після езофагектомії, отримували принаймні функціональне відновлення на 10 день після операції (середнє значення). Використовуючи потужність 80%, α 5% та SD 4 дні, для демонстрації цієї різниці потрібно загалом 128 пацієнтів (64 пацієнти в кожній групі). Очікується, що первинний результат, як правило, не буде розділений, і тому необхідно додаткове 15% включення, що вимагає загальної кількості 148 пацієнтів (74 пацієнти в кожній групі). Незалежний лікар проведе аналіз безпеки для 50 та 100 пацієнтів. Для анастомотичних витоків, (аспіраційної) пневмонії або смертності застосовується принцип Гейттла-Пето.
Рандомізація
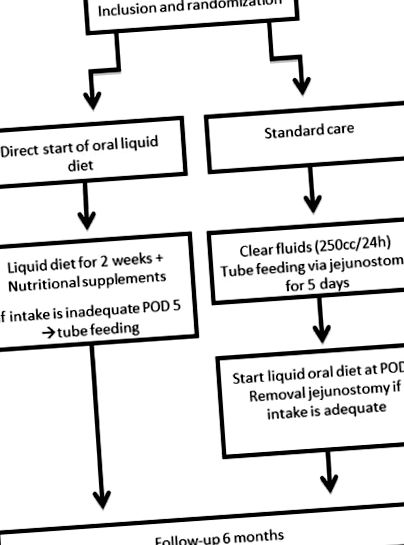
Після отримання письмової інформованої згоди пацієнти будуть випадковим чином віднесені до однієї з двох груп за допомогою програмного забезпечення для рандомізації через Інтернет (Система управління даними клінічних досліджень TENALEA). Ця комп'ютеризована програма створить список рандомізації. Буде використаний відповідний веб-сайт про рандомізацію, який генерує послідовний номер рандомізації, що відповідає стратифікованому списку рандомізації при рандомізації пацієнта. Лікарня включення та лікування та тип хірургічного втручання (гібридна/повна малоінвазивна) є критеріями стратифікації в процесі рандомізації. Рандомізація буде проведена до операції та після неоад'ювантної терапії (~ 3 тижні до операції). Результат рандомізації буде повідомлений в амбулаторії, за допомогою телефонного дзвінка або при надходженні (за 1 день до операції). Блок-схема учасників, включених у це дослідження, представлена на малюнку 1 .
Діаграма потоку досліджень. POD5, післяопераційний день 5.
Післяопераційна процедура
Харчова процедура
Пацієнти групи ранньої дієти отримуватимуть рідку пероральну дієту (суп, йогурт, каші, зріджену тверду їжу тощо), яку підтримують харчові добавки (корми для ковтків) безпосередньо після операції до післяопераційного дня 14. Ця рідка дієта для прийому всередину буде поступово розширюватися і тверда дієта почнеться з POD15.
Пацієнти контрольної групи отримуватимуть стандартне зондове годування після операції за допомогою їюностомії. Цим пацієнтам дозволено пити прозору рідину до 250 куб.см/добу. Через 5 днів пацієнти контрольної групи починають приймати рідку пероральну дієту від 2 тижнів і далі. У післяопераційний 20 день почнеться тверда дієта. Харчування в пробірці буде припинено, коли щонайменше 50% щоденних потреб буде задоволено лише харчуванням всередину.
Дієтолог розрахує потреби в енергії для кожного пацієнта, використовуючи формулу Гарріса-Бенедикта з надлишком 30% для витрат енергії в післяопераційній фазі. У післяопераційні дні 2, 5 і 14 вимірюється і обчислюється споживання калорій і білка. Коли пацієнти в групі раннього перорального прийому не досягли споживання> 50% від розрахункових витрат енергії на післяопераційний 5 день, розпочнеться годування через зонд. Зондове годування можна розпочати за допомогою єюностомії, наявної у всіх пацієнтів. Жодне стандартне парентеральне годування не починається для запобігання початку ентерального годування. Якщо ентеральне харчування неможливе або не бажане (наприклад, через хілоторакс), розпочнеться парентеральне годування.
Результати
Основним параметром результату є функціональне відновлення (таблиця 1), яке визначається як післяопераційні пацієнти, які не мають внутрішньовенної рідини, мають адекватний контроль болю, відновлення рухливості до незалежного рівня, достатнє споживання калорій та відсутність ознак активної інфекції. 15–17 Дата функціонального відновлення - це день, коли всі критерії виконані.
Таблиця 1
Критерії функціонального відновлення
| Адекватний контроль болю за допомогою перорального знеболення | Числова шкала оцінок 19 Вимірювання споживання їжі та зливу амілази ретельно контролюється післяопераційно до POD14. Харчовий статус буде вимірюватися з використанням фактичного споживання калорій та білків проти необхідного споживання калорій та білків. |
Якість життя та симптоми оцінюються за допомогою опитувальника „Європейська організація з досліджень та лікування раку” (QLQ-C30/EORTC-OG25). 20 Ці анкети є надійним та дійсним інструментом для дослідження якості життя пацієнтів з раком стравоходу. Пацієнтам пропонується заповнювати цю анкету в Інтернеті або на папері під час регулярного спостереження: на початковому етапі (5 тижнів після неоад’ювантного лікування) та через 6 тижнів, 3 місяці та 6 місяців після операції. Параметри довгострокового результату, такі як локальний рецидив, загальна та специфічна для раку виживаність, будуть реєструватися в базі даних.
Пневмонія визначається відповідно до Єдиного балу пневмонії. 21 Аспіраційна пневмонія оцінюється окремо, визначається як пневмонія після клінічної аспірації слини, рідкої або твердої їжі або блювоти.
Гострий респіраторний дистрес-синдром визначається згідно з Берлінським визначенням. 22
Витікання анастомотів оцінюється згідно з Low et al. 23 і визначається як будь-який ознака витоку езофагогастрального анастомозу при ендоскопії, реоперації, рентгенологічних дослідженнях, післясмертному дослідженні або коли шлунково-кишковий вміст був виявлений у дренажній рідині. Тип I визначається як витік, який лікується внутрішньовенними антибіотиками та режим перорального прийому. Тип II визначається як витоки, які піддаються ендоскопічним або радіологічним реінтервенціям. Тип III визначається як витік, який лікується хірургічним втручанням.
Статистичний аналіз
Всі аналізи будуть проводитись згідно з підходом до лікування, до якого включаються всі рандомізовані пацієнти, незалежно від дотримання протоколу дослідження. Випадки первинної та вторинної кінцевих точок порівнюються між групами лікування. Результати представлені у вигляді коефіцієнтів ризику з відповідними 95% ДІ. Двохвостий p 2 або точний тест Фішера, якщо кількість клітин 7
Раннє ентеральне годування після езофагектомії порівняно з парентеральним годуванням відновлює функцію кишечника 9 та зменшує частоту ускладнень, що загрожують життю. 8 Загальноприйнятою практикою є режим перорального прийому та встановлення катетера для єюностомії протягом першого післяопераційного тижня після езофагектомії. Однак годування їюностомою пов'язане з незначними ускладненнями, включаючи інфікування місця проникнення, витік місця проникнення та симптоми шлунково-кишкового тракту з невеликим ризиком повторної операції та смертності. 7 Це потенційно може завадити функціональному відновленню, що призведе до тривалого перебування в лікарні.
Важливим аргументом для затримки прийому всередину після езофагектомії є зменшення наслідків витоку анастомозу та зменшення ризику (аспіраційної) пневмонії. 11 12 Ці два дослідження базувались на своїх висновках на ретроспективному аналізі історичних даних про пацієнтів. Наскільки нам відомо, жодні проспективні дослідження не порівнювали раннє пероральне годування з відстроченим пероральним годуванням після езофагектомії.
З іншого боку, ранній початок перорального прийому виявився корисним у програмах ERAS у багатьох видах шлунково-кишкової хірургії, включаючи хірургію верхніх відділів шлунково-кишкового тракту. Однак даних, включаючи пацієнтів, які перенесли езофагектомію, небагато. Попереднє випробування з питань безпеки та доцільності, проведене нашою групою, доводить, що прямий прийом всередину після езофагектомії є безпечним і не призводить до збільшення основних ускладнень, таких як пневмонія та анастомотичні витоки (TJ Weijs, GHK Berkelmans, GAP Nieuwenhuijzen, et al. ).
Ми припускаємо, що раннє введення пероральної дієти після операції на стравоході може поліпшити функціональне відновлення в середньому за 2 дні. Крім того, можливі майбутні переваги включають менший дискомфорт під час їюностомічного годування, а його потенційні ускладнення та якість життя можуть бути покращені шляхом раннього початку перорального прийому.
Виноски
Учасники: GHKB, TJW, MDPL, EAK та MJvD розробили дослідження. GHKB та MDPL написали пропозицію етичного комітету. GHKB, BJWW, TJW, MDPL, EAK, MJvD, KK, MN та GAPN сприяли написанню протоколу дослідження.
Конкуруючі інтереси: Жоден не задекларований.
Затвердження етики: Форми інформованої згоди даного протоколу, навчальні матеріали та матеріали для набору переглядаються та затверджуються (1 вересня 2015 р.) Комітетами з питань етики медичних досліджень (MEC-U).
Походження та експертна оцінка: Не введено в експлуатацію; зовнішня експертна оцінка.
- Вивчіть протокол диференціального впливу дієти та втручань на основі фізичної активності під час вагітності
- Стратегії харчування та годівлі для мінімізації втрат поживних речовин у гною для худоби Свинарник
- Вивчіть простий харчовий принцип, що стоїть за всіма успішними втратами ваги; Дієти; Сучасний монах охорони здоров'я
- Харчовий статус, карієс зубів та прорізування зубів у дітей - поздовжнє дослідження в Камбоджі,
- Харчовий протокол для остеоартрозу (дегенеративні захворювання суглобів) Insight Medical Publishing