Харчові ресурси
Огляд хімії
Білки - це третя основна група макромолекул, що складають тіла організмів. Білки відіграють різноманітну роль у живих істотах. Мабуть, найважливішими білками є ферменти, білки, здатні прискорити конкретні хімічні реакції. Інші короткі білки, звані пептидами, використовуються як хімічні речовини у вашому мозку та у всьому тілі. Колаген, структурний білок, є важливою частиною кісток, хрящів і сухожиль. Незважаючи на різноманітні функції, усі білки мають однакову базову структуру: довгий ланцюг амінокислот, зчеплених кінцем.
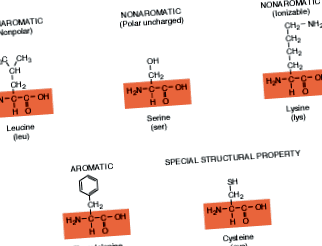
Амінокислоти - це невеликі молекули, що містять аміногрупу (- NH 2), карбоксильну групу (- COOH), атом водню, атом вуглецю та бічний ланцюг, який відрізняється між амінокислотами. У узагальненій формулі для
амінокислоти, бічний ланцюг позначений як R. Ідентичність та унікальні хімічні властивості кожної амінокислоти визначаються природою групи R.
Лише 20 різних амінокислот складають різноманітний масив білків, що містяться в живих істотах. Кожен білок відрізняється залежно від кількості, типу та розташування амінокислот, що складають його структуру. Зверніть увагу, що кожна з них має той самий хімічний кістяк (показаний рамкою), що і в узагальненій формулі. Групи R знаходяться поза межами цих ящиків. Ті амінокислоти з R-групами, що утворюють кільцеві структури, називаються ароматичними сполуками, а ті, що не мають кільцевих структур, неароматичними. (Цей термін був введений, коли хіміки виявили, що багато запашні сполуки мають таку відмітну кільцеву структуру.) Ті амінокислоти, які іонізуються, мають групи R, які заряджаються, коли знаходяться в розчині.
Рисунок 15 Як формується і розривається поліпептидний ланцюг. (а) Під час синтезу дегідратації між сусідніми амінокислотами утворюються пептидні зв’язки, утворюючи поліпептид. (b) Під час гідролізу до кожного пептидного зв’язку додається молекула води, яка зв’язує сусідні амінокислоти, порушуючи зв’язок між ними. Це розділяє молекули на окремі амінокислоти.
Рисунок 16 Первинна структура визначає форму білка завдяки зв’язуванню вздовж ланцюга.
Функціональні групи амінокислот у поліпептидному ланцюзі взаємодіють із сусідами, утворюючи водневі зв’язки. Крім того, частини білкового ланцюга з багатьма неполярними бічними ланцюгами, як правило, засовуються всередину білка через їх гідрофобні властивості. Через цю взаємодію поліпептидні ланцюги, як правило, спонтанно складаються в листи або загортаються в котушки. Цю складчасту або спіралеподібну форму називають вторинною структурою 2. Білки, що складаються здебільшого з листів, часто утворюють волокна, такі як кератинові волокна у волоссі, фібрин у згустках крові та шовк у павутинній мережі. Білки, які мають ділянки, що утворюють спіралі, часто складаються в кулясті форми, такі як глобінові субодиниці гемоглобіну в крові.
Водневий зв’язок може також спричинити білки з більш складною формою, ніж вторинна структура. Наступний рівень структури називається третинною структурою 3. Для білків, які складаються з субодиниць (окремих поліпептидних ланцюгів), спосіб, як ці субодиниці зібрані в єдине ціле, називається четвертинною структурою 4.
- Купон на харчування Omni - 122020
- БЕЗ ГМО БЕЗПЕКИ; Дивовижне харчування
- Чоловіки; s Сексуальне здоров'я Зв'язок між харчуванням, низьким рівнем тестостерону; Імпотенція
- Чоловіки; s Тиждень здоров’я - Харчування та зволоження - Здоров’я по всій долині
- Чоловіки; s Fitness Sports Nutrition Awards 2018