Гуарова камедь та подібні розчинні волокна в регуляції метаболізму холестерину: сучасні розуміння та майбутні пріоритети досліджень
Todd C Rideout
1 Центр функціональних продуктів харчування та нутрицевтиків Річардсона, Університет Манітоби, Вінніпег, Манітоба, Канада;
Скотт Гардінг
1 Центр функціональних продуктів харчування та нутрицевтиків Річардсона, Університет Манітоби, Вінніпег, Манітоба, Канада;
Пітер Дж. Джонс
1 Центр функціональних продуктів харчування та нутрицевтиків Річардсона, Університет Манітоби, Вінніпег, Манітоба, Канада;
Ming Z Fan
2 Центр моделювання харчування, Департамент тваринництва та птахівництва, Університет Гельфа, Гельф, Онтаріо, Канада
Анотація
Вступ
Коротка історія харчових волокон
У середині 1970-х років, коли суперечка навколо ролі холестерину в атеросклерозі досягла незрівнянних суперечок у медичному співтоваристві (Steinberg 2004, 2005), гіпотеза про харчові волокна виникла як нова парадигма харчування в охороні здоров'я людей та профілактиці захворювань. Хоча сучасне харчування з харчовими волокнами випливало із спостережних та епідеміологічних досліджень у 1970-х роках, гіпотеза про те, що споживання грубих продуктів рослинного походження може модулювати здоров’я людини, не була абсолютно новою концепцією. Ще в 430 р. До н. Е. Гіппократ зрозумів зв’язок між харчовими волокнами та „хворобами, які трапляються на людину”, і визнав, що „для людського організму велике значення має чи то хліб, чи тонкий, чи грубий; пшениці з корпусом або без нього ”(Адамс 1939). Дійсно, успіхи в аналізі (McCance et al. 1936) та енергетичної цінності (Atwater 1900) цих "неперетравлюваних вуглеводів" вже були досягнуті до 1930-х років. Однак протягом першої половини 20 століття опублікованих звітів про функціональність харчових волокон було небагато, і думка про те, що група неперетравних рослинних вуглеводів може полегшити профілактику захворювань, не отримувала особливої уваги з боку дієтологів.
У 1970-х рр. Кілька дослідників, зокрема Беркітт (1972), Троуелл (1972а), Пейнтер (1973) і Уокер (1974), припустили, що низька поширеність серцево-судинних захворювань у країнах, що розвиваються, в основному зумовлена споживанням дієти, багатої на клітковину . Після цих первинних спостережень кілька ранніх епідеміологічних досліджень підтвердили зворотну залежність між споживанням харчових волокон та частотою ішемічної хвороби серця (Morris et al 1977; Yano et al 1978; Kromhout et al 1982).
Одним з перших дослідників, який навів експериментальні докази на підтвердження захисної ролі харчових волокон проти ішемічної хвороби серця, був Девід Кричевський. Кричевський був зацікавлений тим, що годування насиченими жирами викликало атеросклероз у кроликів, яких годували напівочищеними дієтами, але не у кроликів, що годували чау. Кричевський висунув гіпотезу, що така розбіжність, ймовірно, зумовлена кардіопротекторними ефектами, пов'язаними з компонентами харчових волокон у комерційних дієтах чау (Кричевський, 1964). Результати подальших експериментів Кричевського підтвердили його початкову гіпотезу про кардіопротекторну дію харчових волокон (Кричевський та Теппер 1965, 1968).
Незважаючи на те, що гіпотеза з харчовими волокнами отримала визнання, необхідне було всебічне визначення харчових волокон, щоб ефективно вивчити епідеміологічні, фізіологічні та аналітичні аспекти цих неперетравлюваних харчових компонентів. Однак розробка всебічного визначення харчових волокон, яке задовольняло б окремі міркування дієтологів, харчових технологів та харчових хіміків, стало предметом великих дискусій. У 1972 р. Троуелл спочатку визначав харчові волокна як „скелетні залишки рослинних клітин, стійких до гідролізу ферментів людини” (Trowell 1972b). Це визначення обмежувалось компонентами клітинної стінки рослин, включаючи целюлозу, геміцелюлозу, лігнін та інші незначні компоненти, такі як віск та кутін. Згодом це визначення було змінено, включаючи полісахариди для зберігання рослин, такі як камеді та пектини, які мають подібні біологічні ефекти традиційних компонентів клітинної стінки, але не походять з інших структур, крім клітинної стінки (Trowell 1976).
З досягненнями аналітичних технологій та кращим розумінням фізіологічних наслідків харчових волокон, Американська асоціація хіміків зернових (2001) запропонувала наступне вичерпне визначення: „харчові волокна - це їстівні частини рослин або аналогічні вуглеводи, стійкі до травлення та всмоктування в тонкому кишечнику людини з повним або частковим бродінням у товстому кишечнику. Харчові волокна включають полісахариди, олігосахариди, лігнін та супутні рослинні речовини. Харчові волокна сприяють сприятливим фізіологічним ефектам, включаючи розслаблення та/або ослаблення холестерину в крові та/або ослаблення глюкози в крові. Ха та його колеги (2000) критикували визначення фізіологічних властивостей клітковини, які підкреслюють бродіння товстої кишки, не включаючи можливу взаємодію харчових волокон з іншими харчовими компонентами у верхніх відділах шлунково-кишкового тракту.
Зовсім недавно Спільна консультація експертів ФАО/ВООЗ з питань вуглеводів у харчуванні людини (Mann et al 2007) визнала, що переоцінка визначення клітковини є виправданою, і запропонувала визначити харчові волокна як „властиві полісахариди клітинної стінки рослин”.
Сучасне розуміння харчування клітковини
Класифікація харчових волокон
Багаторічні дослідження, що підтверджують гіполіпідемічні ефекти та кардіопротекторні переваги, пов’язані із споживанням клітковини, обґрунтовують рекомендації щодо збільшення споживання клітковини від органів охорони здоров’я у всьому світі (Heart and Stroke Foundation, Канада, 2003; Lichtenstein et al, 2006). Однак також очевидно, що фактичне споживання клітковини в Північній Америці набагато нижче, ніж рекомендовано в даний час (James et al 2003). Ця розбіжність може бути пов’язана з плутаниною, спричиненою широким спектром речовин, які класифікуються під парасолькою „харчових волокон”, та відсутністю знань щодо впливу різних клітковин на здоров’я людини (Shamliyan et al, 2006). Харчові волокна, як правило, класифікуються за різними фізико-хімічними та фізіологічними критеріями, включаючи розчинність, в'язкість та ферментацію (James et al 2003). Як правило, розчинні волокна, такі як гуарова камедь (GG), пектин та псиліум, є дуже в'язкими і легко ферментуються до коротколанцюгових жирних кислот (SCFA) у товстій кишці порівняно з нерозчинними волокнами, такими як целюлоза (James et al 2003) . Крім того, розчинні волокна викликають набагато більш виражену гіполіпідемічну та гіпоглікемічну реакцію, ніж їх нерозчинні аналоги (Fernandez 2001).
Змінна гіпохолестеринемічна реакція на споживання розчинної клітковини
Вживання водорозчинних в’язких волокон, таких як GG, пектин та псиліум, постійно демонструє зниження рівня холестерину в плазмі крові у людей (Brown et al 1999; Knopp et al 1999; Schneeman 1999; Butt et al 2007). Ступінь зниження рівня холестерину у відповідь на споживання клітковини змінюється залежно від ряду факторів, включаючи характер фонової дієти, тип харчових волокон, тривалість періоду адаптації та кількість споживаної клітковини. Крім того, вважається, що більша частина цієї мінливості змін ліпідів у плазмі крові, повідомлених у відповідь на споживання харчових волокон, має генетичну основу (Cara et al 1992).
Найбільші гіполіпідемічні ефекти у відповідь на споживання розчинної клітковини спостерігаються при дослідженнях на тваринних моделях, де експериментальні умови дозволяють споживання клітковини перевищувати те, що зазвичай спостерігається у людей. Фернандес та його колеги повідомляють про зниження загального холестерину в плазмі до 43% у морських свинок, які харчуються дієтою з високим рівнем холестерину (0,25%), доповненою 12,5% ГГ (Shen et al 1998). Цікаво, що знижуючий рівень холестерину ефект ГГ є більш вираженим при споживанні з високим вмістом холестерину дієти порівняно з дієтою без холестерину. У щурів, яких годували 7,5% ГГ, Moundras та його колеги (1997) повідомляли про загальне зниження рівня холестерину в плазмі крові на 14 та 32% при дієтах, що не містять холестерину або збагачені холестерином (0,3%). Подібним чином, морські свинки, яких годували дієтами, доповненими 12,5% ГГ, відповіли зниженням загального холестерину в плазмі на 22% на дієті з низьким вмістом холестерину (0,04%), але продемонстрували зниження загального холестерину в плазмі на дієті з високим вмістом холестерину (0,25 %) (Фернандес 1995).
Клінічні дослідження, як правило, повідомляють про зниження рівня ліпопротеїдів низької щільності (ЛПНЩ) у межах 6% -15% (Fernandez 2001). Після споживання 14 г/добу псилію у двадцяти хворих на цукровий діабет 2 типу протягом 6 тижнів, Сьєрра та його колеги (2002) спостерігали зниження загального та ЛПНЩ-холестерину на 7% та 9% відповідно. Крім того, у 24 здорових добровольців, які отримували 9 г ГГ на день протягом 4 тижнів, спостерігалося значне зниження (25%) рівня холестерину ЛПНЩ (Khan et al. 1981). Альтернативно, мета-аналіз 67 контрольованих досліджень Брауна та його колег (1999) припустив, що споживання 2–10 г основних харчових волокон, таких як пектин, вівсяні висівки, гуарова смола та псиліум, призвело до невеликих, але значних скорочень загальної кількості та вмісту ЛПНЩ. холестерин. Нарешті, також було показано, що концентрація ліпідів у циркуляції після їжі сприятливо змінюється після споживання харчових волокон. Споживання їжі з високим вмістом клітковини з 15,7 г бета-глюкану знижує концентрацію холестерину після їжі нижче рівня голодування у 11 здорових чоловіків порівняно з їжею з низьким вмістом клітковини з 5,0 г бета-глюкану (Bourdon et al 1999).
Механізми зниження холестерину розчинних волокон
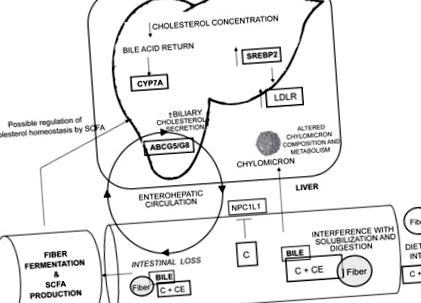
Скорочення: ABCG5/G8, ATP-зв'язуючий касетний транспортер G5 і G8; С, холестерин; CE, ефір холестерилу; CYP7A, холестерин 7a-гідроксилаза; GG, гуарова камедь; LDLr, рецептор ліпопротеїдів низької щільності; NPC1L1, Niemann-Pick-C-1 like 1; SCFA, коротколанцюгові жирні кислоти; SREBP2, регулюючий елемент стеролу елемент, що зв’язує білок 2.
Вважається, що гіпохолестеринемічні ефекти розчинних волокон також є результатом втручання в ентерогепатичну циркуляцію жовчних кислот (Fernandez 2001). Марлетт та його колеги (1994) дійшли висновку, що споживання вівсяних висівок у молодих чоловіків із нормоліпідемією знижує рівень холестерину в сироватці крові, змінюючи склад ентерогепатичного пулу жовчних кислот та збільшуючи фекальні втрати загальних жовчних кислот. Ці спостереження були надалі продемонстровані в клінічних дослідженнях на людях Лією та колегами (1995), Андерссоном та його колегами (2002) та Еллегардом та Андерссоном (2007). Харчові добавки псилію на рівні 10% асоціюються із дозозалежним збільшенням виведення фекальних жовчних кислот у щурів (Buhman et al, 2000). Так само було показано, що нативний крохмаль, стійкий до аміло-кукурудзи, модифікований крохмаль із подібними фізіологічними ефектами до розчинних волокон, збільшує фекальну екскрецію первинних жовчних кислот у людей (van Munster et al, 1994). Цікаво, що, хоча традиційно вважалося, що GG зменшує споживання кишкових жовчних кислот, низка звітів наприкінці 1990-х рр. Припускають, що потік кишкової жовчної кислоти в печінку насправді може бути збільшений у відповідь на споживання GG (Favier et al 1998; Moundras et al 1997; Moriceau et al 2000). Тому традиційні механізми, за допомогою яких ГГ знижує концентрацію холестерину в плазмі крові, можливо, доведеться переглянути заново.
Вважається, що зменшення всмоктування холестерину в кишечнику та поглинання жовчної кислоти у відповідь на споживання розчинної клітковини змінює гомеостаз печінки, ефективно знижуючи концентрацію холестерину в печінці за допомогою двох пов’язаних механізмів. По-перше, зменшення доставки харчового холестерину до печінки через залишки хіломікрону призводить до прямого зменшення печінкового пулу холестерину (Fernandez 2001). Доведено, що дієтичні добавки ГГ у кількості 12,5% знижують рівень вільного в печінці та етерифікованого холестерину на 21% та 16% відповідно у морських свинок (Fernandez 1995). По-друге, збільшення фекальних втрат жовчних кислот і зменшення розміру ентерогепатичного пулу жовчних кислот може стимулювати печінку виробляти більше жовчних кислот із холестерину, зменшуючи таким чином концентрацію вільного холестерину в печінці (van Bennekum et al, 2005).
Підвищена потреба печінки в холестерині внаслідок зниженого клітковиною пулу вільного холестерину в мікросомах печінки може бути задоволена збільшенням поглинання ліпопротеїдів холестерином із плазми, вивільненням вільного холестерину з внутрішньоклітинного зберігання холестерилового ефіру та мембранного холестерину або збільшенням синтез холестерину в печінці (Fernandez 2001; Rideout et al 2007). Було показано, що споживання різних типів розчинних волокон збільшує часткову катаболічну швидкість ЛПНЩ (Вергара-Хіменес та ін., 1998) та експресію ЛПНЩ у печінці (Фернандес, 1995; Фукісіма та ін, 2001; Хан та ін, 2004).
Вважається, що компенсаторне збільшення експресії печінкової HMG-CoA-редуктази, обмежуючого швидкість ферменту в біосинтезі холестерину, пояснює зменшення рівня печінкового вільного холестерину після споживання GG (Favier et al 1998), виготовленого розчинної клітковини з деревної тріски (Chai et al 2003), псилію (Buhman et al 2000) та пектину (Garcia-Diez et al 1996). Існує припущення, що GG викликає гіпохолестеринемічний ефект навіть в умовах збільшення синтезу печінкового холестерину, оскільки збільшення активності HMG-CoAr недостатньо для компенсації втрати фекальних стероїдів у щурів, які отримують дієту, доповнену 7,5% GG ( Мундрас та ін., 1997).
Вважається, що зниження концентрації вільного холестерину в печінці після споживання розчинної клітковини призводить до модифікації метаболізму печінкових ліпопротеїдів. Споживання розчинної клітковини було пов’язане зі зменшенням секреції печінкового аполіпопротеїну В та утворенням великих частинок, багатих тригліцеридами, виснажених холестериловим ефіром дуже ЛПНЩ (ФДНЩ) (Fernandez 2001). Ця зміна ендогенного шляху холестерину призводить до частки ЛПНЩ, яка менш схильна до перетворення ЛПНЩ і ЛПНЩ через позапечінкові ліпази та частки ЛПНЩ з високою піковою щільністю (Roy et al 2000; Fernandez 2001).
Пріоритети досліджень в обміні клітковини та харчових продуктів
Індивідуальні фізіологічні реакції на харчові волокна
Майбутнє функціональних продуктів харчування в модулюванні здоров’я людини тісно пов’язане з концепцією „персоналізованого харчування” (Vakili and Caudill 2007). Можливість спеціально адаптувати дієтичне лікування на основі індивідуальних генетичних поліморфізмів посилить важливість дієти у профілактиці захворювань та потенційно зробить революцію у світовій системі охорони здоров’я. Хоча дієтичні фактори є ефективними модуляторами клітинного метаболізму на молекулярному рівні, стає все більш очевидним, що існує значна мінливість у відповіді ліпідів плазми на різні харчові гіполіпідемічні засоби, включаючи рослинні стерини (Jones et al 1999) та харчові волокна ( Кара та ін., 1992). Ця мінлива індивідуальна реакція частково зумовлена варіаціями одноосновної бази в послідовностях генів, які функціонують як молекулярні мішені дієтичних біоактивних компонентів (Трухільо та ін., 2006). Хоча вплив генетичних поліморфізмів на профіль ліпопротеїнів у відповідь на рослинні стерини (Plat і Mensink 2002), холестерин в їжі (Robitaille et al 2007) та ізофлавони сої (Hall et al 2006) широко вивчався, роль генотипу в визначення гіпохолестеринемічних ефектів харчових волокон було предметом нечисленних досліджень.
Як видно з вищезазначеного обговорення, опублікованих звітів про роль поліморфізму генів у реакції зниження рівня холестерину на розчинні волокна небагато, і часто вони обмежені невеликим обсягом вибірки. Гіпохолестеринемічні ефекти харчових волокон ініціюються первинними кишковими явищами, пов’язаними з перетравленням і всмоктуванням харчового жиру та холестерину (Lairon 1996). Отже, дослідження розумного зв’язку між поліморфізмами в генах, що регулюють кишковий тригліцерид та перетравлення холестерину, та результати ліпопротеїдів у плазмі крові у відповідь на споживання розчинної клітковини можуть бути розумними. Дійсно, тригліцерид-ліпаза підшлункової залози та ліпаза ефіру карбоксильного ефіру, два ферменти, що беруть участь у перетравленні тригліцеридів кишечника та холестерину, виявились високополіморфними, і тому можуть пояснити деякі мінливості, пов’язані з споживанням харчових волокон (Lidberge et al 1992; Cao та Hegele 2003 ).
«Омічний» підхід до досліджень харчових волокон
Регуляція експресії генів та білка в ентерогепатичній петлі
Скорочення: ABCG5, ATP-зв'язуючий касетний транспортер G5; ABCG8, ATP-зв’язуючий касетний транспортер G5; ACAT, ацил-кофермент А: холестерин ацилтрансфераза; ASBT, апікальний натрієзалежний транспортер жовчних кислот; С, холестерин; CE, ефір холестерилу; CEL, ліпаза ефіру карбоксилу; CYP7A, холестерин 7α-гідроксилаза; ЛПВЩ, ліпопротеїни високої щільності; ABCA1, ATP-зв'язуючий касетний транспортер A1; HMG-CoAr, 3-гідрокси-3-метилглутарил-КоА-редуктаза; LDLr, рецептор ліпопротеїдів низької щільності; NPC1L1, Niemann-Pick-C-1 like 1; SR-B1, рецептор поглинача класу B, тип 1; ЛПНЩ, ліпопротеїни дуже низької щільності.
По-друге, у відповідь на споживання GG ми спостерігали збільшення рівня печінкової мРНК ABCG5/G8 та експресії білка та концентрації біліарного холестерину порівняно із свинями, що годувались контролем (Rideout 2007; Rideout and Fan 2008). Традиційно, втручаючись в ентерогепатичну циркуляцію та кишкове засвоєння жовчних кислот, споживається розчинна клітковина модулює виведення холестерину в цілому через стимулювання катаболізму холестерину до жовчних кислот (Trautwein et al 1998). Однак додатковий важливий у кількісному відношенні шлях виведення холестерину відбувається через жовчну секрецію та можливу фекальну втрату вільного холестерину (Spritz et al, 1965). Наші останні дані дозволяють припустити, що стимуляція секреції вільного холестерину в жовчі через печінковий ABCG5/G8 може існувати як новий механізм, за допомогою якого споживання GG стимулює втрату холестерину в усьому тілі та ефективно знижує концентрацію холестерину в плазмі крові (Rideout 2007; Rideout and Fan 2008).
Як цільові традиційні молекулярні підходи, так і нові високопродуктивні технології можуть бути використані для отримання більш повного розуміння того, як споживання харчових розчинних клітковин регулює структури експресії генів та білків. На відміну від інших дієтичних біоактивних компонентів, які, як вважається, безпосередньо регулюють транскрипцію печінкових генів, що реагують на холестерин (Mezei et al 2003), компоненти харчових волокон не всмоктуються із шлунково-кишкового тракту, а тому, як вважають, впливають на гомеостаз печінкового холестерину за допомогою вторинних сигнальних систем та метаболіти (Fernandez 1995). Тому для повного розмежування молекулярних подій, за допомогою яких споживання розчинної клітковини модулює периферичний метаболізм холестерину, буде критично важливо визначити молекулярні сигнали, які беруть участь у опосередкуванні цих вторинних ефектів.
Висновки
Виноски
Розкриття інформації
Автори повідомляють про відсутність конфлікту інтересів у цій роботі.
- Вплив голодування та фізичних вправ на чергування на метаболізм холестерину у людей із зайвою вагою та ожирінням
- Вплив дієти з обмеженням калорій для схуднення на обмін триптофану та запалення
- Розчарований моїм метаболізмом - Що одна жінка зробила з цим - Almased®
- Тести на польову ходьбу дають такі ж серцево-легеневі потреби, як і додатковий тест на біговій доріжці в Україні
- Метаболізм FFA при різних типах ожиріння людини - Повний текст