Гіпотеза: уніфікуючий механізм харчування та хімічних речовин як довічні модулятори гіпометилювання ДНК
Дак-Хі Лі
1 Департамент превентивної медицини та дослідницького центру зміцнення здоров'я, Медичний факультет, Національний університет Кюнгпук, Тегу, Корея
Девід Р. Джейкобс, молодший.
2 Відділ епідеміології, Школа громадського здоров'я, Університет Міннесоти, Міннеаполіс, Міннесота, США
3 Департамент харчування, Університет Осло, Осло, Норвегія
Мікель Порта
4 Інститут муніципальних досліджень медицини та Медичний факультет, Барселонський університет, Барселона, Іспанія
Анотація
Передумови
Хоча як харчування, так і хімічні речовини є важливими факторами навколишнього середовища, що модулюють епігенетичні зміни, вони зазвичай вивчаються окремо дослідниками в різних областях. Однак ці два фактори навколишнього середовища неможливо відокремити один від одного в реальному світі, оскільки ряд хімічних речовин забруднює харчові ланцюги.
Об’єктивна
Ми пропонуємо об'єднуючий механізм, який може пов'язати епігенетичні зміни щодо гіпометилювання ДНК внаслідок хімічних речовин та дефіциту або дисбалансу поживних речовин, підкреслюючи важливість інтегративного підходу в галузі екологічної епідеміології.
Обговорення
Метильні групи з S-аденозилметионіну (SAM) необхідні для метилювання ДНК. Дієта з низьким вмістом метильних груп може призвести до глобального гіпометилювання ДНК, погіршуючи синтез SAM. Однак навіть без харчової недостатності посилена потреба в синтезі глутатіону (GSH) може погіршити синтез SAM та порушити метилювання ДНК, оскільки цикл метилювання та шляхи синтезу GSH біохімічно пов'язані. Вплив хімічних речовин навколишнього середовища є загальною ситуацією, коли потреба в синтезі GSH посилюється, оскільки GSH споживається для сполучення різноманітних хімічних речовин. Враховуючи, що кон'югація GSH відбувається при будь-якій хімічній дозі, ця гіпотеза актуальна навіть при впливах нижче високих доз, що викликають токсикологічні реакції.
Висновок
В даний час населення в цілому піддається великій кількості хімічних речовин, кожна з яких має дуже низькі дози. Таким чином, гіпометилювання ДНК внаслідок хімічного впливу може бути поширеним у сучасному суспільстві і може синергетично взаємодіяти з гіпометилюванням ДНК, спричиненим харчуванням.
Епігенетика - це дослідження мейотично та мітотично індукованих спадкових змін у експресії генів за допомогою метилювання ДНК, модифікацій гістонів або зміни мікроРНК без фактичної модифікації послідовності геномної ДНК (Feinberg 2007; Ozanne and Constancia 2007). Оскільки на експресію генів впливають різні фактори навколишнього середовища, епігенетика може служити інтерфейсом між успадкованим статичним геномом та динамічним середовищем (Feinberg 2007; Ozanne and Constancia 2007), створюючи величезні виклики екологічній епідеміології (Porta 2008).
Тоді як епігенетична дисрегуляція все частіше причетна до раку, роль епігенетики в інших складних хронічних захворюваннях, таких як серцево-судинні захворювання, діабет 2 типу та ожиріння, залишається в основному нехарактерною. До цього часу дослідницькі зусилля щодо причин епігенетичних змін були зосереджені на харчуванні під час вагітності як основному впливі епігенетичних закономірностей у дитинстві та дорослому віці (Mathers 2007). Зокрема, застосовуючи теорію фетального походження захворювань дорослих, передбачається низька вага при народженні через недостатнє харчування, що частково пояснює поточні епідемії метаболічного синдрому та діабету 2 типу - наприклад, у країнах, що розвиваються, таких як Індія чи Китай (Yajnik 2004). Недавно було виявлено, що попередній вплив голоду під час Голландської зими голоду 1944–1945 років пов’язаний з гіпометилюванням інсуліноподібного фактора росту 2 (IGF2) через шість десятиліть (Heijmans et al. 2008). Оскільки IGF2 відіграє ключову роль у зростанні ссавців, впливаючи на поділ та диференціацію клітин і, можливо, метаболічну регуляцію (O'Dell and Day 1998), дослідження забезпечило емпіричну підтримку гіпотези про те, що недоїдання під час вагітності збільшує ризик захворювань у дорослих через епігенетичну модуляцію експресії генів (Gluckman et al. 2008).
З іншого боку, також з’являються докази того, що різні загальноприйняті хімічні агенти навколишнього середовища, включаючи деякі ендокринні руйнівники, можуть впливати на нормальні епігенетичні процеси розвитку і, отже, сприяти збільшенню ризику хронічних захворювань у дорослих (Edwards and Myers 2007). На жаль, епігенетичні зміни, зумовлені цими двома важливими типами факторів навколишнього середовища - харчуванням та хімічними речовинами, як правило, вивчаються окремо дослідниками в різних областях.
Оскільки численні хімічні агенти забруднюють харчові ланцюги, однак у реальному світі ці два фактори навколишнього середовища не можна відокремити один від одного. Крім того, ці фактори можуть синергетично спричинити епігенетичні зміни через загальний шлях, як ми гіпотезуємо нижче. Екологічна епідеміологія - це унікальна дослідна область, яка спостерігає за вільно проживаючими популяціями людей і намагається як розплутати, так і інтегрувати складні етіопатогенні процеси, що включають дуже різноманітні фактори ризику. Отже, критичним для наукового прогресу є глибше розуміння того, як можуть бути пов'язані між собою харчування та синтетичні хімікати.
Гіпометилювання ДНК за допомогою об’єднуючого механізму
Глобальне гіпометилювання геному в значній мірі впливає на міжгенні та інтронні ділянки ДНК, особливо на повторювані послідовності та транспонсовані елементи, і, як вважають, це призводить до хромосомної нестабільності та посилення мутаційних подій (Wilson et al. 2007). Незалежно від типу тканини, рак людини має спільне як глобальне геномне гіпометилювання, так і фокальне гіпо- та гіперметилювання острівців CpG (Franco et al. 2007). Крім того, глобальне гіпометилювання також пов'язане з іншими захворюваннями, такими як атеросклероз (Zaina et al. 2005). Тут ми пропонуємо об’єднуючий механізм, який може пов’язати епігенетичні зміни щодо глобального або фокусного гіпометилювання ДНК внаслідок дії хімічних речовин та дефіциту або дисбалансу поживних речовин, що мало розглядалося серед епідеміологів та інших дослідників. Ми не думаємо, що наш гіпотетичний механізм може пояснити всі епігенетичні механізми, включаючи фокальне гіперметилювання ДНК у конкретних генах, хоча хімічний вплив та дефіцит або дисбаланс харчування, ймовірно, призводять до інших епігенетичних змін через невідомі механізми.
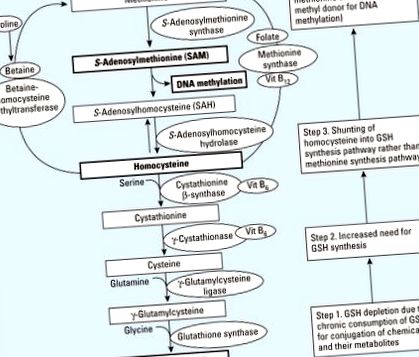
SAM (S-аденозилметионін) є критичним донором метилу для більшості метилтрансфераз, які модифікують ДНК, РНК, гістони та інші білки (Loenen 2006). Фолієва кислота, метіонін, бетаїн, холін та вітамін В12 беруть участь в метаболізмі з одним вуглецем, що включає субстратоване метилювання SAM (Mason 2003). Таким чином, дієти, у яких бракує субстратів або кофакторів в метаболізмі з одним вуглецем, можуть сприяти гіпометилюванню ДНК, погіршуючи синтез SAM (Davis and Uthus 2004; Selhub 2002). Цей цикл метилювання (Рисунок 1, вгорі) дуже відомий і часто цитується для пояснення зв'язку між дієтою та епігенетичними змінами. Однак навіть без аліментарного дефіциту метильних груп може статися порушення синтезу SAM та збуреного метилювання ДНК, коли зростає потреба в синтезі глутатіону (GSH) (рис. 1, внизу).
Гіпотетичний об'єднуючий механізм, що пов'язує гіпометилювання ДНК внаслідок дефіциту хімічних речовин та поживних речовин. Віт, вітамін. Структура метилювання ДНК може бути порушена через виснаження GSH, коли він хронічно споживається для кон'югації хімічних речовин та їх метаболітів. За звичайних обставин метаболізм гомоцистеїну сприяє як шляху синтезу метіоніну, так і GSH. У присутності хімічних речовин, таких як стійкі органічні забруднювачі, які руйнують GSH, внесок у шлях метіоніну може зменшитися через більшу потребу в синтезі GSH (нумеровані поля справа).
Вплив хімічних сполук може бути типовою ситуацією, коли люди потребують більше GSH (Jones et al. 1995). Трансферази GSH та GSH еволюціонували як головний хімічний захист від реактивних ксенобіотиків та реакційноздатних сполук, що утворюються під час метаболізму ендогенних та екзогенних сполук (Ketterer et al. 1983). Трансферази GSH мають широкі та перекриваються специфіки субстрату, що дозволяє їм брати участь у детоксикації хімічно різноманітної групи сполук. Найбільш поширені реакції включають нуклеофільну атаку GSH на електрофіли, як правило, епоксиди ароматичних та аліфатичних органічних сполук (Coles and Ketterer 1990). Ці субстрати мають спільну ступінь гідрофобності і мають електрофільні центри (Coles and Ketterer 1990).
Експериментальні дослідження показали, що вплив хімічних речовин підвищує вміст GSH за рахунок посилення засвоєння амінокислотних субстратів та активності біосинтетичних ферментів (Franco et al. 2007; Shi et al. 1994) як адаптивного механізму проти короткочасного впливу хімічних речовин. Підвищена потреба в GSH зменшує доступність гомоцистеїну, який стоїть на перехресті між циклом метилювання та шляхом транссульфурації, для використання в циклі метилювання. Зрештою, шляхом шунтування гомоцистеїну на шлях синтезу GSH, рівні метіоніну та SAM зменшуватимуться (рис. 1).
Якщо вплив хімічних речовин є тимчасовим, всі ці порушення можуть швидко нормалізуватися без прогресування до рівнів виснаження GSH. Однак при тривалому впливі хімічних речовин це може врешті-решт прогресувати до виснаження внутрішньоклітинного GSH через споживання GSH шляхом кон'югації (Franco та співавт. 2007). Багато польових досліджень водних організмів, що мешкають у забруднених районах, повідомили про зниження вмісту GSH порівняно із вмістом незабруднених територій (Cossu et al. 1997; Otto and Moon 1996). На відміну від експериментів in vitro або тварин, в яких схеми впливу хімічних речовин не є подібними до вільноживучих людей за тривалістю впливу чи кількістю хімічних речовин, натуралістичні польові дослідження можуть надати інформацію, що стосується фізіологічної реакції на фоновий вплив змішаних ксенобіотичних речовин.
Існують прямі експериментальні докази того, що виснаження GSH знижує рівень SAM у клітинах і призводить до гіпометилювання ДНК у цілому за геном (Lertratanangkoon et al. 1997). В експериментальних дослідженнях виснаження GSH зазвичай індукується прямим пригніченням ферментів синтезу GSH або в моделях з нокаутом (Akai et al. 2007; Wu and Cederbaum 2004). Однак у загальних популяціях, що проживають у забруднених хімікатами суспільствах, більш загальним механізмом виснаження GSH може бути споживання GSH через кон'югацію з хімічними речовинами або їх метаболітами.
Як тільки відбувається виснаження GSH, може початися порочний цикл. Як вирішальна молекула в антиоксидантному захисті клітини, виснаження внутрішньоклітинного GSH викликає каскад подій, що тягне за собою окислювальний стрес, включаючи вироблення активних форм кисню/азоту (Higuchi 2004). Окислювальний стрес може безпосередньо пригнічувати цикл метилювання, обмежуючи активність фолат-залежної метіонінсин-тази та кобаламіну (Deth et al. 2008). Крім того, GSH надалі споживається для кон'югації активних форм кисню/азоту, що утворюються через окислювальний стрес, що призводить до посиленого виснаження GSH.
Фоновий вплив сумішей хімічних речовин
Важливо те, що теоретична обгрунтованість нашої гіпотези не вимагає індивідуального впливу високих доз хімічного речовини, яке зазвичай потрібно, щоб викликати класичну токсикологічну реакцію. Насправді, у багатьох країнах світу групи в цілому населення зазнають дуже низьких доз кожної хімічної речовини, часто нижчих за межі, які в даний час вважаються безпечними (Paustenbach and Galbraith 2006; Porta et al. 2008). Однак кон'югація GSH може відбуватися у будь-якій дозі, оскільки це фізіологічна реакція на виділення "чужорідних тіл". Для людини, яка зазнає впливу однієї хімічної речовини в низькій концентрації, споживання GSH є тривіальним. Однак, якщо тривалий час впливає велика кількість хімічних речовин, використання GSH є важливим, і виснаження може статися через кон’югацію GSH.
У наших сучасних суспільствах сотні хімічних речовин виявляються у значних підгрупах населення, причому концентрації сполук мають високу кореляцію (Paustenbach and Galbraith 2006). Більшість таких впливів відбувається під час звичайного повсякденного життя, що передбачає хронічний вплив протягом усього життя. Таким чином, зміни в моделях метилювання через фоновий вплив сумішей хімічних речовин є вірогідними. Вони можуть бути більш серйозними, коли співіснують дефіцит харчування або дисбаланс, пов’язані з циклом метилювання.
Іншим важливим фактором є те, що глобальне гіпометилювання ДНК накопичується поступово під час старіння (Fraga et al. 2007). В даний час незрозуміло, чому старіння пов’язане з глобальним гіпометилюванням ДНК. Однак виснаження GSH може бути пов'язане з цією асоціацією, оскільки рівні GSH знижуються в ряді тканин під час старіння через порушення каталітичної ефективності глутамат-цистеїнової лігази, обмежуючого швидкість ферменту в синтезі GSH (Liu et al. 2004). Одночасно з цим порушенням каталітичної ефективності навантаження на організм хімічних речовин з тривалим періодом напіврозпаду має тенденцію до збільшення зі старінням. Більше того, дефіцит вітаміну В12 і фолієвої кислоти характерний для людей похилого віку (Koehler et al. 1997). Таким чином, хімічний вплив, живлення та старіння можуть взаємодіяти між собою синергетично, що, нарешті, призводить до глобального гіпометилювання.
Індуковані хімічними речовинами епігенетичні зміни можуть успадковуватися між поколіннями (Anway et al. 2005, 2006), підвищуючи ймовірність того, що деяка сімейна агрегація хронічних захворювань може бути частково пов'язана з хімічним впливом у попередніх поколіннях. Якщо їх підтвердять у найближчі кілька років, такі докази стануть відповідним прикладом наукового виклику та виклику громадському здоров’ю, до якого може сприяти екологічна епідеміологія, даючи змогу проводити дослідження, які ефективно включають міркування, методи та докази життєвого шляху, екологічного, молекулярного та епігенетичного епідеміологія (Porta 2008).
Стійкі органічні забруднювачі та епігенетичні зміни
Серед хімічних речовин, передбачувано важливих для епігеноміки навколишнього середовища, стійкі органічні забруднювачі (СОЗ) викликають особливе занепокоєння, оскільки вони біоакумулюються в жировій тканині протягом усього життя (Abelsohn et al. 2002). Люди, як правило, піддаються дії різноманітних сумішей СОЗ, починаючи з внутрішньоутробного періоду, головним чином тому, що ці хімічні речовини біоакумулюються в харчових ланцюгах і переносяться з дієтичного споживання матері через плаценту (Abelsohn et al. 2002).
Ще одна важлива особливість СОЗ також може призвести до виснаження GSH. Ліпофільні ксенобіотики, такі як СОЗ, секретуються в жовч з печінки і реабсорбуються з просвіту кишки в кровообіг і назад у печінку, переживаючи таким чином ентеропечінкову циркуляцію (Jandacek and Tso 2001). Ця особливість СОЗ є однією з основних причин тривалого періоду напіввиведення СОЗ в організмі людини (Jandacek and Tso 2001). СОЗ виділяються в жовч, кон’юговану з такими молекулами, як GSH (Bakke et al. 1990). Таким чином, безперервна переробка СОЗ через ентерогепатичну циркуляцію може призвести до хронічного виснаження GSH печінки. Окрім того, оскільки існує сильна кореляція між концентрацією СОЗ у сироватці крові та віком у загальній популяції (Lee et al. 2006), СОЗ наводять приклади хімічних речовин, які можуть синергетично збільшити ризик глобального гіпометилювання із старінням.
Глобальне гіпометилювання ДНК нещодавно було пов’язане з високими концентраціями СОЗ у сироватці крові у, здавалося б, здорових гренландських інуїтів (Rusiecki et al. 2008). Ступінь метилювання ДНК знижувалась із збільшенням концентрацій p, p′-DDT (дихлордіфенілтрихлоретан), p, p′-DDE (дихлордіфенілдіхлоретилен), β-гексахлорциклогексан, оксихлордан, α-хлордан, полімеран біреп, мірекс конгенерів та суми всіх досліджених СОЗ. Незважаючи на те, що їх концентрації СОЗ були набагато вищими, ніж у інших загальних популяціях, глобальний механізм гіпометилювання ДНК може брати участь у асоціаціях між фоновим впливом СОЗ та різними хронічними захворюваннями, включаючи діабет 2 типу, метаболічний синдром та ішемічну хворобу серця (Ha та ін. 2007; Лі та ін., 2006, 2007).
Варто зазначити, що деякі хлорорганічні (OC) пестициди та поліхлоровані біфеніли (ПХБ) все ще використовуються в країнах, що розвиваються, таких як Індія чи Китай, і що вони зберігаються у постачанні їжі всіх країн. Крім того, велика кількість комунальних відходів викидається щодня на відкриті сміттєзвалища у передмістях великих міст без належного управління. Нещодавнє дослідження повідомило, що навколишнє середовище демонструє надзвичайно високий рівень СОЗ порівняно з таким у контрольних місцях (Minh et al. 2006). Насправді, внутрішньоутробний вплив різних хімічних забруднень, таких як діоксини, ПХБ або пестициди ОК, може спричинити несприятливі наслідки вагітності, такі як низька вага при народженні, передчасні пологи або затримка внутрішньоутробного розвитку (Wigle et al. 2008; Windham and Fenster 2008), які зазвичай відносять до недоїдання та майбутнього високого ризику метаболічного синдрому та діабету 2 типу в країнах, що розвиваються (Yajnik 2004). Епігенетичні зміни, спричинені СОЗ, можуть відігравати певну роль у сучасних епідеміях метаболічного синдрому та діабету 2 типу в країнах, що розвиваються, поряд із західним життям. Однак наша гіпотеза може бути релевантною для будь-якої популяції з фоновим впливом різних хімічних речовин, кон'югованих з GSH.
Висновки
В даний час існує мало інтегративних досліджень на людях, які розглядають як хімічні речовини, так і харчування. Тому для вивчення впливу хімічного впливу на гіпометилювання ДНК з урахуванням дієтичних факторів будуть потрібні майбутні дослідження на людях.
Особливо в часи загальнодоступної дієти, дослідження епігенетичних змін можуть пропустити фактор, що має велике значення, якщо вони не враховують хімічні агенти. Оскільки епігенетичні зміни оборотні, розробка препаратів, які контролюють епігенетичну регуляцію, зараз залучає значні інвестиції у дослідження, включаючи розробку функціональних продуктів харчування або добавок. Однак, оскільки довічне вплив деяких хімічних речовин, ймовірно, відіграватиме важливу роль у епігенетичних змінах етіопатогенного значення для деяких захворювань дорослих, було б також розумним та ефективним посилити державну та приватну політику, що зменшують вплив таких хімічних речовин.
Виноски
Це дослідження було підтримане грантом від Корейського проекту досліджень та розробок технологій охорони здоров’я Міністерства охорони здоров’я, соціального забезпечення та сім’ї, Республіка Корея (A084046).
- Це; s не калорії, це; s хімічні речовини; Клініка харчування
- Закладаючи міцну основу для вашої стратегії Ironman Nutrition
- Вступ до харчування
- Принцип інтуїтивного харчування №2 Шануй свій голод - Харчуюся добре
- Інтуїтивно зрозумілі принципи харчування, щоб почуватись та виконувати психологію сьогодні