Гіполіпідемічний ефект Fragarianilgerrensis Шлехт. лікарська сполука на гіперліпідемічних щурах
Анотація
Передумови
Fragarianilgerrensis Шлехт. лікарська сполука (FN-MC) - це різновид сполуки китайських трав, до складу якої входять Fragarianilgerrensis Шлехт. і Centella asiatica (L.) Міський. Дослідження мало дослідити ефект гіполіпідемії FN-MC на гіполіпідемічній моделі щурів.
Методи
Самців щурів SD випадковим чином розподіляли на п'ять груп: група з нормальним жиром (NFD), група з високим вмістом жиру (HFD), група FN-MC (2 г/кг), група FN-MC (4 г/кг) і група симвастатину (PDC). Після лікування FN-MC вимірювали масу тіла, споживання їжі, біохімічні показники сироватки та печінки щурів, а патологічні зміни печінки та її клітин спостерігали за допомогою оптичного мікроскопа та просвічувальної електронної мікроскопії.
Результати
Результати показали, що FN-MC суттєво знижував рівень тригліцеридів у сироватці крові (TG), загального холестерину (TC), ліпопротеїдів низької щільності (LDL-C), аполіпопротеїнів B (ApoB) та печінкового малоандіальдегіду (MDA), одночасно підвищуючи високий рівень сироватки крові -ліпопротеїди щільності (HDL-C), аполіпопротеїн А1 (ApoA1) та печінкова супероксиддисмутаза (SOD). FN-MC також покращував структуру печінки та значно зменшував краплі ліпідів у цитоплазмі. Крім того, FN-MC суттєво зменшував набір ваги і не мав значного впливу на споживання їжі.
Висновки
Дослідження показало, що FN-MC виявляв сильну здатність покращувати дисліпідемію та запобігати відкладенням жиру в печінці у щурів, які отримували дієту з високим вмістом жиру. Тим часом FN-MC виявляв проти ожиріння та антиоксидантні властивості.
Основні моменти
Fragarianilgerrensis Schlecht. лікарська сполука має гіполіпідемічну дію на гіперліпідемічну модель щурів
Fragarianilgerrensis Schlecht. введення лікарської сполуки покращує антиоксидантну здатність щурів
Fragarianilgerrensis Schlecht. лікарська сполука запобігає печінковому відкладенню жиру
Передумови
Гіперліпідемія є різновидом захворювання метаболічного розладу, яке включає аномально високий рівень ліпідів та ліпопротеїдів у крові. Це основна причина атеросклерозу, мозкового інсульту, ішемічної хвороби серця, інфаркту міокарда та ниркової недостатності у китайців [1,2,3].
В даний час основним методом лікування гіперліпідемії є фізичні вправи, відмова від куріння, дієтотерапія та прийом ліків. Статини, нікотинова кислота та секвестранти жовчних кислот є найбільш часто використовуваними ліками, які можуть зменшити вміст ліпідів та ліпопротеїдів у крові. Було показано, що ці препарати корисні для пацієнтів з профілактикою багатьох видів серцево-судинних захворювань [4]. Хоча вони ефективні в модулюванні гіперліпідемії як в доклінічних, так і в клінічних дослідженнях, їх токсичність для печінки та нирок не можна ігнорувати, тому багато дослідників працюють над пошуком більш ефективних препаратів для лікування [5,6,7]. В останні роки китайська медицина приділяла велику увагу багатьох вчених своїм стабілізуючим ефектом і кількома побічними ефектами [6, 7].
Fragarianilgerrensis Шлехт. - це рослина, яка належить до рожевих грибів, Fragaria. Він росте на луках гірських схилів або лісах на березі річки на висоті 700-3000 м, і в основному розповсюджується в провінції Юньнань, провінція Гуансі, Китай. Fragarianilgerrensis Шлехт. має ідеальний ефект очищення від тепла та детоксикації, і він може активізувати кровообіг, щоб розсіяти застій крові. Люди в провінції Юньнань, Китай, зазвичай роблять із них суміш Centella asiatica (L.) Urban [8, 9] і використовують суміш як народний засіб для лікування серцево-судинних захворювань.
У нашому експерименті ми годували щурів дієтою з високим вмістом жиру, щоб встановити гіперліпідемічну модель щурів. Потім ми розділили щурів на групу NFD, групу HFD, групу FN-MC (2 г/кг), групу FN-MC (4 г/кг) та групу PDC. Після медикаментозного лікування вимірювали загальний холестерин (ТС), тригліцериди (ТГ), ліпопротеїди низької щільності (ЛПНЩ-С), ліпопротеїни високої щільності (ЛПВЩ-С), аполіпопротеїн А1 (АпоА1) та аполіпопротеїн В (АпоВ) у сироватці крові. оцінити гіполіпідемічний ефект FN-MC [10,11,12]. Тим часом ми використовували оптичний мікроскоп та електронну мікроскопію для спостереження за змінами морфології та ультраструктури тканини печінки. Крім того, ми вимірювали активність супероксиддисмутази (СОД) та вміст малонового діальдегіду (МДА) в гомогенаті печінки для вивчення змін антиоксидантної здатності щурів [13,14,15].
Методи
Приготування ліків
Цілі рослини Росії Fragarianilgerrensis Шлехт. і Centella asiatica (L.) Міські (включаючи коріння, стебла та листя) вирізали після висихання. Кожне рослинне ліки важило 12 г і вимивання 500 мл 75% етанолу при кімнатній температурі протягом 3 годин. Приготували та концентрували з'єднання під вакуумом у роторному випарнику при 40 ± 5 ° C протягом 1,5 год, а потім фільтрували для отримання екстракту з отриманням сполуки, концентрація сирої лікарської речовини якої становила 0,4 г • мл - 1 [16].
Доза симвастатину для людини становить 20 мг на добу. Дозу для щурів розраховували за еквівалентною дозою людини (HED) на основі площі поверхні тіла: якщо взяти вагу людини 60 кг, HED для 20 (мг)/60 (кг) = 1/3 мг/кг [ 16]; Доза щурів, перетворена на поверхню тіла, становила 2 мг/кг; експериментальна ефективна доза вдвічі перевищувала клінічну, тож становила 4 мг/кг. Кожну капсулу симвастатину розчиняли у 50 мл води з утворенням розчину симвастатину в концентрації 0,4 мг/мл.
Дослідні тварини
Загалом 30 самців щурів Sprague-Dawley (180 ± 20 г маси тіла) було отримано від Shanghai Slac Laboratory Animal Co., Ltd. (Шанхай, Китай). Щурів утримували при температурі 22 ± 2 ° C з вільним доступом до їжі та води, у циклі 12:12 год світло/темно (світло світиться о 08:00 год). Усі експериментальні методи були схвалені Інституційними комісіями з Оглядового Університету Східного Китаю, і вони виконувались відповідно до відповідних рекомендацій та норм.
Групування тварин
Після акліматизації протягом двох тижнів щурів випадковим чином розподіляли на дві групи: група з нормальним жиром (NFD) (n = 6) та група дієти з високим вмістом жиру (HFD) (n = 24). Щурів групи HFD годували кормом з високим вмістом жиру 60% калорій протягом трьох тижнів для встановлення моделі гіперліпідемії. Через 3 тижні у гіперліпідемічних щурів відбирали зразок крові з хвостової вени для вимірювання ліпідів та розподіляли на 4 групи (n = 6 у кожній групі). (1) група HFD: HFD з 10 мл/кг/день дистильованої води; (2) група FN-MC (2 г/кг): HFD з 10 мл/кг/день 0,2 г · мл - 1 FN-MC; (3) група FN-MC (4 г/кг): HFD з 10 мл/кг/добу 0,4 г · мл - 1 FN-MC; (4) Група PDC: HFD, оброблений 10 мл/кг/день 0,4 г · мл - 1 розчин симвастатину. Щурам групи NFD давали однаковий обсяг дистильованої води, еквівалентний вазі тіла. Дистильовану воду та наркотики давали дахою один раз на день протягом 3 тижнів.
Збір зразків
Протягом експериментального періоду масу тіла реєстрували раз на тиждень, а споживання їжі кожної групи реєстрували щодня. Через 3 тижні у кожного щура збирали кров з каудальної вени після нічного голодування. Зібрану цільну кров витримували в холодильнику при 4 ° C протягом 15 хв, потім отримували сироватку після центрифугування крові (3000 об/хв протягом 15 хв) і зберігали при - 80 ° C до аналізу. Щурів жертвували вивихом шийки матки, тканини збирали і зберігали при - 80 ° C до використання.
Аналіз біохімічних показників сироватки та печінки
Загальний холестерин (ТС), тригліцериди (ТГ), холестерин ліпопротеїдів високої щільності (ЛПВЩ) та холестерин ліпопротеїдів низької щільності (ЛПНЩ) вимірювали за допомогою комерційних наборів (Інститут біоінженерії Нанкін Цзяньчен, Нанкін, Китай). до інструкцій виробників. Сироватковий аполіпопротеїн А1 (АпоА1) та аполіпопротеїн В (АпоВ) вимірювались комерційними наборами (Westang Bio-Tech, Шанхай, Китай) згідно з протоколами виробника. Частина печінки гомогенізували в крижаному PBS. Гомогенат центрифугували і супернатант відбирали для вимірювання активності SOD (метод ксантиноксидази) та вмісту MDA (метод TBA, метод тіобарбітурової кислоти), використовуючи комерційні набори (Нанкінський інститут біоінженерії Цзяньчен, Нанкін, Китай) згідно з даними інструкції виробників.
Гістологічний аналіз
Тканини печінки швидко видаляли у щурів, фіксували у 4% розчині параформальдегіду, а потім вносили у парафін. Зрізи були отримані, а пізніше забарвлені гематоксиліном та еозином (H&E) для гістологічного дослідження під мікроскопом.
Ультраструктурний аналіз
Тканини печінки виділяли від щурів, фіксували 2,5% розчином глутаральдегіду та 1% розчином осмієвої кислоти, потім зневоднювали з різним градієнтом концентрації розчину етанолу і вносили в епоксидну смолу. Зразки обробляли ультратонким мікротомом, а потім фарбували цитратом уранілу і цитратом свинцю. Нарешті, спостерігали і фотографували ультраструктуру гепатоцитів за допомогою просвічувального електронного мікроскопа. Всього для визначення площі поверхні крапель ліпідів було використано 36 площин (6 площин на групу). Площу поверхні крапель ліпідів вимірювали за допомогою програмного забезпечення Image J (Національний інститут психічного здоров’я, США).
Статистичний аналіз
Значення представлені як середнє значення ± S.E.M. Істотні відмінності між результатами п'яти груп були проаналізовані програмним забезпеченням GraphPad Prism 7.0 з використанням одностороннього ANOVA з подальшим посттестом Даннета. P
Результати
Вплив FN-MC на масу тіла, збільшення ваги та споживання їжі щурами
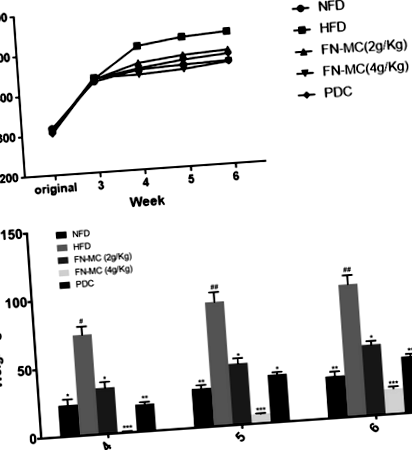
Вага тіла та приріст ваги щурів наведені в таблиці 1 та на рис. 1. У експерименті не було відмінностей у початковій масі тіла серед 5 груп (P > 0,05), що вказує на розумність групування. Протягом періоду зондування маса тіла щурів з часом зростала, а приріст ваги щурів у групі з HFD був значно вищим, ніж у інших чотирьох груп. Приріст щурів у групі FN-MC (4 г/кг) був значно меншим, ніж у групі HFD, і FN-MC (2 г/кг) також мав певний вплив на масу тіла. Через 1 тиждень проби ваги тіла групи PDC та групи FN-MC значно відрізнялися від ваги групи HFD (P Таблиця 1 Вплив FN-MC на масу тіла та споживання їжі щурами (n = 6)
Вплив FN-MC на сироваткові ліпідні профілі щурів
Вплив FN-MC на сироваткові ліпідні профілі у експериментальних щурів показано на рис. 2. Через 3 тижні рівні TC і TG у групі HFD були значно вищими, ніж у групі NFD (P Рис.2
Вплив FN-MC на сироваткові профілі ліпопротеїдів щурів
Вплив FN-MC на сироваткові профілі ліпідів у експериментальних щурів показано на рис. 3. Через 3 тижні рівні LDL-C у групі HFD були значно вищими, ніж у групі NFD (P Рис.3
Вплив FN-MC на сироваткові рівні ApoA1 та ApoB щурів
Як показано в таблиці 2, порівняно з групою NFD, рівень ApoB у групі HFD був значно вищим (P Таблиця 2 Вплив FN-MC на сироваткові рівні ApoA1 та ApoB щурів (n = 6)
Вплив FN-MC на антиоксидантну здатність печінки щурів
Як показано на рис. 4, порівняно з групою NFD, вміст MDA у печінці групи HFD значно збільшився (P Рис.4
Вплив FN-MC на морфологію та ультраструктуру тканини печінки у щурів
Гістопатологічні зрізи тканини печінки у щурів. Оригінальне збільшення 400 × і фарбування ВІН. a Група NFD; b HFD Group; c Група FN-MC (2 г/кг); d Група FN-MC (4 г/кг); e Група PDC)
Обговорення
Згідно з існуючим дослідженням, тривала дієта з високим вмістом жиру може призвести до підвищення рівня ліпідів у крові [17,18,19]. У нашому експерименті ми встановлюємо моделі гіперліпідемічних щурів, годуючи дієтою з високим вмістом жиру, щоб дослідити терапевтичний ефект FN-MC на гіперліпідемію. Наш фармакологічний тест показав, що FN-MC було достатнім для зниження рівня TC, TG, LDL-c та ApoB та підвищення рівня HDL-c, ApoA1 та ApoA1/ApoB у гіперліпідемічних щурів. Порівняно з групою HFD, вміст MDA у печінці групи FN-MC було зменшено, а активність SOD групи FN-MC збільшена. Спостерігаючи за ультраструктурою печінкової тканини, ми виявили, що після лікування FN-MC краплі ліпідів значно зменшувались, а кількість ER в цитоплазмі збільшувалось. Ці результати свідчать про те, що FN-MC чинив гіполіпідемічну та антиоксидантну дію і може мати захисну дію проти атеросклерозу, подібний до позитивного препарату симвастатину [20,21,22]. Крім того, після 6 тижнів пробірки, збільшення ваги групи FN-MC було значно нижчим, ніж у групи HFD, що вказує на те, що FN-MC має ефекти ожиріння.
Добре встановлено, що тривалий високий рівень ліпідів у крові може призвести до фіброзу печінки; дієта з високим вмістом жиру може спричинити пошкодження печінки та печінки. Мітохондрії - це органели, які забезпечують АТФ для життєдіяльності. Клітинний енергетичний метаболізм також значною мірою залежить від бета-окислення жирних кислот. Повідомлялося, що у пацієнтів з гіперліпідемією спостерігаються ультраструктурні мітохондріальні зміни. Дисфункція мітохондрій може погіршити гомеостаз жирової печінки та спричинити надмірну продукцію АФК, викликаючи перекисне окислення ліпідів, вивільнення цитокінів та загибель клітин. [23] ER відповідає за синтез, модифікацію та транспорт ліпідів, білків. Дослідження показали, що структурні та функціональні відхилення ЕР пов'язані з гіперліпідемією. Шляхом спостереження та порівняння зрізів тканин печінки ми підтвердили, що у щурів групи HFD спостерігалося збільшення крапель ліпідів, велика кількість уражень печінки, зменшення мітохондрій та ендоплазматичного ретикулума. Після лікування FN-MC жирова печінка була зменшена, краплі ліпідів значно зменшені, пошкодження печінки, спричинені дієтою з високим вмістом жиру, і кількість мітохондрій та ER в цитоплазмі збільшено.
Зміни рівня ліпідів у крові є основними факторами ризику порушень ліпідного обміну; підвищений рівень ТК, ТГ та ЛПНЩ у сироватці крові та зниження рівня ЛПВЩ є основними симптомами гіперліпідемії [24]. Відповідно до попередніх досліджень, дієта з високим вмістом жиру індукувала підвищений рівень ТК, ТГ та ЛПНЩ у сироватці крові у групі з ВЧС [25]. Рівні LDL-C та TG у сироватці крові є показниками ризику розвитку атеросклеротичних серцево-судинних захворювань. [26] Зниження рівня LDL-C та TG у сироватці може підвищити ризик розвитку судинних захворювань та зменшити частоту гострих коронарних подій. [27] У нашому дослідженні рівні ТК, ТГ, ЛПНЩ у сироватці крові були значно нижчими у групі FN-MC порівняно з групою HFD, тоді як рівні ЛПВЩ були значно підвищеними, подібно до групи PDC.
Аполіпопротеїн - це білковий компонент, який становить ліпопротеїн плазми, який транспортує ліпіди та стабілізує ліпопротеїни. ApoA1 в основному походить від HDL-C, а ApoB в основному походить від LDL-C. Отже, зниження ApoA1 та підвищення ApoB є проявом гіперліпідемії. ApoA1/ApoB є фактором ризику розвитку атеросклеротичних серцево-судинних захворювань [28]. Результати цього дослідження показали, що FN-MC збільшував сироватковий ApoAl, знижував ApoB та збільшував співвідношення ApoA1/ApoB. Це свідчило про те, що FN-MC чинив регуляторний вплив на рівень аполіпопротеїнів у дієтичних мишей з високим вмістом жиру, що вказує на регуляцію ліпідів у крові.
Окислювальний стрес викликаний дисбалансом між виробленням АФК та здатністю цих антиоксидантних ферментів [29]. Окислювальний стрес може спричинити пошкодження клітин організму та посилити декілька захворювань, таких як атеросклероз та ішемічна хвороба серця [30,31,32]. Як типовий антиоксидантний фермент, СОД видаляє супероксидні радикали шляхом каталізу [33]. Після лікування FN-MC протягом 3 тижнів активність SOD значно зросла у групі FN-MC порівняно з групою HFD. MDA - це вид виробництва перекисного окислення ліпідів. Збільшення MDA відіграє важливу роль у пошкодженні печінки, спричиненому гіперліпідемією. Ступінь перекисного окислення ліпідів може бути відображена шляхом виявлення кількості MDA. [34] У нашому експерименті показник MDA був суттєво підвищений у групі із ВЧЧ. Однак після лікування FN-MC рівень MDA значно знизився. Ці результати продемонстрували, що FN-MC може покращити активність антиоксидантних ферментів у печінці гіперліпідемічних щурів та зменшити вміст продуктів перекисного окислення ліпідів, щоб поліпшити антиоксидантну здатність щурів. Ми припустили, що FN-MC захищає печінку, пом'якшуючи ступінь перекисного окислення ліпідів, зменшуючи ступінь ураження та дегенерації клітин печінки та сприяючи її регенерації.
Тим часом було встановлено, що FN-MC впливав на збільшення ваги щурів-гіперліпідемічних моделей. Відповідно до попереднього дослідження, дієта з високим вмістом жиру спричинила збільшення маси тіла [25]. Приріст ваги групи HFD був значно вищим, ніж у інших 4 групах. Приріст ваги у групі FN-MC (4 г/кг) був значно нижчим, ніж у групі HFD, і FN-MC (2 г/кг) також мав певний вплив на зменшення приросту ваги. Однак FN-MC не мав істотного впливу на споживання їжі. Це вказувало на те, що FN-MC мав ефект проти ожиріння, що могло бути пов’язано з тим, що FN-MC може сприяти розкладанню та використанню зайвого жиру в організмі.
Висновок
Результати свідчать про те, що FN-MC може запобігти набору ваги, знизити рівень ліпідних профілів у сироватці крові, ефективно запобігти відкладенню жирових відкладень у печінці. Тим часом FN-MC підвищував активність антиоксидантних ферментів, зменшував перекисне окислення ліпідів та виявляв антиоксидантні властивості, можливо запобігаючи прогресу гіперліпідемії. Отже, FN-MC є потенційною харчовою добавкою або фармацевтичним агентом для лікування або профілактики гіперліпідемії. Необхідні подальші дослідження гіперліпідемії, антиоксидантного та механізму проти ожиріння FN-MC.
- ГІПОГЛІКЕМІЧНА ТА ГІПОЛІПІДЕМІЧНА ДІЯЛЬНІСТЬ АРГІНІНУ, ЯКИЙ ВМІСТУЄ ЕКСТРАКТ ЛИСТОВИХ ЯГОДИНИ ІНСУЛІН
- Гіполіпідемічна активність екстракту хлороформу листя Mimosa pudica
- Як дієта впливає на функцію мозку Біострап
- Якщо ви постійно їсте журавлину, це неймовірний вплив це зробить на ваше серце
- IJERPH Безкоштовна повнотекстова поширеність впливу відносного віку в російському футболі Роль хронологічного