Гіполіпідемічна активність екстракту хлороформу листя Mimosa pudica
Реха Раджендран
1 Кафедра фармакогнозії та фітохімії, Університет SRM, Фармацевтичний коледж SRM, Тамілнад, Індія
Екамбарам Кришнакумар
2 Департамент фармацевтичної біотехнології, Мохамед Сатак А. Коледж фармації, Тамілнад, Індія
Анотація
Mimosa pudica Lin., Відома як chue Mue, - це міцна, низькоросла кущова рослина, з остистими прилистками і кулястими рожевими головками квітів, і росте як бур’ян майже у всіх частинах країни. Він традиційно використовується за різних властивостей, і тому в цьому дослідженні хлороформний екстракт листя Mimosa pudica пройшов скринінг на його гіполіпідемічну активність. Гіполіпідемічну активність перевіряють шляхом індукування гіперліпідемії за допомогою атерогенної дієти у щурів-альбіносів wistar та визначають рівні різних біохімічних параметрів, таких як загальний холестерин, тригліцериди, холестерин ЛПНЩ, ЛПНЩ та ЛПВЩ. Атерогенний індекс показує міру атерогенного потенціалу препаратів. Екстракт хлороформу показав значну кількість (p Ключові слова: Атерогенна дієта, аторвастатин, біологічні маркери Хлороформ, тонкошарова хроматографія
Вступ
Mimosa pudica (Mimosaceae), відомий як chue Mue, - це міцна невисока кущова рослина зі складом листя, чутливим до дотику. Він має остисті прилистки і кулясті рожеві головки квітів і росте як бур’ян майже у всіх частинах країни (1). Повідомляється, що листя та стебло рослини містять алкалоїд мімозин; листя також містять слиз, а корінь містить дубильні речовини (1). Mimosa pudica застосовується завдяки своїм антигіперглікемічним (2), протидіарейним (3), протисудомним (4), цитотоксичним (5) та гепатопротекторним властивостям (6).
Рослина також містить листя тургоринів. Листя і коріння використовуються при лікуванні ворсів і свищів. Пасту з листя наносять на гідроцеле. Бавовна, просочена соком листя, використовується для заправки пазух. Рослина також використовується для лікування хворих на яснах і використовується як очищувач крові (1). В аюрведичній та унанійській системі медицини ця рослина застосовувалася при захворюваннях, що виникають із-за пошкодження крові та жовчі, серцевих розладів, мільярдної лихоманки, ворсів, жовтяниці, прокази, виразок та віспи.
Дисліпідемія сприяє розвитку атеросклерозу, захворювання, при якому з часом в артеріях накопичуються жирові відкладення, які називаються «наліт». Якщо наліт звужує артерії, існує велика ймовірність страждати серцевими захворюваннями, інфарктом, захворюваннями периферичних артерій (зменшення кровотоку в кінцівках, як правило, ногах) та інсультом. Люди, які страждають на діабет, частіше хворіють на атеросклероз, серцеві захворювання, погане кровообіг та інсульт, ніж ті, хто не страждає на діабет.
У багатьох хворих на цукровий діабет захворювання, які називаються «факторами ризику», сприяють розвитку атеросклерозу та його ускладнень. Сюди входять високий кров’яний тиск, надмірна вага та високий рівень глюкози в крові. Дисліпідемія також підвищує ризик розвитку атеросклерозу у хворих на цукровий діабет. Дисліпідемія вражає людей з діабетом 2 типу частіше, ніж хворих на цукровий діабет 1 типу. Найбільш поширеною дисліпідемією при цукровому діабеті є поєднання високих тригліцеридів і низького рівня ЛПВЩ. Люди з діабетом також можуть мати підвищений рівень холестерину ЛПНЩ.
Серед препаратів, доступних для лікування дисліпідемії, статини часто є першим вибором для зниження рівня загального та холестерину ЛПНЩ. Інші препарати, що знижують рівень холестерину, включають блокатори поглинання холестерину, секвестранти жовчних кислот та нікотинову кислоту. Вони можуть застосовуватися в комбінації, якщо окремий препарат неефективний для досягнення цільових рівнів. Фібрати та ніацин з пролонгованим вивільненням можуть використовуватися для зниження рівня тригліцеридів або підвищення рівня холестерину ЛПВЩ (7).
Гіперглікемія та дисліпідемія є важливими та незалежними факторами ризику розвитку судинних ускладнень і пропонують викликати серцево-судинні патологічні зміни діабетичних станів за допомогою таких молекулярних механізмів: утворення та накопичення розвинених продуктів глікації, підвищений окислювальний стрес, активація шляху протеїнкінази С, підвищена активність гексозамінового шляху, а також запалення судин та порушення дії інсуліну в судинних тканинах (8).
Оскільки рослинні види Mimosa pudica традиційно заявляються для лікування атеросклерозу; отже, у цьому дослідженні зроблена спроба відбору рослинного екстракту, який є екстрактом хлороформу листя Mimosa pudica, для виявлення гіполіпідемічної активності, щоб довести свою претензію у фольклорній практиці.
Матеріали і методи
Рослинний матеріал
Листя Mimosa pudica були закуплені у Тайлавараму (поблизу Університету SRM) у місяці лютому 2009 року. Рослину ідентифікував доктор Д. Нарашіман, Центр флористичних досліджень, Департамент біології рослин і біологічних технологій рослин, Християнський коледж Мадраса, штат Тамбарам, Ченнаї, штат Тамілнаду, Індія. Зразок ваучера (023/02/09) був зданий на зберігання у Департамент фармакогнозії та фітохімії M. S. A. J Pharmacy College, Індія, для подальшого використання. Подбали про збір здорових і молодих листя Mimosa pudica.
Приготування екстракту
Грубо подрібнене в порошок листя (300 г) Mimosa pudica екстрагували до виснаження в апараті Сокслета (9) при 50 o C з 500 мл хлороформу. Екстракт фільтрували через бавовняну пробку, потім фільтрувальний папір з ватманом (№1), а потім концентрували за допомогою роторного випарника при низькій температурі (40–60 o C) і зниженому тиску, отримуючи хлороформ, екстрактивний 8,20 г.
Попередній фітохімічний аналіз
Потім екстракт хлороформу листя Mimosa pudica піддавали попередньому фітохімічному (10) аналізу для оцінки присутності різних фітоконститунтів; виявлено наявність флавоноїдів, алкалоїдів та глікозидів. Попередні дослідження тонкошарової хромат-графії також підтвердили ці складові (11).
Аналіз ВЕРХ
П’ятнадцять мкл хлороформного екстракту Mimosa pudica Lin., Було помічено на попередньо покритому силікагелем пластині ТШХ розміром (10 х 6 см) (E. Merck) після активації при 105 ° C. Потім плямисту пластинку розробляли в попередньо насиченій камері, що містить систему розчинників толуол: етилацетат (3: 1), як умови рухомої фази для поділу. Розроблену пластину сушили на повітрі та сканували під УФ 254 нм за допомогою денситометра Camag і реєстрували хроматограму. Потім пластину обприскували розпилювальним реактивом 1% -ною сірчаною кислотою ваніліну і нагрівали при 105 ° С у духовці з гарячим повітрям протягом 5-10 хв для розвитку кольору плям. Після розвитку кольору пластину знову сканували у видимому діапазоні при 550 нм і реєстрували хроматограму.
Тварини
Для скринінгу використовували щурів-альбіносів Wistar вагою 175–225 г будь-якої статі, що утримувались у стандартних умовах вирощування (температура 23 ± 2 o C, відносна вологість 55 ± 10% та 12-годинний цикл світлого темряви). Протягом досліджуваного періоду тварини годувались стандартними лабораторними кормами та за бажанням. Експерименти проводились після затвердження експериментальних протоколів інституційним комітетом з етики тварин, Індія, 2009.
Дослідження токсичності
Дослідження гострої токсичності проводили для екстракту хлороформу за класичним методом гостротоксичних токсичних речовин відповідно до рекомендацій ОЕСР (12). Самки щурів-альбіносів використовували для дослідження гострої токсичності. Тварин тримали на ніч натще, забезпечуючи лише водою, після чого екстракт вводили перорально в дозі 300 мг/кг і спостерігали протягом 14 днів. Якщо смертність спостерігалася у двох тварин із трьох, тоді введена доза призначалася як токсична доза. Якщо смертність спостерігалася у однієї тварини, то ту саму дозу повторювали для підтвердження токсичної дози. Якщо смертності не спостерігалося, процедуру повторювали для подальших вищих доз, таких як 50, 200 та 2000 мг/кг маси тіла. У тварин спостерігали токсичні симптоми протягом 72 годин.
Гіполіпідемічна активність (13)
Тварин було розділено на чотири групи, по шість тварин у кожній групі. Для того, щоб надати гіперліпідемії щурів, їм дали атерогенну дієту, що включала основу кукурудзяного борошна, сухе молоко, масло, сіль, мелене горіхове масло, сахарозу та вітамінну суміш. Крім того, 400 мг порошку холестерину/кг маси тіла розчиняли в кокосовій олії і вводили перорально протягом 45 днів.
Група I розглядалася як контроль, який отримував 0,5% карбоксиметилцелюлози натрію; ІІ група вважалася атерогенною групою і отримувала атерогенну дієту; III групу розглядали як випробувальну групу і отримували випробуваний екстракт, який є екстрактом хлороформу Mimosa pudica у дозі 200 мг/кг маси тіла на пероральний прийом разом з атерогенною дієтою, а IV групу розглядали як стандартну групу, яка отримувала стандартний препарат Аторвастатин (доза 1,2 мг/кг маси тіла на пероральний прийом) разом з атерогенною дієтою.
Наприкінці 45-ї доби сироватку крові відбирали з ретроорбітального сплетення після нічного голодування для вивчення біохімічних показників. У сироватці крові визначали загальний рівень холестерину, тригліцеридів, ЛПНЩ, ЛПНЩ та ЛПВЩ. Індекс атерогенності (AI), який є мірою атерогенного потенціалу агента, розраховували за такою формулою, і результати складали у таблиці.
Гістопатологічні дослідження
В кінці періоду лікування тварин з усіх чотирьох груп забивали, аорту, печінку, нирки розтинали, промивали, готували зрізи предметних стекол і фарбували гемотоксилін-еозином та досліджували за допомогою світлової мікроскопії.
Статистичний аналіз
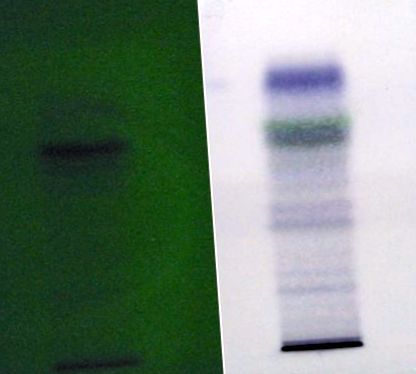
Результати були представлені як середнє значення ± SD. Значимість різниці між групами оцінювали за допомогою одностороннього дисперсійного аналізу (ANOVA) з подальшим тестом Даннета. P Таблиця 1, пластинка TLC для екстракту хлороформу показана на малюнку 1. Відбиток пальця HPTLC для екстракту хлороформу показав 6 піків на довжині хвилі 260 нм, а при 550 нм екстракт хлороформу показав 7 піків. Загальна висота та площа піків наведені в таблиці 1 .
Пластини TLC для хлороформного екстракту Mimosa pudica
Таблиця 1
Дані відбитків пальців HPTLC для екстракту хлороформу Mimosa pudica
| Хлороформ | 260 | 6 | 782,8 | 32750,1 |
| 550 | 7 | 13670 | 85680.4 |
Дослідження гострої токсичності
Екстракт хлороформу Mimosa pudica не давав жодних токсичних симптомів та смертності до рівня дози 2000 мг/кг маси тіла у щурів, а отже, екстракт вважався безпечним та нетоксичним для подальшого фармакологічного скринінгу.
Гіполіпідемічна активність
Помітне підвищення рівня холестерину в сироватці крові, тригліцеридів, ЛПНЩ та ЛПНЩ було виявлено у тварин, які отримували атерогенну дієту, і рівень ЛПВЩ був знижений. При введенні екстракту хлороформу в дозі 400 мг/кг спостерігається значне зниження рівня холестерину в сироватці крові, тригліцеридів, ЛПНЩ, ЛПНЩ та підвищення рівня ЛПВЩ, що було подібним до стандартного аторвастатину і майже наближалося до рівнів нормального контролю.
Значне відсоткове зниження рівня холестерину в сироватці крові, тригліцеридів, ЛПНЩ, ЛПНЩ та відсоток збільшення ЛПВЩ у досліджуваному екстракті також було порівнянним із стандартним препаратом. Потужний гіполіпідемічний ефект екстракту хлороформу був виявлений значним зниженням рівня холестерину в сироватці крові, ЛПНЩ, ЛПНЩ та тригліцеридів у тварин, які отримували холестерин, а також помітним підвищенням рівня ЛПВЩ (табл. 2).
Таблиця 2
Вплив Mimosa pudica на біохімічні показники
| Контроль I | 101,4 ± 0,16 | 121,2 ± 0,82 | 36,3 ± 0,07 | 80,9 ± 0,5 | 19,4 ± 0,16 |
| Атеродієта II | 242,4 ± 0,31 | 160,8 ± 0,12 | 25,3 ± 0,06 | 135,2 ± 0,13 | 30,6 ± 0,05 |
| Екстракт хлороформу III | 112,6 ± 0,17 ** | 112,6 ± 0,42 *** | 34,1 ± 0,11 *** | 82,9 ± 0,15 ** | 18,9 ± 0,09 ** |
| Стандартний аторвастатин IV | 107,1 ± 0,08 *** | 107,3 ± 0,03 *** | 32,2 ± 0,07 *** | 85,0 ± 0,25 *** | 20,6 ± 0,10 *** |
Значення, виражені як середнє значення ± SEM. Рівні значущості - II група порівняно з I, III та IV групами.
Таблиця 3
Індекс атерогенності Mimosa pudica
| Контроль I | 3.34 | - |
| Атеродієта II | 6.36 | - |
| Екстракт хлороформу III | 2.33 | 63,3% |
| Стандартний аторвастатин IV | 2.25 | 68% |
Гістопатологічний зріз аорти тварин, що харчуються атеродієтами, демонструє помітне атероматозне потовщення в інтимі. Атероматозні запальні зміни відсутні у нормальній контрольній групі та стандартній групі, яка отримувала лікарські засоби (рис. 2). Ділянка печінки тварин, що харчуються атеродієтами, має помітні перинулярні запальні жирові зміни, які порівняно слабо виражені в екстракті хлороформу (рис. 3). Нирковий зріз тварин, що харчуються атеродієтами, демонструє помітну скупченість та утворення гіалінових крапель у канальцях. У той час як у стандартних тварин та тварин, оброблених екстрактом хлороформу, спостерігалася легка скупченість, архітектура нирки помітно не змінювалась (рис. 4). З цього підтверджується антиатеросклеротичний ефект Mimosa pudica.
Гістопатологічні зрізи аорти (атерогенно-атероматозні потовщення інтими)
- ГІПОГЛІКЕМІЧНА ТА ГІПОЛІПІДЕМІЧНА ДІЯЛЬНІСТЬ АРГІНІНУ, ЯКИЙ ВМІСТУЄ ЕКСТРАКТ ЛИСТОВИХ ЯГОДИНИ ІНСУЛІН
- Гіполіпідемічний ефект Fragarianilgerrensis Schlecht
- Гіпохолестеринемічний ефект екстракту насіння гінкго білоба з мишей з високим вмістом жиру
- Виявлення моделей харчування та фізичної активності у дітей Латентний класний аналіз ожиріння
- Скільки фізичної активності потрібні дорослим CDC з фізичної активності