Флунаризин
Флунаризин - блокатор кальцієвих каналів, який може викликати паркінсонізм та екстрапірамідні побічні ефекти, а також тремор.
Пов’язані терміни:
- Паркінсонізм
- Пропранолол
- Мігрень
- Амітриптилін
- Циннарізин
- Верапаміл
- Топірамат
- Бета-блокатори
- Німодипін
- Кальцієвий канал
Завантажити у форматі PDF
Про цю сторінку
Головний біль
Вінченцо Гвідетті,. Кріштіану Термін, у Довіднику з клінічної неврології, 2010
Блокатори кальцієвих каналів
Флунаризин вивчали у відкритому дослідженні 12 пацієнтів, 8 з 12 показали зменшення частоти головного болю на 75–100% (Guidetti et al., 1987a). Згодом було проведено подвійне сліпе плацебо-контрольоване перехресне дослідження флунаризину у 70 дітей (Sorge et al., 1988). Після 4 тижнів спостереження за вихідними ліками без ліків 35 дітей отримували флунарізин та 35 - плацебо протягом 12 тижнів. Після 4-тижневого вимивання вони схрещували процедури ще 12 тижнів. В обох групах флунаризин значно знижував частоту (P Battistella et al., 1990). Після 4-тижневого періоду без введення ліків 19 пацієнтів отримували плацебо, тоді як 18 отримували німодипін протягом 12 тижнів. Після 4-тижневого періоду вимивання групи змінювали терапію на наступні 12 тижнів. Протягом першого періоду лікування не було різниці між активним препаратом та плацебо. Протягом другого періоду лікування німодипін виявив значно більший ефект, ніж плацебо, щодо частоти, тоді як відповідь була подібною до плацебо щодо тривалості нападів.
Циннаризин та флунаризин
Загальна інформація
Циннаризин та флунаризин є похідними піперазину з антигістамінними властивостями та блокуючою активністю кальцієвих каналів [1–3]. Флунаризин - це похідне дифтору циннаризину. Циннаризин застосовується для лікування хвороби руху.
Кілька контрольованих клінічних випробувань флунаризину у пацієнтів з періодичною кульгавістю припустили значне покращення суб'єктивних ознак та деякі об'єктивні виміри. Його ефективність у пацієнтів з цереброваскулярною недостатністю не була чітко продемонстрована, але його застосування для профілактики мігрені та інших форм загального головного болю було широко вивчено. Кілька подвійних сліпих контрольованих досліджень припустили, що флунаризин у дозі не більше 10 мг/добу зменшує частоту головних болів [4–6]. Клінічні дослідження протиепілептичної ефективності флунаризину були неоднозначними [7].
При підтримуючій дозі 10 мг/добу основними несприятливими ефектами флунаризину є сонливість, седація, втома та сонливість протягом перших кількох днів у приблизно 10% пацієнтів. Під час тривалого лікування деякі пацієнти відзначають труднощі зі сном, млявість та зниження мотивації. Дозування 20 мг/добу або більше може спричинити сонливість, підвищене потовиділення, периферичні набряки та втому [8].
Недавній прогрес у відкритті та розробці модуляторів кальцієвих каналів N-типу для лікування болю
4.2.2 Структури на основі піперазину
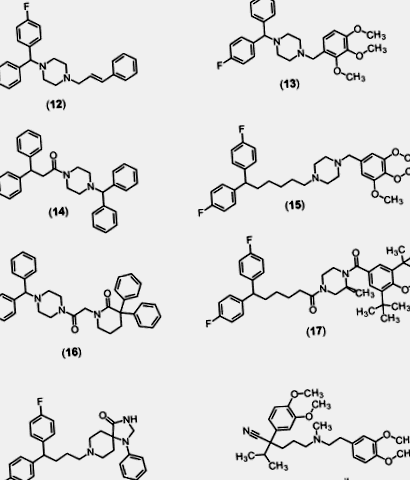
Слід зазначити, що на сьогоднішній день єдиною молекулою з перших зусиль з оптимізації дифенілметилпіперазинової основи, про яку повідомляється, що досягла розвитку в клініці, є Z160. Дійсно, подальші дослідження SAR та оптимізація навколо бензгідрильного фрагмента піперазинового ядра Z160 [118] не виявили молекул з більшою силою чи селективністю. Модифікація NP078585 для виробництва (17), включаючи заміну груп R1 і R3 на бензильній області трет-бутиловими групами, заміщення S-метилу біля піперазинового кільця, що прилягає до бензоїльного лінкера, і заміщення амінних зв'язків по обидві сторони ядра піперазину, призвели до найбільш потужних (40 нМ IC50) та селективні (3600 разів проти L-типу) сполуки з найбільшою селективністю по каналу hERG (> 100 разів) [119] .
Після високопродуктивних скринінгових зусиль дослідники з Ебботта припустили, що дифеніллактамний фрагмент може виступати біоізостеричним замінником групи дифенілметилпіперазину, яка була встановлена як важлива детермінанта спорідненості до кальцієвих каналів. На основі цієї гіпотези було підготовлено низку аналогів бензигідрилпіперазину, що містять дифеніллактам, деякі з яких продемонстрували як хорошу активність кальцієвих каналів N-типу, так і ефективність на капсаїциновій моделі вторинної гіпералгезії [120]. Одна молекула, отримана з цієї серії, A-1048400 (16), була надалі охарактеризована в ряді електрофізіологічних та неклінічних моделей ефективності [120]. Ці дослідження показали, що A-1048400 має субмікромолярну активність на кальцієвих каналах N-типу з приблизно в п'ять разів більшою ефективністю для інактивованого стану каналу. Ця молекула також продемонструвала залежну від стану активність як кальцієвих каналів T-, так і P/Q-типу з потенцією
1 мкМ. В електрофізіологічних дослідженнях A-1048400 продемонстрував також залежний від стану блок кальцієвих каналів L-типу, причому блок майже еквіпотентний такому на каналах N-типу. Цікаво, що фармакологічна селективність цієї молекули як на розслаблення тканини аорти щурів, так і на гемодинамічні показники щурів була значно вищою; принаймні в 14 разів порівняно з дозами, ефективними для зменшення ноцицептивного, запального та невропатичного болю.
- Желатин - огляд тем ScienceDirect
- Яєчний жовток - огляд тем ScienceDirect
- Германій - огляд тем ScienceDirect
- Грибок - огляд тем ScienceDirect
- Центрифуга - огляд тем ScienceDirect