Фізика тепла
Наприкінці цього розділу ви зможете:
- Визначте тепло як передачу енергії.
У главі Робота, енергія та енергетичні ресурси ми визначили роботу як силу, відстань і дізналися, що робота, що виконується на об'єкті, змінює його кінетичну енергію. Ми також бачили в температурах, кінетичній теорії та газових законах, що температура пропорційна (середній) кінетичній енергії атомів і молекул. Ми говоримо, що теплова система має певну внутрішню енергію: її внутрішня енергія вища, якщо температура вище. Якщо два об'єкти при різних температурах контактують між собою, енергія передається від більш гарячого до більш холодного об'єкта до досягнення рівноваги і досягнення тілами теплової рівноваги (тобто вони мають однакову температуру). Жоден об’єкт не виконує жодної роботи, оскільки жодна сила не діє через відстань. Передача енергії зумовлена різницею температур і припиняється, коли температури дорівнюють. Ці спостереження приводять до наступного визначення тепла: Тепло - це спонтанна передача енергії через різницю температур.
Як зазначалося в розділі "Температура, кінетична теорія та газові закони", тепло часто плутають з температурою. Наприклад, ми можемо сказати, що спека була нестерпною, коли насправді маємо на увазі, що температура була високою. Тепло є формою енергії, тоді як температура - ні. Помилка виникає через те, що ми чутливі до потоку тепла, а не до температури.
Завдяки тому, що тепло є формою енергії, воно має одиницю виміру СІ джоулів (J). Калорія (кал) є загальною одиницею енергії, що визначається як енергія, необхідна для зміни температури 1,00 г води на 1,00 ºC - зокрема, між 14,5 ºC та 15,5 ºC, оскільки існує невелика температурна залежність. Мабуть, найпоширенішою одиницею тепла є кілокалорія (ккал), яка є енергією, необхідною для зміни температури 1,00 кг води на 1,00ºC. Оскільки маса найчастіше вказується в кілограмах, зазвичай використовують кілокалорію. Харчові калорії (з урахуванням позначення Cal, а їх іноді називають "великими калоріями") насправді є кілокалоріями (1 кілокалорія = 1000 калорій), що нелегко визначити з маркування упаковки.
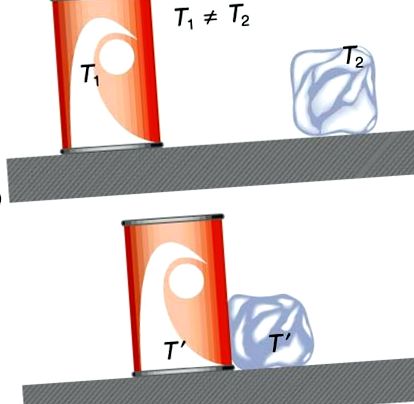
Рисунок 1. На малюнку (а) безалкогольний напій і лід мають різні температури, Т1 і Т2, і не перебувають у тепловій рівновазі. На малюнку (b), коли безалкогольному напою та льоду дозволяється взаємодіяти, енергія передається, поки вони не досягнуть однакової температури T ′, досягаючи рівноваги. Передача тепла відбувається через різницю температур. Насправді, оскільки безалкогольний напій і лід контактують із навколишнім повітрям і лавочкою, рівноважна температура буде однаковою для обох.
Механічний еквівалент тепла
Також можна змінювати температуру речовини, виконуючи роботу. Робота може передавати енергію в систему або поза нею. Це усвідомлення допомогло встановити той факт, що тепло є формою енергії. Джеймс Прескотт Джоуль (1818–1889) провів багато експериментів, щоб встановити механічний еквівалент тепла - робота, необхідна для отримання таких самих ефектів, як теплообмін. З точки зору одиниць, що використовуються для цих двох термінів, найкращим сучасним значенням для цієї еквівалентності є 1000 ккал = 4186 Дж.
Ми розглядаємо це рівняння як перетворення між двома різними одиницями енергії.
Рисунок 2. Схематичне зображення експерименту Джоуля, який встановив еквівалентність тепла та роботи.
На рисунку 2 вище показана одна з найвідоміших експериментальних установок Джоуля для демонстрації механічного еквівалента тепла. Він продемонстрував, що робота та тепло можуть спричинити однакові ефекти, і допоміг встановити принцип збереження енергії. Гравітаційна потенційна енергія (PE) (робота, що виконується силою тяжіння) перетворюється на кінетичну енергію (KE), а потім рандомізується за в'язкістю та турбулентністю у збільшену середню кінетичну енергію атомів та молекул у системі, викликаючи підвищення температури. Його внесок у область термодинаміки був настільки значним, що одиниця енергії СІ була названа на його честь.
Тепло, додане або відведене від системи, змінює її внутрішню енергію, а отже, і температуру. Таке підвищення температури спостерігається під час варіння. Однак додавання тепла не обов'язково підвищує температуру. Прикладом є танення льоду; тобто коли речовина переходить з однієї фази в іншу. Робота в системі або в системі також може змінити внутрішню енергію системи. Джоуль продемонстрував, що температуру системи можна підвищити, перемішуючи. Якщо кубик льоду натирається об шорстку поверхню, робота виконується силою тертя. Система має чітко визначену внутрішню енергію, але ми не можемо сказати, що вона має певний “вміст тепла” або “вміст роботи”. Ми використовуємо словосполучення «теплопередача», щоб підкреслити його характер.
Перевірте своє розуміння
Два зразки (А і В) однієї і тієї ж речовини зберігаються в лабораторії. Хтось додає 10 кілоджоулів (кДж) тепла до одного зразка, тоді як 10 кДж роботи виконується над іншим зразком. Як ви можете сказати, до якої проби додали тепло?
Рішення
Нагрівання та робота змінюють внутрішню енергію речовини. Однак властивості зразка залежать лише від внутрішньої енергії, так що неможливо визначити, чи додавали тепло до зразка А чи В.
Підсумок розділу
- Тепло і робота - це два різні методи передачі енергії.
- Тепло - це енергія, що передається виключно за рахунок різниці температур.
- Будь-яку енергетичну одиницю можна використовувати для передачі тепла, і найпоширенішими є кілокалорія (ккал) і джоуль (Дж).
- Кілокалорія визначається як енергія, необхідна для зміни температури 1,00 кг води між 14,5ºC і 15,5ºC.
- Механічний еквівалент цього теплообміну становить 1,00 ккал = 4186 Дж.
Концептуальні запитання
- Як пов’язана передача тепла з температурою?
- Опишіть ситуацію, при якій відбувається теплообмін. Які утворюються форми енергії?
- Коли тепло передається в систему, чи зберігається енергія як тепло? Поясніть коротко.
Глосарій
тепло: мимовільний перенос енергії через різницю температур
кілокалорія: 1 кілокалорія = 1000 калорій
механічний еквівалент тепла: робота, необхідна для отримання тих самих ефектів, що і передача тепла
- Скільки калорій у рибі, щука, північна, варена, сухе тепло
- Скільки калорій у рибі, лососі, перекусі, вареному, сухому жарі
- Скільки енергії в калоріях потрібно, щоб нагріти 18 кубічних сантиметрів жиру з 25
- Натуральні стилі для нарощування тренажерних залів для кожного тренування; Волосся без тепла
- Визначення тепла та факти Британіка