Фатальна привабливість: як бактеріальні адгезини впливають на сигналізацію господаря та що ми можемо навчитися від них
Анотація
Здатність видів бактерій колонізувати та інфікувати організми хазяїна критично залежить від їх здатності прилипати до клітинних поверхонь хазяїна. Відомо, що прилипання до клітинних поверхонь має важливе значення для активації та доставки певних факторів вірулентності, але також може безпосередньо впливати на передачу сигналів клітин-господарів для сприяння поширенню та виживанню бактерій. У цьому огляді ми обговоримо останні досягнення в галузі адгезії бактерій, те, як ми починаємо розкривати вплив адгезинів на сигналізацію клітини-хазяїна, і як ці зміни допомагають бактеріям з точки зору їх виживання та ухилення від імунної відповіді. Нарешті, ми підкреслимо, як експлуатація бактеріальних адгезинів може забезпечити нові терапевтичні шляхи для лікування широкого кола бактеріальних інфекцій.
1. Вступ
Таблиця 1
Бактеріальні адгезини та їх ліганди.
| S. aureus | Коефіцієнт злипання A (ClfA) | Γ-ланцюг фібриногену | Адгезія та ухилення від імунітету | [14,15] |
| Коефіцієнт збивання B (ClfB) | Α-ланцюг фібриногену, кератин 10 та лорікрин | Адгезія до десквамованих епітеліальних клітин | [15] | |
| FnBPA/FnBPB | Фібронектин, γ-ланцюг фібриногену та еластин | Адгезія до ECM, формування біоплівки | [15] | |
| Колагеновий адгезин (Cna) | Колаген, доповнення C1q | Адгезія, ухилення від доповнення | [15] | |
| Streptococcal sp. | Sfbl | Фібронектин | Адгезія | [8,9] |
| Yersinia sp. | Інвазін | β1-інтегрин | Адгезія, інтерналізація | [16] |
| Тримерний автотранспорт YadA | Фібронектин, колаген | Адгезія, інтерналізація | [17] | |
| Хвороба | Фібронектин, ламінін, C4bp, доповнення H | Доставка йопа, адгезія, інтерналізація, сироваткова стійкість | [18,19] | |
| Кишкова паличка | CU P-pilus | Гал (α1-4) гал, що містить рецептори | Адгезія, імунна відповідь | [20] |
| МС типу I пілі | Манноза, що містить глікопротеїни | Спайка, запалення | [21,22] | |
| Афа/д-р | Колаген, hDAF, CEACAM | Спайка, запалення | [23] | |
| Кучері | Фібронектин, ламінін | Формування біоплівки, інвазія, запалення | [24] | |
| Тримерний автотранспортний антиген 43 | Невідомо | Агрегація | [25] | |
| N. meningitidis | Набряк IV типу | Невідомо | Адгезія, агрегація, рухливість, перенесення ДНК | [26] |
| М. туберкульоз | Mtp амілоїд | Ламінін | Адгезія, колонізація | [27] |
| MCE1a | Невідомо | Адгезія, інвазія | [28,29] | |
| V. parahaemolyticus | МАМ7 | Фосфатидова кислота, фібронектин | Адгезія, інвазія | [30] |
| H. pylori | Набряк IV типу | β5-Інтегрін | Вироблення гастрину, підвищує кислотність | [31] |
| BabA | Антиген Льюїса В. | Спайка, запалення | [32] | |
| L. rhamnosus Г.Г. | SpaCBA pilus | Слиз | Адгезія, імуномодуляція | [33,34] |
| Salmonella sp. | FliC | Холестерин | Адгезія, формування біоплівки | [35] |
| PefA | Антиген групи Льюїса X | Адгезія | [36] | |
| Тип I pilus FimH | Манноза, що містить глікопротеїни | Адгезія | [37] |
FnBP: білки, що зв’язують фібронектин; ECM: позаклітинний матрикс; CU: Шаперон-вступник.
Тому очевидно, що адгезія залишається невід’ємною ознакою протягом усього перебігу бактеріальних інфекцій. Хоча тема адгезії бактерій та певною мірою вплив цього на сигналізацію клітини-господаря вже розглядався раніше [1,2], у цьому огляді ми прагнемо узагальнити ключові моменти, що стосуються різних механізмів бактеріальної адгезії, та виділити останні досягнення на місцях, з акцентом на ефекти адгезії на сигналізацію клітини господаря і, нарешті, як ці взаємодії можуть бути використані з точки зору нових методів лікування широкого кола бактеріальних інфекцій, уникаючи при цьому нецільових ефектів на господаря.
2. Бактеріальні класи адгезину та їх ліганди
2.1. Білки, що зв'язують інтегрин та фібронектин
Інтегрини представляють висококонсервативну групу гетеродимерних трансмембранних глікопротеїнів, які є важливими для багатьох взаємодій клітина-клітина та клітина-матрикс. Зокрема, було показано, що інтеграни, що зв’язують колаген, зберігаються у всьому метазойському дереві життя і утворюють важливий компонент багатоклітинності у тварин [3,4,5]. Завдяки цій широко розповсюдженій присутності по всьому царству тварин і тому факту, що передача сигналів інтегрину полегшує багато важливих клітинних каскадів сигналізації, включаючи ті, що беруть участь у адгезії клітин та організації цитоскелета, у багатьох видів бактерій розвинулися механізми адгезії, які взаємодіють прямо або опосередковано з рецепторами інтегрину господаря.
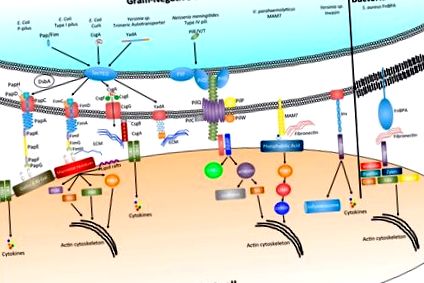
Білки, що зв’язують фібронектин (FnBP), складають різноманітну групу поверхневих адгезинів, які зв’язуються з білком фібронектину позаклітинного матриксу (ECM). Таким чином, вони є підкласом великого сімейства бактеріальних адгезинів, які називаються мікробними поверхневими компонентами, що розпізнають молекули клейової матриці, або короткими MSCRAMMS [6]. У випадку з грампозитивною бактерією Staphylococcus aureus ця взаємодія з фібронектином всередині ECM здатна полегшити зв'язування бактерій з поверхнею клітини-хазяїна, використовуючи зв'язування фібронектинів з інтегрином клітини-господаря α5β1 (рис. 1). Було показано, що зв’язування FnBPA S. aureus з інтегрином α5β1 за допомогою мостування фібронектину полегшує поглинання бактерій у клітинах хазяїна [7]. Крім того, було показано, що стрептококовий FnBP Sfbl/F1 також опосередковує інвазію епітеліальних клітин [8,9]. Хоча, як повідомляється, зв'язування FnBP з фібронектином є сильною взаємодією (
2,5 нН), можливо через те, що один FnBP може зв'язувати до 9 молекул фібронектину [10,11], значення FnBP під час інфікування при порівнянні або мутантних штамів дикого типу, або FnBP in vivo було змінним. Існує припущення, що це може бути пов'язано із типово широким спектром захворювань, спричинених цими організмами, і поширеність додаткових факторів вірулентності за деяких обставин може мати зайву роль [12]. Однак недавнє дослідження продемонструвало, що FnBPs необхідні для формування біоплівки у штамі S. aureus LAC, метицилінорезистентному клінічному ізоляті [13].
Бактеріальні адгезини та їх вплив на сигналізацію клітини-господаря.
Бактерії також можуть прилипати до клітин-господарів та інтерналізуватися в них шляхом безпосередньої взаємодії з інтегринами. Білок інвазин Yersinia сприяє початковій адгезії бактерії і з високою спорідненістю пов'язується з β1-інтегриновими рецепторами, виявленими на поверхні М-клітин [16]. Однак після початкового приєднання та інвазії експресія інвазину зменшується, а адгезія підтримується адгезинами YadA та Ail, які опосередковують сироваткову резистентність та сприяють чіткій прихильності до білків ECM фібронектину та колагену (рис. 1) [17,19]. Механізм інвазіації інвазином буде розглянуто нижче.
2.2. Chaperone-Usher Pili: P Pili та тип I Pili
Пілі типу I представляють інший клас гетерополімерних фімбрій, присутніх на поверхні патогенної кишкової палички (UPEC та DAEC) і кодуються фім-опероном. Подібно до P-pilus, тип I типу формується через шлях CU, що включає FimC як периплазматичний шаперон та FimD як зовнішню мембрану (рис. 1) [40]. Кінець адгезину фімбрії утворений субодиницею FimH, яка пов'язує моно- та три-маннозу, що містять глікопротеїни. Структурний та біофізичний аналіз типу I та P-пілі продемонстрував, що зв'язування адгезинів наконечника з відповідними лігандами відбувається через уловлювальний зв'язок (зв'язок, міцність якої збільшується під дією такої сили, як напруга на зсув), і що регулювання зв'язування міцність можна контролювати шляхом розмотування спірально накрученого доменного стрижня [41]. Крім того, нещодавні дані також свідчать про те, що FimH є ключовим фактором впливу на вірулентність. Було продемонстровано, що через зміну конформації адгезину точковими мутаціями в FimH хвороби Крона, пов'язаної з адгезивно-інвазивною кишковою паличкою, виникає посилене запалення кишечника за невідомим механізмом [22].
2.3. Тип IV Пілі
2.4. Клейові амілоїди
2.5. Автотранспортери
2.6. Молекули багатовалентної адгезії
3. Вплив адгезії бактерій на сигналізацію клітини-господаря
Здатність прикріплюватися до клітинних поверхонь хазяїна, очевидно, є ключовим першим кроком у колонізації, оскільки це може зменшити здатність очищення від хазяїна через напругу зсуву, однак одного прикріплення недостатньо для встановлення та підтримання інфекції. Бактерії розвинули механізми маніпулювання навколишнім середовищем хазяїна та імунної відповіді, щоб допомогти їх поширенню та виживанню шляхом зміни сигналізації клітини хазяїна. Хоча цю здатність на пізніх стадіях зараження можна віднести до безлічі секретуються ефекторів, залежно від бактерій та середовища ніші, є накопичувальні докази того, що на початкових стадіях зараження багато видів здатні маніпулювати сигналами клітин-господарів безпосередньо через процес адгезії.
Незважаючи на те, що зв'язування інтегрину є загальною мішенню для багатьох патогенних мікроорганізмів, щоб змінити організацію цитоскелету актину, останні дослідження виділили альтернативні молекули поверхневих клітин, які також можуть призвести до подальшого впливу на цитоскелет. Фосфатидні кислоти складають від 1% до 4% вмісту фосфоліпідів у клітині і є ключовими попередниками для інших фосфоліпідів, регулюють кривизну мембрани і можуть впливати на широкий спектр сигнальних молекул [61,62,63,64,65]. Нещодавно було показано, що скупчення адгезину MAM7 V. parahaemolyticus на поверхні клітини-господаря при зв’язуванні з фосфатидною кислотою опосередковує активацію малої GTPase RhoA. Активація в RhoA призводить до перебудови актину, що призводить до перерозподілу білків з щільним з'єднанням і порушення цілісності епітелію. Це руйнування епітеліального бар'єру дозволяє V. parahaemolyticus транслокуватися через поляризовані епітеліальні шари [66].
Бактеріальні адгезини також можуть викликати імунні відповіді в тканині хазяїна, такі як субодиниця CsgA Enlin бактерій Enterobacteriaceae, яка зв'язується і активує сигналізацію Toll-подібного рецептора 2 в клітинах господаря, що призводить до посилення запалення [67].
4. Потенціал пригнічення адгезії як нове втручання в інфекцію
5. Підсумок
Подяка
Деніел Х. Стоунз та Енн-Марі Крахлер висловлюють подяку Новій нагороді дослідників Ради з питань біотехнологій та біологічних наук (BBSRC) BB/L007916/1.
- Чи впливає куріння на рівень енергії та мотивацію у вашому розумі
- Чи впливає ваша група крові на ваш раціон
- Список продуктів для дітей, щоб вони були щасливими, активними та здоровими - по-лістонському
- Курка слабка, втрачена вага, блідий гребінець Кури BackYard - Дізнайтеся, як вирощувати курей
- Сни покійної матері - дізнайтеся тлумачення снів