Діяльність печінкової ERK відіграє певну роль в енергетичному обміні
Пінг Цзяо
1 Центр діабету та ендокринології Халлет, лікарня Род-Айленда, медична школа Уоррена Альперта, Університет Брауна, Провіденс, RI 02903, США
2 Школа фармацевтичних наук, Університет Цзілінь, Чанчунь, провінція Цзілінь, Китай
Бен Фен
1 Центр діабету та ендокринології Халлет, лікарня Род-Айленда, медична школа Уоррена Альперта, Університет Брауна, Провіденс, RI 02903, США
Юцзе Лі
1 Центр діабету та ендокринології Халлет, лікарня Род-Айленда, медична школа Уоррена Альперта, Університет Брауна, Провіденс, RI 02903, США
Цинь Хе
1 Центр діабету та ендокринології Халлет, лікарня Род-Айленда, медична школа Уоррена Альперта, Університет Брауна, Провіденс, RI 02903, США
Хайян Сю
1 Центр діабету та ендокринології Халлет, лікарня Род-Айленда, медична школа Уоррена Альперта, Університет Брауна, Провіденс, RI 02903, США
Анотація
1. Вступ
2. Матеріали та методи
2.1. Реактиви та клітини
Антитіла до фосфо-ERK, tERK та MEK1 були придбані у Cell signaling (Danvers, MA). Антитіло до тубуліну придбано у Abcam (Кембридж, Массачусетс). Антитіло до MKP-3 було придбано у компанії Santa Cruz Technology (Санта-Крус, Каліфорнія). Клітини Фао були надані д-ром Жиданом Ву (Інститут біомедичних досліджень Novartis) і культивовані в RPMI 1640 з 10% фетальною бичачою сироваткою (Xu et al., 2005).
2.2. Екстракція РНК та ПЛР-аналіз у реальному часі
Зразки РНК витягували з тканин за допомогою реагенту TRIzol (Invitrogen, Carlsbad, CA) відповідно до інструкцій виробника. Зразки РНК, оброблені ДНКазою I, реверсували зворотну транскриптазу SuperScript III (Applied Biosystems, Карлсбад, Каліфорнія) та випадкові гексамери (Invitrogen) для отримання кДНК. ПЛР-аналіз у реальному часі проводили за допомогою реагенту Power SYBR Green RT-PCR (Applied Biosystems) на моделі термоциклера ABI Prism StepOnePlus (Applied Biosystems). Кожна 15 мкл реакції ПЛР містила 1 × реакційну суміш, 5,5 мМ MgSO4, 300 нМ прямого праймера та 300 нМ зворотного праймера. Програма термічного циклічного руху становила 50 ° C протягом 2 хвилин, потім 95 ° C протягом 10 хвилин протягом 1 циклу, потім 95 ° C протягом 15 секунд, після чого 60 ° C протягом 1 хвилини протягом 40 циклів. Аналіз кривої плавлення проводили для забезпечення специфічності праймерів. 28S рРНК використовували як еталонний ген у кожній реакції. Послідовності праймерів ПЛР в реальному часі є такими:
PEPCK 5 ’CTGCATAACGGTCTGGACTTC, 3’ CAGCAACTGCCCGTACTCC
G6Pase 5 ’CGACTCGCTATCTCCAAGTGA, 3’ GTTGAACCAGTCTCCGACCA
MKP-3, 5 ’ATAGATACGCTCAGACCCGTG, 3’ ATCAGCAGAAGCCGTTCGTT
FAS, 5 ’GGCTCTATGGATTACCCAAGC, 3’ CCAGTGTTCGTTCCTCGGA
ACC1, 5 ’CGGACCTTTGAAGATTTTGTGAGG, 3’ GCTTTATTCTGCTGGGTGAACTCTC
ACC2, 5 ’GGAAGCAGGCACACATCAAGA, 3’ CGGGAGGAGTTCTGGAAGGA
PPARα 5 ’AGAGCCCCATCTGTCCTCTC, 3’ ACTGGTAGTCTGCAAAACCAAA
CPT-1β 5 ’GCACACCAGGCAGTAGCTTT, 3’ CAGGAGTTGATTCCAGACAGGTA
VLCAD 5 ’TCAGGTGTTCCCATACCCATC, 3’ AAGGCGTCGTTCTTGGCAG
2.3. Вестерн-блот-аналіз
Тканини та клітини гомогенізували та лізували з холодним буфером для лізису, доповненим інгібіторами протеази. Білкові лізати відокремлювали на 4–12% гелі Bis-Tris-PAGE, переносили на мембрани полівінілідендифториду з подальшим блокуванням протягом 60 хвилин у 1% бичачому сироватковому альбуміні/1 × солі, забуференному Tris, з Твін-20 (TBST) або 5% знежирене сухе молоко/1 × TBST. Потім мембрани інкубували з відповідними первинними антитілами у присутності 1% бичачого сироваткового альбуміну/1 × TBST або 5% нежирного сухого молока/1 × TBST протягом ночі на коромислі при 4 ° C. Після ретельного промивання в 1 × TBST мембрани піддавали дії відповідних вторинних антитіл до пероксидази хрону в 5% нежирному сухому молоці/1 × TBST протягом 1 години при кімнатній температурі. Після ретельного промивання в 1 × TBST сигнали виявляли за допомогою розчину для виявлення хемілюмінесцентного вестерн-блоттингу (PerkinElmer, Waltham, MA) на системі візуалізації Alpha-Inotech fluorochem.
2.4. Побудова та очищення аденовірусу
2.5. Технічне обслуговування та аналіз мишей
2.6. Тести на толерантність до глюкози та інсуліну
Для тесту на толерантність до глюкози (GTT) мишей голодували протягом ночі, а потім вводили глюкозу в дозі 2 г/кг для мишей-самців, що годували чау, або в дозі 0,75 г/кг для мишей DIO. Рівні глюкози в крові вимірювали через 0, 15, 30, 45, 60 та 90 хвилин після ін'єкції. Для тесту на толерантність до інсуліну (ITT) мишей голодували протягом 6 годин і вводили інсулін у дозі 0,5U/kg для мишей-самців, що годували чау, та 1,5U/kg для мишей DIO. Рівні глюкози в крові вимірювали кожні 15 хвилин до 90 хвилин після ін'єкції.
2.7. Непряма калориметрія
Споживання кисню (VO2), вироблення діоксиду вуглецю (VCO2) та споживання їжі вимірювали індивідуально протягом 24 годин за допомогою комплексної лабораторної системи моніторингу тварин (Columbus Instruments, Columbus, OH) після одноденної аклімації. Під час експерименту миші мали вільний доступ до їжі та води. Витрати енергії розраховували за такою формулою: VO2 × (3,815 + 1,232 × RQ), нормували по відношенню до маси тіла тварини та коригували відповідно до ефективного значення маси, яке становить масу тіла 0,75 .
2.8. Гістологічний аналіз
Тканини печінки фіксували у 10% нейтрально забуференному формаліні протягом однієї доби, потім переносили у 70% етанол та вбудований парафін. Фарбування глікогену (PAS) було проведено в основній лабораторії лікарні Род-Айленда.
2.9. Вимірювання вмісту тригліцеридів (TAG) та вільних жирних кислот (FFA)
Вміст печінкової ТАГ визначали за допомогою гомогенатів печінки. Заморожені тканини зважували, подрібнювали в рідкому азоті, гомогенізували в етанолі, вихрово перемішували, центрифугували і супернатант збирали для вимірювання. Стандарти або зразки TAG змішували з реакційним буфером (100 мМ Трис, рН 7,4, 1 мМ MgCl2, 0,05 мМ АТФ, 0,2 Од/мл пероксидази хрону, 1 Од/мл гліцерину фосфат-оксидази, 2 О/мл гліцерол-кінази, 25 О/мл ліпази, і 0,05 мМ Amplex червоний) та інкубували протягом 30 хвилин при 37 ° C. Для вимірювання вмісту FFA у плазмі крові стандарти або зразки змішували з реакційним буфером (100mM Tris, pH7,4, 1mM MgCl2, 0,05mM ATP, 0,2U/мл пероксидази хрону, 0,05U/мл ацил-CoA-синтетази, 0,05U/мл ацил-КоА-оксидази, 0,04 мМ CoA, 0,004 мМ FAD та 0,05 мМ Амплекс червоний) та інкубували протягом 30 хвилин при 37 ° C. Флуоресценцію зчитували при збудженні 530 нм/випромінювання 590 нм за допомогою планшетного зчитувача Synergy 4 (BioTek Instruments, Winooski, VT).
2.10. Виділення первинних адипоцитів
Мишей голодували протягом ночі, а первинні адипоцити отримували з жирових прокладки гонад, як описано раніше (Feng et al., 2011; Jiao et al., 2011). Коротко кажучи, адипоцити виділяли з жирових прокладки гонад мишей шляхом травлення колагеназою (1 мг/мл, тип I). Жирові прокладки з гонад розтинали, зважували, прополіскували та розрізали на дрібні шматочки в ізоляційному буфері. Подрібнені жирові прокладки перетравлювали при 37 ° С протягом 30 хвилин, а потім фільтрували через сітку 380 мкМ для отримання одноклітинної суспензії. Після центрифугування при 1000 об/хв плаваючі адипоцити збирали і двічі промивали ізоляційним буфером.
2.11. Ліполіз в ізольованих адипоцитах
Ізольовані адипоцити інкубували в ізоляційному буфері плюс носій або 1 мкМ ізопротеренолу протягом 1 години. Зразки центрифугували і супернатанти нагрівали при 80 ° С. Для вимірювання вивільнення гліцерину гліцеринові стандарти або зразки змішували з реакційним буфером (100 мМ трис, рН 7,4, 1 мМ MgCl2, 0,05 мМ АТФ, 0,2 од/мл пероксидази хрону, 1 од/мл гліцерину фосфат-оксидази, 2 од/мл гліцерол-кінази, і 0,05 мМ Amplex червоний) та інкубували протягом 30 хвилин при 37 ° C. Флуоресценцію зчитували при збудженні 530 нМ/випромінювання 590 нМ за допомогою планшетного зчитувача Synergy 4.
2.12. Ядерна локалізація злитого білка FOXO1-GFP
Клітини Фао інфікували аденовірусом, що експресує β-gal або MEK CA на 12-лункових планшетах. Через двадцять чотири години ці клітини трансфікували pcDNA-FOXO1-GFP. Через сорок вісім годин після трансфекції клітини інкубували в безсироватковому середовищі протягом шістнадцяти годин, потім інкубували в безглюкозному безсироватковому DMEM, доповненому 1 мкМ дексаметазоном, 2 мМ пуривату та 20 мМ лактату, ще протягом трьох годин. Потім клітини фіксували в 10% формаліні протягом 30 хвилин при кімнатній температурі та інкубували з 1 мкг/мл DAPI протягом 1 години при 37 ° С. Знімки були зроблені з копій свердловин. Відсоток локалізації ядерного FOXO1 розраховували шляхом ділення кількості зелених клітин з переважною ядерною локалізацією на загальну кількість зелених клітин.
2.12. Статистичний аналіз
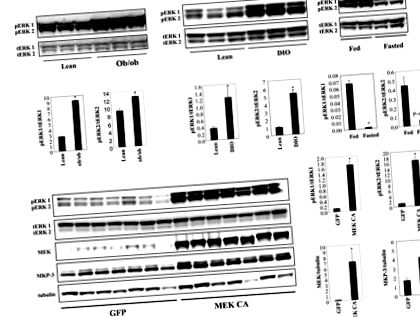
Результати представлені як середнє значення ± SEM. Статистичну значимість було визначено на рис P 1A). Збільшення фосфорилювання ERK у печінці мишей DIO з’являється на пізній стадії розвитку ожиріння, оскільки фосфорилювання ERK у печінці мишей DIO, які годувались дієтою з високим вмістом жиру протягом шістнадцяти тижнів, не мало значного збільшення (дані не наведені). Фосфорилювання ERK1/2 у печінці худих мишей може бути зменшено голодуванням (рис. 1А), що вказує на роль у відповідь на зміни енергетичного стану.
A. Рівні фосфорилювання ERK1/2 у печінці самців мишей ob/ob та DIO порівняно з худими контролями (n = 3 у кожній групі, миші DIO були на дієті з високим вмістом жиру протягом 24 тижнів) та в печінці годуваних проти пісних мишей ( n = 2 у кожній групі). B. Надмірна експресія конститутивно активного MEK1 (MEK CA) у печінці худих самців мишей C57BL/6 (n = 7 у кожній групі). Мишей приносили в жертву через сім днів після ін’єкції вірусу натщесерце. * P Рисунок 1B). Експресія білка MKP-3, фосфатази MAP-кінази з високою специфічністю до ERK, значно підвищується завдяки потенційному механізму негативного зворотного зв'язку для обмеження активності ERK (рис. 1B). Конститутивна активація печінкової ERK протягом семи днів не впливала на масу тіла або рівень глюкози в крові після їжі, але суттєво збільшила рівень глюкози в крові натще і вага печінки (рис. 2А).
Мишей жертвували через сім днів після ін’єкції вірусу. A. Вплив на експресію генів, що беруть участь у глюконеогенезі. B. Вплив на експресію генів, що беруть участь у синтезі ліпідів. C.. Вплив на експресію генів, що беруть участь в окисленні жирних кислот. * P Рисунок 4A – B). Адипоцити, виділені від мишей, яким вводили Ad-MEK CA, виявляли вищу ліполітичну активність як в базальних, так і в стимульованих ізопротеренолом умовах (рис. 4С). Підвищений ліполіз, ймовірно, є основним фактором, що сприяє підвищенню рівня циркулюючої жирної кислоти та зменшенню жирової маси у мишей з конститутивною активацією ERK у печінці протягом тривалого часу. Дослідження метаболічної клітини виявило зменшення споживання кисню, зниження викиду вуглекислого газу, зменшення енергетичних витрат та зменшення споживання їжі у мишей, яким вводили Ad-MEK CA порівняно з мишами, яким вводили Ad-GFP (рис. Температура основного тіла також була значно нижчою у мишей, яким вводили Ad-MEK CA у годуванні та знижували стан натще (Малюнок 5).
A Печінкова активація ERK та вплив на толерантність до інсуліну (n = 6–7 у кожній групі). Аденовіруси, що експресують GFP або MEK CA, вводили в дозі 5 × 10 11 частинок на мишу. * P Рисунок 7А). Чутливість до інсуліну та толерантність до глюкози значно покращились у мишей DIO, яким вводили аденовірус, що експресує shERK1/2, порівняно з контрольними мишами, що експресують shGFP (рис. 7В), що вказує на те, що ендогенна печінкова активність ERK при ожирінні сприяє системній резистентності до інсуліну. Вміст глікогену в печінці значно зменшився у мишей DIO, яким вводили аденовірус, що експресує shERK1/2, порівняно з контрольними мишами DIO, яким вводили shGFP (рис. 7C), але вміст TAG в печінці не змінювався за рахунок послабленої сигналізації ERK. Рівні циркулюючої жирної кислоти також значно зменшувались при зменшенні печінкової активності ERK, що свідчить про потенційний механізм поліпшення чутливості до інсуліну (рис. 7С).
Виноски
Заява видавця: Це PDF-файл нередагованого рукопису, який прийнято до друку. Як послуга для наших клієнтів ми надаємо цю ранню версію рукопису. Рукопис пройде копіювання, набір версій та перегляд отриманого доказу, перш ніж він буде опублікований у остаточній формі. Зверніть увагу, що під час виробничого процесу можуть бути виявлені помилки, які можуть вплинути на вміст, і всі юридичні застереження, що стосуються журналу, стосуються.
- Мамо; s Стиль життя відіграє велику роль у дитині; s Ризик ожиріння MedPage сьогодні
- Кето-дієта відіграє ключову роль у стартапах, які претендують на зворотний діабет - Business Insider
- Менопаузальний статус та абдомінальне ожиріння є важливими факторами метаболізму печінкових ліпідів у
- Чи існує якийсь зв’язок між надмірною вагою, фізичною активністю, споживанням жиру та клітковини з
- Турбота про здоров’я, мотиви вибору їжі та ставлення до здорового харчування Посередницька роль їжі