Диференціальний вплив харчового натрію на артеріальний тиск та атеросклероз у мишей з гіперхолестеринемією ☆
Хонг Лу
Центр серцево-судинних досліджень Саха, Університет Кентуккі, Лексінгтон, KY 40536
Конгін Ву
b Випускник центру харчових наук, Університет Кентуккі, Лексінгтон, KY 40536
Дебора А. Хаватт
Центр серцево-судинних досліджень Саха, Університет Кентуккі, Лексінгтон, KY 40536
Анжу Балакрішнан
Центр серцево-судинних досліджень Саха, Університет Кентуккі, Лексінгтон, KY 40536
Річард Дж. Чарніго, молодший
c Департамент статистики Університету Кентуккі, Лексінгтон, KY 40536
Ліза А. Кассі
b Випускник центру харчових наук, Університет Кентуккі, Лексінгтон, KY 40536
Алан Догерті
Центр серцево-судинних досліджень Саха, Університет Кентуккі, Лексінгтон, KY 40536
b Випускник центру харчових наук, Університет Кентуккі, Лексінгтон, KY 40536
Анотація
1. Вступ
Харчова сіль (хлорид натрію) необхідна організму для підтримки гомеостазу води та натрію. Він також відіграє важливу роль у регуляції артеріального тиску. Хоча механізми недостатньо вивчені, епідеміологічні дослідження на людях та інтервенційні експерименти на моделях тварин дають вагомі докази того, що велике споживання натрію призводить до підвищення артеріального тиску [1–4]. Високий кров'яний тиск є загальновизнаним фактором ризику розвитку атеросклерозу. Однак маніпулювання харчовим натрієм дало суперечливі результати у дослідженнях атеросклерозу з використанням моделей мишей. Хоча деякі дослідження повідомляли, що натрій з високим вмістом їжі збільшує атеросклероз [4,5], два дослідження показали, що низький вміст натрію в їжі збільшує атеросклероз у мишей з гіперхолестеринемією [6,7]. Суперечливі висновки цих досліджень роблять висновок про більш складну роль дієтичного споживання натрію у розвитку атеросклерозу, ніж причинно-наслідковий зв’язок, зумовлений зміною артеріального тиску.
На додаток до регуляції артеріального тиску, високий вміст натрію в їжі пригнічує систему ангіотензинових ренінів (RAS), тоді як обмежене споживання натрію активує RAS, що добре задокументовано як у дослідженнях на людях, так і на тваринах [8–10]. Активація RAS підвищує кров'яний тиск і сприяє розвитку атеросклерозу. Прямі дані свідчать, що інфузія ангіотензину II (AngII) спричиняє помітне підвищення систолічного артеріального тиску та прискорює атеросклеротичне утворення у мишей з гіперхолестеринемією [11,12]. І навпаки, фармакологічні інгібіції та генетичні порушення RAS знижують артеріальний тиск та послаблюють атеросклероз у цих тваринних моделях [13–19]. Хоча високий кров'яний тиск є критичним фактором ризику розвитку атеросклерозу, є накопичувальні докази того, що активація RAS сприяє розвитку атеросклерозу через механізми, що не включають зміни артеріального тиску [11,13,14,16,17,20–23].
Досі невідомо, чи суперечливі результати попередніх досліджень, що стосуються споживання натрію в їжі на атеросклероз, відображають диференційований вплив споживання натрію в їжі на артеріальний тиск та RAS. Для вирішення цього питання ми рандомізували гіперхолестеринемічних мишей до однієї з трьох дієтичних концентрацій натрію. Наша гіпотеза полягала в тому, що низьке вживання в їжу натрію сприятиме розвитку атеросклерозу через активацію RAS. Харчові потреби у “нормальних” концентраціях натрію у мишей невідомі. Дієта, збагачена насиченими жирами, що використовується багатьма лабораторіями [14,21,24,25] для стимулювання гіперхолестеринемії та індукції атеросклерозу у мишей, містить 0,1% ваги/ваги (мас./Мас.) Натрію (Na 0,1%). Дорослі миші (віком 8 тижнів), які харчуються цією дієтою, стабільно набирають масу тіла зі швидкістю 2–3 г на тиждень. Тому ми використовували 0,1% Na для наближення до “нормальної” дієтичної концентрації натрію для цього дослідження. Потім ми вибрали Na 2% та 0,01% як високу та низьку дієтичні концентрації натрію відповідно. Щоб визначити вплив дієтичного споживання натрію на розвиток атеросклерозу, ми дослідили атеросклеротичні ураження по всьому корінцю аорти після 12 тижнів годування вибраних дієт рецепторами ліпопротеїдів низької щільності (ЛПНЩ) -/- самців мишей.
2. Методи та матеріали
2.1. Миші та дієта
Миші чоловічого рецептора ЛПНЩ -/- (B6.129S7-Ldlr tm1Her; Stock # 002207) мишей були придбані в лабораторії Джексона (Бар-Харбор, штат Мен, США) і рандомізовані у три групи. Всіх мишей утримували в бар’єрних приміщеннях для тварин в Університеті Кентуккі та годували звичайною лабораторною дієтою для мишей, що містить 0,2% Na (Дієта № 2918; Харлан Теклад, Медісон, Вісконсин, США). Щоб викликати гіперхолестеринемію, дієту змінили на дієту, додану з такою ж кількістю насичених жирів (молочний жир 21% мас.) Та холестерину (0,2% мас.), Але що містить різні концентрації натрію (Na 0,01%, 0,1%, або 2% мас./Харлан Теклад). Тривалість обраного дієтичного годування становила 12 тижнів, починаючи з мишей 8 тижнів. Дослідження проводилось із схвалення Комітету з питань догляду та використання тварин Університету Кентуккі.
2.2. Вимірювання артеріального тиску
Систолічний артеріальний тиск вимірювали за допомогою неінвазивної системи хвостової манжети (Coda 6; Kent Scientific Corp., Torrington, CT, USA). Вимірювання проводили протягом 5 днів поспіль до обраного раціону харчування, щоб сформувати базовий артеріальний тиск (тиждень 0), та на 4, 8 та 12 тижнях відповідно під час годування обраними дієтами [26].
2.3. Вимірювання концентрації натрію в сечі
Двадцять чотиригодинну сечу збирали через 10 тижнів вибраного дієтичного годування за допомогою метаболічної системи клітин (модель MMC100; Hatteras Instruments, Cary, NC, США) і зберігали при -80 ° C. Зразки сечі були доставлені на сухий лід до Університету Міссурі для вимірювання концентрації натрію в сечі. Швидкість виведення натрію з сечею розраховували, використовуючи концентрації натрію в сечі та 24-годинний об’єм сечі.
2.4. Вимірювання концентрації холестерину в плазмі та розподілу ліпопротеїнів
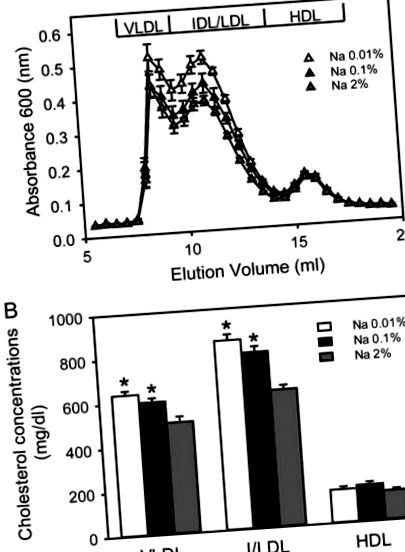
Концентрації холестерину в плазмі крові вимірювали за допомогою комерційного набору (Каталожний номер 439-17501; Wako Chemicals USA, Richmond, VA, USA). Розподіл ліпопротеїнів у плазмі крові (від п’яти до шести зразків плазми з кожної групи) визначали методом виключення за розмірами за допомогою швидкодіючої рідинної хроматографічної машини. Тридцять дві фракції з кожного зразка плазми були зібрані та згодом виміряні за допомогою набору для аналізу на основі ферментів концентрацій холестерину в плазмі. Концентрації холестерину в плазмі крові ліпопротеїдів дуже низької щільності (VLDL-C), ліпопротеїдів середньої/низької щільності (I/LDL-C) та ліпопротеїдів високої щільності (HDL-C) у трьох групах аналізували за допомогою програмного забезпечення PeakFit (SeaSolve Software, Сан-Хосе, Каліфорнія, США). Це програмне забезпечення дозволило аналізувати хроматографічні дані за допомогою автоматизованої функції нелінійного розділення піків, як описано раніше [27].
2.5. Вимірювання концентрації реніну та альдостерону у плазмі крові
Концентрацію реніну в плазмі крові вимірювали радіоімуноаналізом (RIA). Коротко, зразки плазми (8 мкл) інкубували з надлишком щурячого ангіотензиногену в присутності ЕДТА (0,02 М) протягом 30 хв при 37 ° С. AngI, згенерований у зразках, кількісно визначали RIA за допомогою комерційного набору (номер за каталогом 1553; DiaSorin, Stillwater, MN, USA). Концентрації альдостерону в плазмі крові визначали за допомогою комерційного набору (номер за каталогом DSL-8600; Diagnostic Systems Laboratories, Webster, TX, USA), як описано раніше [14].
2.6. Кількісна оцінка атеросклеротичних уражень
Атеросклеротичні ураження кількісно визначали по всьому корінню аорти, як було описано раніше [28,29].
2.7. Ланцюгова реакція полімерази в реальному часі (ПЛР) реніну в нирках
Загальну РНК збирали з нирок миші, використовуючи систему загальної ізоляції РНК SV (номер за каталогом Z3100; Promega, штат Медісон, штат Вісконсин, США). ПЛР у режимі реального часу проводили, як описано раніше [30]. Ряд мРНК реніну в нирках розраховували з нормалізацією до 18S рРНК за допомогою методу ΔΔ Ct.
2.8. Імунофарбування макрофагів
Імунофарбування проводили на зрізах коренів аорти, як описано раніше [31]. Макрофаги в атеросклеротичних ураженнях виявляли за допомогою антитіл CD68 проти мишей щурів (Клон FA-11, номер за каталогом MCA1957, AbDSerotec, Ролі, штат Північна Кароліна, США) з відповідними негативними контролями [31].
2.9. Статистичний аналіз
Таблиця 1
Характеристика чоловічих мишей рецепторів ЛПНЩ -/-, які харчуються збагаченою насиченим жиром дієтою, що містить вибрані концентрації натрію
| Кількість на групу | 18 | 16 | 18 |
| Вага тіла (базовий рівень; г) | 21,4 ± 0,7 | 21,5 ± 0,6 | 21,5 ± 0,7 |
| Вага тіла (термінація; г) | 33,8 ± 0,6 * | 34,8 ± 1,0 * | 28,5 ± 0,8 |
| Холестерин плазми концентрації (мг/дл) | 1625 ± 92 * | 1612 ± 78 * | 1264 ± 74 |
| Альдостерон у плазмі концентрації (нг/мл) | 253 ± 24 * | 150 ± 36 *, # | 53 ± 6 |
| Витрата води (мл/24 год) | 1,9 ± 0,1 * | 2,5 ± 0,3 * | 5,1 ± 0,2 |
| Об’єм сечі (мл/24 год) | 0,70 ± 0,04 * | 0,87 ± 0,11 * | 2,13 ± 0,15 |
| Швидкість виведення Na з сечею (мкмоль/24 год) | 8,8 ± 0,7 * | 29,7 ± 3,1 *, # | 770,2 ± 93,3 |
Значення представлені як середнє значення ± S.E.M.
3.3. Низький вміст у раціоні натрію призвів до збільшення кількості мРНК ниркового реніну та концентрації реніну в плазмі
Ренін є чутливим параметром при визначенні циркулюючих гормональних змін RAS. ІРНК ниркового реніну була більш поширеною у мишей, яких годували Na 0,01%, ніж у тих, хто годував Na 2% або Na 0,1% (рис. 3А). Відповідно до зміни мРНК, миші, які годували Na 0,01%, демонстрували вищі концентрації реніну в плазмі, ніж ті, що годували Na 2% або Na 0,1% (рис. 3B).
Низький вміст натрію в їжі призвів до збільшення атеросклеротичного ураження в коренях аорти. Зони атеросклеротичного ураження вимірювали в коренях аорти. Трикутники представляють середні площі ураження по всьому корінню аорти (вісім серійних зрізів/корінь аорти; n = 13–15/група) кожної миші. Кола представляють засоби, а стовпчики - S.E.M. Статистичний аналіз проводили за допомогою одного способу ANOVA. Не було значущих відмінностей середніх площ ураження між мишами, яких годували Na 0,1%, і мишами, які годували або Na 0,01%, або Na 2%.
Ми також проаналізували зв'язок між систолічним артеріальним тиском та розміром атеросклеротичного ураження за допомогою кореляцій Пірсона та моделей лінійної регресії. Істотної кореляції між систолічним артеріальним тиском та розміром ураження не спостерігалося.
4. Обговорення
У цьому дослідженні вибрані дієтичні споживання натрію виявляли диференційований вплив на систолічний артеріальний тиск та атеросклеротичні ураження. Хоча високий вміст натрію в їжі підвищував систолічний артеріальний тиск, він знижував як концентрацію реніну в плазмі, так і зону атеросклеротичного ураження в корінцях аорти чоловічих мишей рецепторів ЛПНЩ -/- годували насиченою жирами дієту протягом 12 тижнів.
На відміну від нижчого систолічного артеріального тиску, концентрація реніну в плазмі крові була вищою у мишей, які отримували низький вміст натрію в їжі, ніж у тих, що годувались нормальним або високим вмістом натрію (Na 0,1% та Na 2%). Хоча механізми ще не встановлені, ці результати узгоджуються з висновками, представленими як на людях, так і на моделях тварин [6,7,9,10,34]. На додаток до цього дослідження є й інші докази активації RAS щодо споживання натрію в їжі. Більш конкретно, апоЕ -/- миші, які годували нормальну лабораторну дієту для гризунів, що містить 0,01% Na, мали вищі концентрації AngII у плазмі порівняно з тими, які годували Na 0,25% [7]. Наші результати в поєднанні з літературними даними свідчать про те, що низький вміст натрію в їжі активує RAS у мишей з гіперхолестеринемією, що може сприяти розвитку атеросклерозу.
Це дослідження також виявило, що миші, які харчуються високим вмістом натрію в їжі, мали менший приріст маси тіла порівняно з тими, які годували або Na 0,01%, або Na 0,1%. Хоча про це ніде не повідомлялося, недавнє дослідження виявило неоднозначний вплив споживання натрію в їжі на зміну маси тіла [38]. Самки мишей ApoE -/-, яких годували або Na 0,03%, або Na 3,2%, набирали більше ваги порівняно з тими, що годували Na 0,28%, але механізм не досліджували. У нашому дослідженні ми не побачили жодної різниці у споживанні їжі, хоча споживання води та об'єм сечі були збільшені у мишей, яких годували Na 2%. Повідомлялося, що зменшення RAS призводить до зменшення маси тіла у мишей [39]. Хоча ця тема виходить за рамки мети цього дослідження, цікавим буде вивчити механізм, за допомогою якого кількість споживаного натрію в їжі регулює масу тіла в майбутньому дослідженні.
На закінчення, вибрані дієтичні маніпуляції натрієм мають різний вплив на систолічну регуляцію артеріального тиску та розвиток атеросклерозу у мишей з гіперхолестеринемією.
Подяка
Це дослідження підтримано Національним інститутом охорони здоров'я (> HL062846). Ми визнаємо кваліфіковану технічну допомогу Джессіки Мурлеген, Дебри Л. Ратері та Вікторії Інгліш.
- Вплив харчового лляного насіння на скорочувальну функцію судин та атеросклероз протягом тривалого періоду
- Дієтичні добавки вітаміну С знижують артеріальний тиск у DOCA-сольових гіпертонічних чоловіків Sprague
- Дієтичне споживання вуглеводів та смертність - перспективне когортне дослідження та мета-аналіз
- Дієтичне споживання вуглеводів та смертність - перспективне когортне дослідження та мета-аналіз - PubMed
- Дієтичний жир (оливкова олія або соняшникова олія) та взаємодія фізичних тренувань з ліпідами крові