Дієтичний куркумін значно покращує асоційоване із ожирінням запалення та діабет у мишачих моделей діабету
Анотація
Ожиріння є основним фактором ризику розвитку діабету 2 типу, і в даний час визнано, що обидва стани мають значні запальні компоненти, що лежать в основі їх патофізіології. Ми перевірили гіпотезу, згідно з якою рослинна поліфенольна сполука куркумін, яка, як відомо, має потужну протизапальну та антиоксидантну дію, покращить діабет та запалення на мишачих моделях інсулінорезистентного ожиріння. Ми виявили, що дієтична домішка куркуміну покращує діабет у людей, що страждають ожирінням та страждають лептином, страждають ожирінням та страждають лептином, самцями мишей C57BL/6J, як визначають тестування на толерантність до глюкози та інсуліну та відсоток гемоглобіну A1c. Лікування куркуміном також суттєво зменшило інфільтрацію макрофагами білої жирової тканини, збільшило вироблення адипонектину в жировій тканині та знизило активність ядерного фактора κB печінки, гепатомегалію та маркери запалення печінки. Отже, ми робимо висновок, що куркумін, який потрапляє всередину, змінює багато запальних та метаболічних розладів, пов’язаних із ожирінням, та покращує глікемічний контроль на мишачих моделях діабету 2 типу. Ці або споріднені сполуки вимагають подальшого розслідування як нових допоміжних методів лікування діабету 2 типу у людини.
ВИСОКА РЕАЛЬНІСТЬ ожиріння є основною загрозою для здоров’я населення. Ожиріння є важливим фактором ризику розвитку інфаркту міокарда, інсульту, цукрового діабету 2 типу, раку (1,2,3,4,5), жіночого безпліддя (6,7,8) та ускладнень вагітності (9). Не дивно, що ожиріння також пов'язане із суттєвим зниженням якості життя, пов'язаного зі здоров'ям, та збільшенням витрат на лікування (10,11,12). З огляду на велике навантаження, що накладається ожирінням на добробут суспільства, необхідно розробити нові методи, які можуть зменшити його поширеність, а також повернути назад шкідливі фізіологічні зміни.
Є переконливі докази того, що великий компонент патофізіології, пов’язаної з ожирінням, може походити із слабозапального прозапального стану. Прояви цього прозапального стану включають посилену продукцію прозапальних молекул, таких як TNF-α, білок хемоаттрактантів моноцитів (MCP) -1, індуковану синтазу оксиду азоту та інгібітор активатора плазміногену-1 в жировій, печінковій та м’язовій тканинах та посилену активацію запальні сигнальні шляхи, такі як ядерний фактор-kB (NF-κB) та системи N-кінцевих кіназ Jun у цих тканинах. Біла жирова тканина у людей, що страждають ожирінням, запалюється гістологічно, з ознаками гіпоксії, підвищеної загибелі адипоцитів та інфільтрацією як макрофагів, так і цитотоксичних Т-клітин у стромальний судинний простір (13,14,15).
Цільові делеції декількох генів, важливих для опосередкування запальних реакцій, захищають від розвитку резистентності до інсуліну та гіперглікемії на мишачих моделях ожиріння. Деякі з цих генів кодують цитокіни, такі як TNF-α та MCP-1 (16,17). Нещодавно кілька досліджень показали, що порушення гена, що кодує вроджений рецептор імунної системи Toll-подібний рецептор (TLR) -4 у мишей, забезпечує захист від індукованого ожирінням запалення та резистентності до інсуліну (18,19,20,21,22). Крім того, інгібування передачі сигналів NF-κB з використанням високих доз саліцилатів або умовна делеція інгібіторної κB-кінази-β у клітинах мієлоїдної лінії забезпечує захист від індукованого ожирінням запалення та резистентності до інсуліну на моделях мишей (23, 24). І навпаки, стимуляція печінкової сигналізації NF-κB трансгеном є достатньою для збільшення місцевої печінкової продукції прозапальних цитокінів та системної інсулінорезистентності (25). Отже, сполуки, що послаблюють запальну реакцію, пов’язану з ожирінням, можуть виявитися корисними для медичного лікування пацієнтів з діабетом 2 типу.
Матеріали і методи
Дослідні тварини
Миші дикого типу та ob/ob самці C57BL/6J були отримані з лабораторії Джексона (Bar Harbor, ME). Мишей розміщували п’ятьох в клітці і підтримували 12-годинний світлий і 12-годинний темний цикл з вільним доступом до їжі та води. Отримавши у віці 8–10 тижнів, мишей об/об рандомізували для отримання стандартизованої дієтичної їжі з 4 мас.% Жиру (D12450B-I; Research Diets, Нью-Брансвік, Нью-Джерсі), що містить або 3 мас.% Домішки куркумін або відсутність добавки. Мишей дикого типу C57BL/6J отримували у віці 3–5 тижнів і рандомізували для отримання або стандартизованої дієти на 4% жиру за вагою, або дієти з високим вмістом жиру, що містить 35% жиру по масі (D12492-I; Дієти досліджень). У віці 20 тижнів ці миші дикого типу були додатково рандомізовані з урахуванням додавання до їх попередньо призначеного раціону 3% вагової домішки куркуміну або без добавки.
В якості куркуміну використовували Куркумін С3 Комплекс (Sabinsa Corp., Newark, NJ), який є 95% стандартизованим екстрактом куркуміну. Усі миші залишалися на призначеному їм раціоні, поки вони не загинули від задухи СО2 у віці приблизно 24–28 тижнів. Усі протоколи проводились згідно з керівництвом Національного інституту охорони здоров’я щодо догляду та використання лабораторних тварин і були затверджені Комітетом з догляду та використання тварин Колумбійського університету.
Аналіз складу тіла
Маси жиру та нежирної тканини розраховували на живих неанестезованих мишах за допомогою апарату ядерно-магнітного резонансу (ЯМР) (Bruker, Billerica, MA). Гранульовану їжу зважували щодня, щоб оцінити загальну кількість споживаної їжі на клітку на день, а потім розділили на 5, щоб оцінити середньодобову кількість споживаної їжі на мишу.
Тест на толерантність до глюкози
Після голодування у свіжих клітках протягом 16 год протягом ночі збирали приблизно 25 мкл крові на кінчику хвоста для встановлення рівня глюкози та інсуліну натще. Після цього всі миші отримували одну одиницю (0,01 куб. См) 20% розчину декстрози на грам маси тіла шляхом внутрішньовенного введення. Рівень глюкози в крові кінчика хвоста оцінювали за допомогою глюкометра Freestyle Flash (Abbott, Abbott Park, IL) через 15, 30, 60 та 120 хв. Зразки крові центрифугували при 14000 об/хв протягом 10 хв (4 С), а сироватки переносили в свіжі пробірки і заморожували при -80 С для подальшого аналізу інсуліну.
Тест на толерантність до інсуліну
Після голодування мишей протягом 6 год для стабілізації рівня глюкози та інсуліну в їжі було зібрано приблизно 25 мкл крові на кінчику хвоста для встановлення рівня глюкози та інсуліну натще. Потім миші отримували 1,5 од/кг звичайного інсуліну (Lilly, Indianapolis, IN) шляхом внутрішньовенного введення. Рівень глюкози в крові кінчика хвоста оцінювали за допомогою глюкометра через 15, 30, 45, 60 та 120 хв.
Імуногістохімія
Усі тканини фіксували протягом 12–16 год при кімнатній температурі в цинково-формаліновому фіксаторі (Z-Fix; Anatech Ltd., Battle Creek, MI) і вкладали у парафін. Тканину розрізали на ділянки розміром 5 мкм, розрізані з інтервалом 50 мкм, а потім встановлювали на заряджені скляні предметні стекла, депарафінізували в ксилолі та фарбували. Білі жирові предметні стекла фарбували макрофагом специфічним моноклональним антитілом F4/80, наданим Е. Річардом Стенлі (Медичний коледж Альберта Ейнштейна, Нью-Йорк, Нью-Йорк). Для кожного жирового депо миші було проаналізовано чотири різні поля великої потужності з кожного з чотирьох різних розділів. Для кожного поля підраховували загальну кількість ядер та кількість ядер клітин, що експресують F4/80. Частка клітин, що експресують F4/80, для кожного зразка була розрахована як сума кількості ядер клітин, що експресують F4/80, поділена на загальну кількість ядер у зрізах (SPOT, версія 3.3; Diagnostic Instruments Inc., Стерлінг Хайтс, Мічиган).
Кількісна ПЛР в режимі реального часу
Загальну РНК екстрагували із замороженої жирової тканини (100 мг) за допомогою комерційно доступного кислотно-фенольного реагенту (TRIzol; Invitrogen, Карлсбад, Каліфорнія). Для зразків тканин кДНК першої нитки синтезували із застосуванням зворотної транскриптази SuperScript III та праймерів випадкових гексамерів, як описано в протоколі виробника (Invitrogen). Зразки кДНК розбавляли 1:25 у воді без нуклеази (QIAGEN Inc., Валенсія, Каліфорнія). Зразки з кожного пулу кДНК розбавляли 1:10, 1:30, 1:90 та 1: 270, щоб створити стандартну криву для розрахунку відносних рівнів експресії генів. Суміші для ампліфікації ПЛР (20 мкл) містили 10 мкл 2 × PCR SYBR Green I QuantiTect master суміш (QIAGEN), 0,4 мкл суміші 25 мкм зворотного та прямого праймерів та 11,6 мкл розведеного матриці кДНК. Кількісну ПЛР у режимі реального часу проводили за допомогою приладу DNA Engine Opticon 2 (MJ Research Inc., Waltham, MA) з наступними циклічними параметрами: активація полімерази протягом 15 хв при 95 С та ампліфікація протягом 40 циклів по 15 с при 94 С, 10 с при 58 С і 10 с при 72 С. Після ампліфікації аналіз кривої плавлення підтвердив присутність одного амплікону в кожному випадку.
Для аналізу експресії ми використовували попередньо підтверджені праймери ПЛР у режимі реального часу (QuantiTect; QIAGEN) для кількох генів миші: рибосомного білка S3, Emr1 (антиген F4/80), TNF-α, IL-6 та білка, пов'язаного з адипоцитарним комплементом (адипонектин). ).
Для кожної кДНК та зразка стандартної кривої проводили кількісні ПЛР для визначення експресії кожного гена внутрішнього контролю. Для обчислення нормованих рівнів відносної експресії кожного гена, які аналізували в кожній пробі, ми розділили значення відносної експресії генів для цієї вибірки на середнє геометричне значення відносної експресії контрольних генів. Окремі аналізи, в яких значення відносної експресії нормалізувались із значеннями відносної експресії кожного контрольного гена, давали подібні результати.
Аналіз на гормони
Після мінімального голодування протягом 6 год, щоб уникнути будь-яких потенційно гострих коливань глюкози або лептину, пов’язаних із недавнім прийомом їжі, мишей зважували, а потім вимірювали рівень глюкози в крові за допомогою глюкометра (Glucometer Elite, Elkhart, IN), використовуючи приблизно 5 мкл крові кінчика хвоста. Потім вони були вбиті задухою CO2. Потім їх кров отримували шляхом серцевої пункції, давали їй згортатися на льоду протягом 3 год, а потім центрифугували при 10000 × g протягом 10 хв. Потім сироватки переносили в чисті флакони для зберігання при -80 ° С до дня аналізу. Інсулін миші у сироватці крові, лептин, MCP-1, адипонектин, резистин та активатор тканинного плазміногену-1 кількісно визначали методом ІФА (Linco Research Inc., Сент-Чарльз, Міссурі). Усі коефіцієнти варіації між- та внутрішньопробними були менше 10%.
Аналіз активності NF-κB
Екстракти ядерних білків готували з тканини печінки контрольних та куркумін-годували мишей за допомогою набору ядерних екстрактів (Active Motif, Карлсбад, Каліфорнія) відповідно до інструкцій виробника. Потім кількісно визначали концентрації білка за допомогою аналізу Бредфорда, а рівні кількості білка використовували в колориметричному аналізі NF-κB, специфічному для активованої форми субодиниці p65 NF-κB (набір TransAM NF-κB p65; Активний мотив).
Статистика та визначення
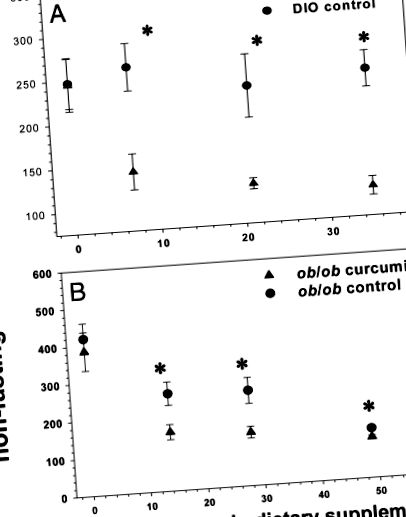
Для порівняння аналітів сироватки крові між худими експериментальними групами C57BL/6J та ожирінням використовували двосторонній тест студента. P 1, A і B). Ця закономірність зберігалася у мишей DIO протягом 5 тижнів лікування, тоді як миші ob/ob з часом з часом стали евглікемічними без лікування, що є відомим явищем, пов’язаним з гіперплазією острівців підшлункової залози (44). Як миші DIO, так і ob/ob, оброблені куркуміном, виявили суттєво зменшені ділянки під кривою (AUC), отримані шляхом тестування толерантності до глюкози протягом 2 годин (рис. 2 2, A та B), порівняно з контролем. Більше того, відсоток гемоглобіну A1c (HbA1c) у мишей DIO та ob/ob значно зменшився після 5 тижнів обробки куркуміном (рис. 3 3),), а от у худих мишей дикого типу такого зниження не було зафіксовано що куркумін не викликає гіпоглікемію у евглікемічних тварин.
Вплив куркуміну на рівень глюкози в крові у мишей із ожирінням та діабетом. Дієтичний куркумін значно знижував випадкові рівні глюкози в крові як у самців мишей C57BL/6J DIO (A), так і ob/ob (B) протягом 6-тижневого періоду. Рівень глюкози в крові у мишей ob/ob, які отримували контрольну дієту, з часом спонтанно нормалізувався через їх схильність до гіперплазії острівців підшлункової залози та гіперінсулінемії (n = 5 на групу). *, P 4A). ). Не було виявлено такої різниці для куркумін-мишей, які годували DIO-мишей (рис. 4В (рис. 4В),), які, на відміну від своїх аналогів об/об, виявляли рівні глюкози в крові, які були значно нижчими, ніж їхня контрольна когорта, у подібному ступені ~ 40 мг/дл) у будь-який момент часу, включаючи вихідний рівень натщесерце. Щоб зобразити точніше враження про їхній глікемічний статус, їх тест на толерантність до інсуліну також був показаний із використанням середніх рівнів глюкози для осі ординат, а не відсотків базальних рівнів глюкози (рис. 4C 4C).
Вплив куркуміну на толерантність до інсуліну у мишей із ожирінням та діабетом. Куркумін покращує толерантність до інсуліну у мишей ob/ob, що проявляється зниженням AUC 2-годинного тесту на толерантність до інсуліну з рівнем глюкози в крові після ін'єкції інсуліну, вираженим у відсотках від базового рівня глюкози (A). У самців мишей DIO таких відмінностей не спостерігалося (В), оскільки вони виражали значно нижчий рівень глюкози натще, ніж їх відповідна контрольна група та після ін'єкції інсуліну; їх глюкози в кожну часову точку після цього залишалися значно нижчими (С) (n = 5 на групу). *, P 5). ). Оброблені куркуміном DIO та ob/ob миші важили дещо, але значно менше, ніж їх контрольна когорта (рис. 6 6, B та C). Лікування куркуміном також асоціювалося зі значно меншим вмістом жиру в організмі мишей DIO та ob/ob та мишами з більшою мірою у мишей ob/ob, як було визначено за допомогою аналізу ЯМР Bruker (рис. 6 6, B та C). У той час як контрольні миші DIO з високим вмістом жиру продовжували набирати вагу протягом усього цього дослідження, миші DIO, які перейшли на дієту з високим вмістом жиру, але збагачена куркуміном, втратили значну кількість ваги на 2 тижні в цьому дослідженні, яке після цього здавалося плато (рис. 6D 6D).
Вплив куркуміну на споживання їжі мишами. Дієтичний куркумін був пов’язаний із суттєво збільшеним споживанням їжі у нежирних і DIO, але не об/об, мишей C57BL/6J, навіть після компенсації 3% споживання їжі, яке було куркуміном (n = 5 на групу). *, P (рис.7). ). Ми також проаналізували вплив лікування куркуміном на експресію кількох генів, які, як відомо, тісно корелюють із запальним процесом у перигонадальній білій жировій тканині за допомогою кількісної ПЛР у реальному часі. Куркумін суттєво знижував експресію Emr1, макрофагоспецифічного гена, що кодує антиген F4/80 (рис. 8, 8),), що узгоджується зі зниженою імуногістохімічною присутністю макрофагів, що спостерігаються в жировій тканині на перерізі. Лікування куркуміном значно збільшило перигонадальну жирову експресію генів, що кодують фактор транскрипції форхеда Foxo1 та протизапальний адипокін адипонектин. Ці висновки узгоджуються з нещодавніми дослідженнями, які показали зниження експресії жирової тканини Foxo1 у мишей із ожирінням та пряму стимуляцію транскрипції адипонектину Foxo1 в адипоцитах (45,46).
Вплив куркуміну на жирове запалення. Багато адипоцитів у жировій тканині необроблених мишей чоловічої статі виявляють темне забарвлення на F4/80, маркер макрофагів, тоді як жир тих мишей, які отримували дієтичний куркумін, демонструє значно менше фарбування макрофагів (В і С).
Вплив куркуміну на жирову експресію генів цитокінів та реакцію на стрес. Дієтичний куркумін значно підвищує експресію адипонектину (Acdc) та зменшує експресію F4/80 (Emr1) у перигонадальній білій жировій тканині самців мишей ob/ob через 10 тижнів (A). Лікування куркуміном також спричинило суттєвий ефект на транскрипцію гена перигонадального жиру на стрес-реакцію на ER із значним збільшенням експресії Sirt1, HSP70, HSP90 та FOXO1a (B) (n = 5 на групу). *, P 9). ). Вага печінки куркумін-годували мишей об/об не важили суттєво менше, ніж контролі, ефект, який потенційно можна пояснити повною відсутністю лептину у цих мишей, що, як було показано, пов'язано з важким та рефрактерним гепатостеатозом (47,48) . Ми визначили, що куркумін суттєво знижує експресію печінкового TNF-α, супресора сигналізації цитокінів-3, MCP-1 [рецептор хемокінів (мотив CC)] та ліганду-2 хемокіну (CC мотив) у мишей ob/ob (рис. 10 10). ). Використовуючи специфічний аналіз активності p65 (набір TransAM NF-κB p65; Активний мотив), ми встановили, що була значно менша активність p65 у зразках ядерних екстрактів печінки, отриманих від оброблених куркуміном DIO та мишей ob/ob, порівняно з тими, що отримані від необроблених мишей (рис. 11 11). ). Зниження активності NF-κB може також пояснити збільшену м’язову масу, яку спостерігають у мишей ob/ob, що харчуються куркуміном, оскільки активація NF-κB сильно сприяє м’язовій атрофії, особливо внаслідок невикористання (49).
Вплив куркуміну на вагу печінки. Лікування куркуміном асоціювалося зі значним зниженням ваги печінки у ДІО, але не з об/мишами (n = 5 на групу). *, P 12). ). Це узгоджується з даними жирової експресії та їх покращеними результатами на тесті толерантності до інсуліну (рис. 4 4). ). Рівні MCP-1 у сироватці крові, моноцитарного хемоаттрактантного фактора, що секретується адипоцитами, знижувались куркуміном у всіх експериментальних групах, досягаючи значущості в нежирних та DIO-групах. Це узгоджується зі зменшеною інфільтрацією макрофагів, відзначених імуногістохімічно в перигонадальній тканині мишей з ожирінням у цьому дослідженні.
- Ефекти несучості er-каротину, куркуміну, аліцину та бутирату натрію несучок
- Багата клітковиною дієта з коричневим рисом покращує функцію ендотелію при цукровому діабеті типу 2
- EndoBarrier покращує результати для пацієнтів із ожирінням, діабетом 2 типу
- Дієтичні підходи для пацієнтів із серцевою недостатністю та діабетом - Батлер - 2018 - Практичні
- Дієтичний підхід до зменшення запалення ЦНС, пов’язаного зі старінням Нейрологічна нейрологія Том 8, No 2