Дієтичне харчування з високим вмістом жиру по-різному впливає на розвиток запалення в центральній нервовій системі
Анотація
Передумови
Ожиріння та пов'язані з ним розлади стають головною проблемою охорони здоров'я у багатьох країнах. В результаті запалення низької ступеня ураження вражає не тільки периферію, але й центральну нервову систему. Ми взяли курс на вивчення впливу дієти з високим вмістом жиру на різні регіони центральної нервової системи з урахуванням запального тонусу.
Методи
Ми використовували модель ожиріння, спричинену дієтою, і порівнювали протягом кількох часових точок (1, 2, 4, 6, 8 та 16 тижнів) групу мишей, які годували дієту з високим вмістом жиру, а відповідна контрольна група отримувала стандартну дієту. Ми також провели масштабний аналіз ліпідів у центральній нервовій системі за допомогою ВЕРХ-МС, а потім протестували цікаві ліпіди на первинній спільній культурі астроцитів та мікрогліальних клітин.
Результати
Ми вимірювали підвищення запального тонусу мозочка в різні моменти часу. Однак на 16 тижні ми довели, що запальний тонус демонструє суттєві відмінності у двох різних регіонах центральної нервової системи, зокрема збільшення мозочка та відсутність модифікації кори головного мозку для дієтичних мишей з високим вмістом жиру у порівнянні з мишами, яких годували чау. . Наші результати чітко вказують на залежність від регіону, а також залежність від часу адаптації центральної нервової системи до дієти з високим вмістом жиру. Відмінності запального тонусу між двома розглянутими регіонами, здається, стосуються астроцитів, але не мікрогліальних клітин. Крім того, широкомасштабний скринінг ліпідів, поєднаний з тестуванням ex vivo, дозволив нам визначити три класи ліпідів - фосфатидиліноситоли, фосфатидилетаноламіни та лізофосфатидилхоліни, а також пальмітоїлетаноламід, як потенційно відповідальний за різницю запального тонусу.
Висновки
Це дослідження демонструє, що запальний тонус, викликаний дієтою з високим вмістом жиру, не впливає так само на окремі ділянки центральної нервової системи. Більше того, ідентифіковані та перевірені ex vivo ліпіди показали цікаві протизапальні властивості і можуть бути додатково вивчені для кращої характеристики їх активності та ролі у контролі запалення в центральній нервовій системі.
Передумови
Ожиріння та пов'язані з ним розлади стають проблемами охорони здоров'я у всьому світі [1–3]. Ожиріння розглядається як запальний стан через пов'язане із ним низькостепенне запалення [4–6], що вражає периферію та збільшує частоту багатьох патологій, таких як серцево-судинні захворювання [7], астма [8] або навіть рак [9]. Один із запропонованих механізмів, що призводить до периферичного запалення, стосується мікробіоти кишечника. Більш конкретно, дієта з високим вмістом жиру (HFD) змінить баланс між різними популяціями бактерій у кишечнику [10, 11]. Це призведе до порушення цілісності кишкового епітелію, що, в свою чергу, призведе до посиленого проходження ендотоксинів (таких як ліпополісахариди (LPS)) у кров, що в подальшому сприятиме запаленню периферичного тонусу [4, 12, 13]. Демонстрація того, що порушення сигналізації ЛПС (тобто мишей TLR4 -/- або мишей CD14 -/-) захищає від ожиріння, спричиненого дієтою, та метаболічних розладів сильно підтримує важливу роль, яку відіграє ЛПС у патофізіології цих розладів [12–15].
Сприйняття ліпідів кардинально змінилося від простої молекули енергетичного субстрату до біоактивної молекули, яка бере участь у багатьох фізіологічних процесах, зокрема завдяки появі ліпідомічного підходу [33]. Ліпіди визнані центральними медіаторами, що беруть участь у появі, розвитку та вирішенні запальних процесів [34, 35]. Ожиріння змінює ендогенні рівні кількох біоактивних сімейств ліпідів, таких як кераміди, фосфатидилхоліни та ендоканабіноїди [36–38]. У свою чергу, деякі біоактивні ліпіди надають або про-, або протизапальну дію під час ожиріння. Наприклад, кераміди матимуть прозапальну дію на печінку і поступово призведуть до інсулінорезистентності шляхом фальсифікації інсулінової сигналізації [6, 39, 40]. І навпаки, n − 3 поліненасичені жирні кислоти виявляють сприятливі ефекти, протидіючи індукованому HFD запаленню жирової тканини [41]. Тим не менше, потенційну участь інших ліпідів необхідно розглянути, щоб краще характеризувати запальний тонус, що виникає внаслідок ожиріння.
У цьому дослідженні ми поставили за мету охарактеризувати, у різні моменти часу та в різних регіонах ЦНС, запальний тонус, індукований HFD. Ми виявили, що залежно від області ЦНС HFD диференційовано впливає на запальний тонус. Тому ми дослідили, чи можуть зміни вмісту ліпідів ЦНС пояснити відмінності запального тонусу між регіонами ЦНС.
Методи
Тварини та дієти
Дев'ятитижневі самці мишей C57BL/6J (річка Чарльз) утримувались в контрольованому середовищі (12-годинний денний світловий цикл, вимкнення світла о 18:00, контрольована температура та вологість). Після прибуття їх випадковим чином розділили на 12 груп по вісім мишей у кожній (чотири миші/клітка) та акліматизували протягом 1 тижня. Потім шість із цих груп отримали безкоштовний доступ до стандартної дієти (AIN 93-M, Research Diets, New Brunswick, USA), а решта шість груп отримали безкоштовний доступ до HFD (D12492, Research Diets, New Brunswick, USA ). Детальніше про склад обох дієт див. У Додатковому файлі 1: Таблиця S1. Для цього експерименту ми евтаназували у кожну вибрану точку часу (тобто через 1, 2, 4, 6, 8 та 16 тижнів) одну групу зі стандартною дієтою та одну групу під HFD. Мишей знеболювали за допомогою ізофлурану після 6-годинного періоду голодування і жертвували вивихом шийки матки. Кору, мозочок та стовбур мозку ретельно та швидко відновлювали та швидко заморожували у рідкому азоті. Збирали та зважували різні депо жирової тканини (підшкірна жирова тканина (SAT), вісцеральна жирова тканина (VAT), епідидимальна жирова тканина (EAT) та коричнева жирова тканина (BAT)). Всі зібрані тканини зберігали при -80 ° C до подальшого аналізу.
Ми провели це дослідження відповідно до європейської рекомендації 2007/526/CE (яка була перетворена в бельгійський закон від 29 травня 2013 р.) Щодо захисту лабораторних тварин. Місцевий комітет з етики затвердив протокол дослідження (угода про дослідження 2010/UCL/MD/022; угода про лабораторію LA1230314).
Кількісна оцінка холестерину
Кількісний показник загального холестерину в плазмі крові, відповідно до вказівок виробника, проводився в порожнистій вені з використанням набору холестерину FS10 (DiaSys Diagnostic and Systems, Holzheim, Німеччина), який базується на ферментативній реакції в поєднанні зі спектрофотометричним виявленням кінцевого продукту.
Підготовка РНК та аналіз RT-qPCR
Загальну РНК з тканин екстрагували за допомогою реагенту TriPure (Рош, Базель, Швейцарія) відповідно до інструкцій виробника. кДНК синтезували за допомогою набору RT (Promega, GoScript ™ система зворотної транскрипції) з 1 мкг загальної РНК. qPCR проводили за допомогою приладу та програмного забезпечення StepOnePlus (Applied Biosystems, Фостер-Сіті, Каліфорнія, США). ПЛР-реакції проводили із застосуванням суміші SYBR Green (Promega, GoTaq® qPCR Master Mix). Ми вимірювали кожну пробу в двох примірниках під час одного циклу. Для ампліфікації використовувались наступні умови: початкова стадія витримки 10 хв при 95 ° C, потім 45 циклів, що складаються з денатурації при 95 ° C протягом 3 с, відпалу при 60 ° C протягом 26 с і розширення при 72 ° C для 10 с. Продукти аналізували, виконуючи криву плавлення в кінці реакції ПЛР. Дані нормалізуються до експресії РНК-посланника рибосомного білка L19 (RPL19) (мРНК) 60S [42]. Послідовності використовуваних праймерів наведені в таблиці 1.
Кількісне визначення ліпідів
Тканини (мозочок або кора) гомогенізували у воді (2,5 мл), а потім ліпіди екстрагували після підкислення у присутності внутрішніх стандартів, додаючи 10 мл хлороформу (CHCl3) та 5 мл метанолу (MeOH). Після енергійного перемішування та обробки ультразвуком зразки центрифугували і органічний шар відновлювали і сушили під потоком N2. Отримані ліпідні екстракти очищали твердофазною екстракцією з використанням діоксиду кремнію та елюювали сумішшю CHCl3 та MeOH. Отримані фракції ліпідів аналізували за допомогою ВЕРХ-МС, використовуючи мас-спектрометр LTQ-Orbitrap (ThermoFisher Scientific), з'єднаний із системою Accela HPLC (ThermoFisher Scientific). Поділ аналіту досягали за допомогою попередньої колонки C-18 Phenomenex та колонки Kinetex LC-18 (5 мкм, 4,6 × 150 мм) (Phenomenex).
Для лізофосфосфатидилхолінів, фосфатидилхолінів та сфінгомієлінів рухливі фази A та B складалися з MeOH-H2O 85:15 (v/v) і MeOH, відповідно, з 5 мМ CH3COONH4. Градієнт (0,25 мл/хв) був розроблений таким чином: перехід від 100% А до 100% В протягом 15 хв, а потім 100% В лінійно протягом 15 хв з наступним повторним збалансуванням при 100% А. Аналіти іонізували за допомогою джерела ESI, що працює в позитивному режимі.
Для інших лізофосфосфоліпідів, а також для фосфоліпідів і сульфатидів рухливі фази A і B складалися з MeOH-H2O-NH4OH 50: 50: 0,1 (v/v/v) та MeOH-NH4OH 100: 0,1 (v/v), відповідно. Градієнт (0,4 мл/хв) був розроблений наступним чином: перехід від 100% А до 100% В протягом 30 хв, після чого 100% В лінійно протягом 15 хв з наступним повторним збалансуванням при 100% А. Аналіти були іонізовані з використанням джерела ESI, що працює в негативному режимі.
Для N-ацилетаноламіни та кераміди, рухливі фази A і B складалися з MeOH-H2O-оцтової кислоти 75: 25: 0,1 (v/v/v) та MeOH-оцтова кислота 100: 0,1 (v/v), відповідно. Градієнт (0,4 мл/хв) був розроблений таким чином: перехід від 100% А до 100% В протягом 15 хв, за яким слідував 100% В лінійно протягом 45 хв з наступним повторним збалансуванням при 100% А. іонізований за допомогою джерела APCI, що працює в позитивному режимі. Сигнали ліпідів нормалізували, використовуючи сигнал, отриманий для відповідного внутрішнього стандарту. Ми використовували d4-PEA, 17: 1-лізофосфатидилінозитол, 17: 0-лізофосфатидилхолін, 17: 0-сульфатид, 17: 0-керамід, 17: 0-сфінгомієлін та 17: 0/17: 0-ПК. Дані представлені у вигляді збільшення в рази порівняно з рівнями, виявленими у контрольних мишей.
Імуногістологія
Первинна культура гліальних клітин та лікування
Кількісна оцінка запальних цитокінів у плазмі крові
Цітокіни плазми IL-1β, IL-10 та фактор некрозу пухлини α (TNFα) визначали кількісно за допомогою набору Bio-Plex Multiplex (Bio-Rad, Назарет, Бельгія) та вимірювали за допомогою технології Luminex (Bio-Plex 200; Bio- Rad), дотримуючись інструкцій виробника.
Статистичний аналіз
Усі дані представлені як середнє значення ± s.e.m. Статистичний аналіз проводили за допомогою GraphPad Prism версії 5.0 для Windows (Сан-Дієго, Каліфорнія). Ми використовували двосторонній Студентський т тест на неспарені значення для порівняння двох груп, і, коли це було доречно, ми використали тест Манна-Уітні для оцінки периферичного запалення. Ми використовували односторонню ANOVA з пост-тестом Бонферроні або тест Крускала-Уолліса з пост-тестом Данна між групою HFD та відповідною групою CTL (*P
Результати і обговорення
Характеристика фенотипу ожиріння
Ми спостерігали за вагою мишей для різних груп протягом усього дослідження. Вага тіла вже зростала через 4 дні годування HFD і постійно зростала з часом. І навпаки, миші контрольних груп істотно не набирали вагу (додатковий файл 2: Малюнок SI 1). Ми також зважували різні депо білої жирової тканини в кожну вибрану точку часу. З часом спостерігається стійке збільшення підшкірної (SAT), епідидимальної (EAT) та вісцеральної (VAT) жирової тканини (додатковий файл 2: Рисунок SI 2). Ми також вимірювали холестеринемію мишей найраніше (1 тиждень) та пізніше (16 тижнів). Ми виявили чітке збільшення для мишей, які отримували HFD, порівняно з відповідними контролями (додатковий файл 2: Рисунок SI 3a-b). У сукупності ці дані підтверджують обесогенні властивості дієти, що використовується.
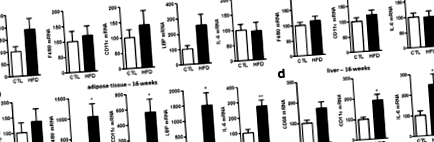
Периферичне запалення, спричинене годуванням HFD
Центральне запалення, спричинене годуванням HFD
Ожиріння є добре встановленим фактором, що сприяє збільшенню частоти периферичних патологій. Також добре продемонстровано, що ожиріння викликає запалення в гіпоталамусі [21, 22, 27]. Однак набагато менше відомо про вплив ожиріння на інші ділянки ЦНС. Ми вважали, що два регіони, мозочок та кора, представляють особливий інтерес, оскільки ожиріння викликає морфологічні зміни в цих двох областях. Дійсно, пацієнти з ожирінням демонструють відмінності в щільності сірої речовини в цих двох конкретних регіонах у порівнянні з худими суб'єктами [43, 44]. Ожиріння на ранніх стадіях також пов'язане з декількома аномаліями мозочка, такими як пошкодження нейронів, менший обсяг та порушення розвитку [45, 46]. Що стосується кори, то це область, відповідальна за когнітивний контроль споживання їжі [44, 47, 48]. Ці специфічні зміни можуть бути або причиною, або наслідком ожиріння та подальшим підтримкою порушення регуляції поведінки, орієнтованої на їжу.
Оскільки наслідки живлення HFD при запаленні явно відрізнялись у корі та мозочку, ми прагнули визначити, чи є цей знижений запальний тонус специфічним для кори. Таким чином, ми виміряли запальний тонус у стовбурі мозку на 1 та 16 тижнях і виявили підвищену експресію IL-1β, TNFα та MCP-1 в обох часових точках (Додатковий файл 2: Рисунок SI 4), a профіль, подібний до того, що спостерігається в мозочку. Таким чином, ці результати чітко свідчать про регіонально-залежні адаптації ЦНС до HFD.
Для пояснення цих спостережень ми спочатку оцінили експресію zonula occludens (ZO) -1, claudin 1 і 5 та occludin, чотирьох щільних сполучних білків гематоенцефалічного бар'єру [51, 52]. Дійсно, показано, що цілісність гематоенцефалічного бар’єру змінюється під час ожиріння [53]. Ми не виявили змін у експресії ZO-1 та клаудину 5 в корі або мозочку на 16-му тижні. Однак експресія клаудину 1 та оклюдину значно збільшилася в мозочку, тоді як на 16-му тижні не було виміряно змін у корі (додатково файл 2: Рисунок SI 5). Варто зазначити, що експресія мРНК цих білків демонструє постійні зміни з білками, виявленими за допомогою імуногістохімії [54].
Харчування HFD змінює рівень ліпідів у мозочку та корі на 16 тижні
Як згадувалось у вступі, ліпіди беруть участь у контролі запалення. Таким чином, ми вирішили провести широкий аналіз ліпідів, що знаходяться в корі та мозочку, зосередившись на 16 тижні, оскільки миші виявляли чіткий запальний тонус у цей конкретний момент часу. Ми вирішили зосередити свої дослідження на керамідах, дигідроцерамідах, сфінгомієлінах, сульфатидах та N-ацилетаноламіни, а також фосфоліпіди та лізофосфоліпіди, оскільки вони, як відомо, беруть участь у запаленні [60–64]. Визначені тут види керамідів та дигідроцерамідів у всьому світі не виявили змін у корі та мозочку. Що стосується видів сфінгомієліну, їх рівні були збільшені в корі і не мали змін у мозочку. Серед досліджених фосфоліпідів та лізофосфоліпідів ми виявили, що рівні фосфатидилінозитолів, фосфатидилетаноламінів та лізофосфатидилхолінів були підвищені в корі при годуванні HFD, тоді як HFD набагато менше впливав на їх рівень у корі. Зауважимо, ми також виявили, що рівні протизапальної пальмітоїлетаноламіду підвищувались у корі, але не в мозочку під час годування HFD (рис. 4 та додатковий файл 1: таблиця S2-4).
Масштабний скринінг ліпідів у мозочку (CBL) та корі (CTX) на 16-му тижні. Фосфоліпіди, лізофосфоліпіди, кераміди, сфінгомієліни, N-ацилетаноламіни, дигідроцераміди та сульфатиди вимірювали в корі та мозочку мишей CTL та HFD на 16 тижні за допомогою ВЕРХ-МС. Колір червоний являє собою збільшення рівня ліпідів у мишей HFD порівняно з мишами CTL. Колір зелений являє собою зниження рівня ліпідів у мишей HFD порівняно з мишами CTL. Числові дані представлені у додатковому файлі 1: Таблиця S2-4. ND не виявлено. Для фосфоліпідів вказується сума ацильних ланцюгів R1 та R2, тоді як для інших ліпідів згадується R ацильна ланцюг
Вплив ідентифікованих ліпідів на первинні спільно культивовані астроцити та мікроглію
Висновки
У цьому дослідженні ми показали, що периферичне запалення низького ступеня, індуковане ВЧС, не впливає однаково на різні області ЦНС і що цей запальний тонус також залежить від часу. У цій конкретній обстановці ми змогли визначити потенційну участь гліальних клітин і, точніше, астроцитів. Цікаво, що ці клітини запалення ЦНС також беруть участь у контролі проникності гематоенцефалічного бар’єру. У мозочку ми виявили активовані астроцити та підвищену експресію клаудину 1 та оклюдину. Ця підвищена експресія білків з щільним з'єднанням може бути потенційним механізмом, спрямованим на відновлення цілісності гематоенцефалічного бар'єру з метою зменшення запального порушення, що виявляється в цій області ЦНС. Ці зміни відсутні у корі, де запальний тонус був подібний до мишей, що годували чау. Ці висновки надалі підтверджують, що запальний тонус низького ступеня, що виникає в результаті СН, диференційовано впливає на дві специфічні області ЦНС.
Далі ми охарактеризували специфічне мікросередовище в цих двох областях ЦНС шляхом вимірювання рівня біоактивних ліпідів. Під час тестування на первинній спільній культурі мікроглії та астроцитів ми виявили фосфатидилінозитоли, лізофосфатидилхоліни та PEA як потенційні протизапальні сполуки, оскільки вони були збільшені в корі мишей HFD на 16 тижні, а також змогли зменшити експресію про- маркери запалення ex vivo. Це дослідження демонструє, що не всі регіони ЦНС рівні, коли вони стикаються із запальними образами, спричиненими ожирінням. Нарешті, ця робота відкриває шлях для подальших досліджень, спрямованих на вплив виявлених ліпідів як протизапальних сполук при ожирінні та інших запальних умовах, що впливають на ЦНС.
- Дієта з високим вмістом жиру сприяє метастазуванню раку, годуючи протеїни, що поширюють рак, Tech Tech Times
- Дієта з високим вмістом жиру порушує склад мікробіомів, викликає запалення при серцевій недостатності
- Дієта з високим вмістом жиру з використанням антибіотиків, пов’язана із запаленням кишечника EurekAlert! Новини науки
- Тривала дієта з високим вмістом жиру порушує обмін ліпідів і викликає запалення у дорослих щурів-самців
- Дієта з високим вмістом жиру у матері порушила одновуглецевий метаболічний процес та епігенетичну регуляцію в