Дієта з високим вмістом жиру, що розпочалася пубертально, сприяє пухлинному ставленню молочних залоз у схильних до ожиріння мишей FVB подібно до стійких до ожиріння мишей BALB/c 1
Іронг Чжу
Program Програма клітинної та молекулярної біології, Університет штату Мічиган, Східний Лансінг, Мічиган
† Програма дослідження раку молочної залози та навколишнього середовища, Університет штату Мічиган, Східний Лансінг, Мічиган
Марк Д. Ауперлі
† Програма дослідження раку молочної залози та навколишнього середовища, Університет штату Мічиган, Східний Лансінг, Мічиган
‡ Кафедра фізіології Мічиганського державного університету, Східний Лансінг, штат Мічиган
Сандра З. Хаслам
† Програма дослідження раку молочної залози та навколишнього середовища, Університет штату Мічиган, Східний Лансінг, Мічиган
‡ Кафедра фізіології Мічиганського державного університету, Східний Лансінг, штат Мічиган
Річард Шварц
† Програма дослідження раку молочної залози та навколишнього середовища, Університет штату Мічиган, Східний Лансінг, штат Мічиган
§ Кафедра мікробіології та молекулярної генетики, Університет штату Мічиган, Східний Лансінг, Мічиган
Анотація
Вступ
Матеріал та методи
Миші та дієти
Таблиця 1
| Жир | Кукурудзяна олія | 2,396 | 16.1498 |
| Сало | 1,8957 | 31,6537 | |
| Вуглеводи | Кукурудзяний крохмаль | 54.407 | 8,888 |
| Мальтодекстрин | 11.848 | 16.1498 | |
| Білок | Казеїн | 18.987 | 25,8397 |
| L-цистеїн | 0,2843 | 0,3876 | |
| Клітковина | Целюлоза | 4.7393 | 6,4599 |
| Вітаміни | Вітамінна суміш V10001 | 0,9479 | 1,2919 |
| Холін бітартрат | 0,1896 | 0,2584 | |
| Мінерали | Мінеральна суміш> S10026 | 0,9479 | 0,1286 |
| Фосфат діКальцію | 1,2322 | 1,6795 | |
| Карбонат кальцію | 0,5213 | 0,7106 | |
| Цитрат калію, 1 Н20 | 1,5639 | 2.1318 | |
| Енергія | |||
| ккал щільність/г. | 3.8 | 5.2 | |
| % ккал | Жир | 10 | 60 |
| Вуглеводи | 70 | 20 | |
| Білок | 20 | 20 | |
Туморогенез
3-тижневих мишей випадковим чином розподіляли до груп LFD та HFD (LFD, n = 60; HFD, n = 80). Починаючи з 5-тижневого віку, мишей обох груп обробляли перорально через один раз на тиждень протягом чотирьох тижнів 7,12-диметилбенз [а] антраценом (DMBA), розчиненим у рослинній олії (50 мг/кг маси тіла/миша). У 13-тижневому віці (10 тижнів на дієті) та у 19-тижневому віці (16 тижнів на дієті) від 3 до 5 мишей з кожної групи випадковим чином відбирали і жертвували на еструсі для вивчення ранніх наслідків HFD до розвитку пальпуються пухлини. Решта мишей пальпували два рази на тиждень для розвитку пухлини до кінця експерименту у віці 52 тижнів. Пухлини збирали з діаметром 1 см. Після закінчення частини пухлин та тканин молочної залози були або зафіксовані формаліном, і оброблені цілими кріпленнями [11], або вбудовані парафіни для фарбування гематоксиліном та еозином та імуногістохімії [12]. Цілісні препарати залоз та зрізи гематоксиліну та еозину оцінювали на загальну морфологію, наявність гіперплазії та неоплазії [13]. Усі ураження та пухлини були розглянуті та класифіковані, як описано раніше [14].
Аналіз цілого кріплення
Зафіксовані формаліном пахові молочні залози оцінювали подовжній ріст протоків, вимірюючи відстань між найдистальнішою кінцевою протокою та лімфатичним вузлом. Кінцеві ниркові кінці (TEB) визначали як збільшені багатошарові протокові кінчики діаметром більше 100 мкм, оточені адипоцитами і розташовані на периферії залози.
Імуногістохімія
Метаболічні параметри
Мишей голодували протягом 4 годин перед забором крові та жертвою. Для визначення рівня глюкози та інсуліну в плазмі крові проводили пункцію серця та запобігали коагуляцію за допомогою ЕДТА. Рівні глюкози в плазмі крові визначали OneTouch UltraMini (Lifescan, Milpitas, CA), а рівні інсуліну визначали за допомогою набору ELISA для інсуліну щурів/мишей (Millipore, Billerica, MA), відповідно до інструкцій виробника.
Статистичний аналіз
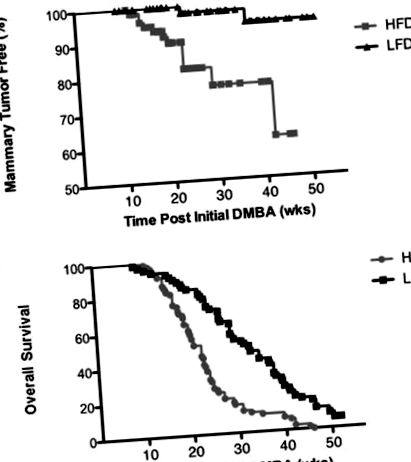
Результати представлені як середнє значення ± стандартне відхилення (SD) для маси тіла та середнє значення ± стандартна похибка середнього значення (SEM) для імуногістохімічних аналізів. Різниці вважалися суттєвими на рис. Більшість пухлин були негативними щодо ЕР та PR (2/2 пухлини ЛФД; 11/12 пухлини ХФД) (табл. 2). З двох пухлин, що розвинулись у мишей, що годувались LFD, одна була аденосквамозна, а друга - епітеліальної гістопатології. Половина пухлин HFD належала до епітеліальної гістопатології (6/12; залозиста, папілярна, крибриформна, тверда), а решта - аденосквамозних (4/12) та веретеновидно-клітинних (2/12) гістопатологій (табл. 2). HFD також сприяв розвитку пухлин в інших системах органів, виробляючи пухлини шкіри та печінки та лімфоми, що призвело до значно гіршого загального виживання (рис. 1 B).
Дієта з високим вмістом жиру сприяє туморогенезу молочної залози, спричиненому DMBA. (A) Ділянка Каплана – Мейєра показала, що кількість безпухлинних молочних залоз зменшується з часом більшою мірою на дієті з високим вмістом жиру (n = 70), ніж на дієті з низьким вмістом жиру (n = 50). (Б) Ділянка Каплана – Мейєра показала, що дієта з високим вмістом жиру зменшує загальну виживаність.
Таблиця 2
Властивості пухлин.
| М11 | HFD | 17 | Епітеліальний | ER−/PR- |
| М21 | HFD | 19 | Аденосквомозний | ER−/PR- |
| М45 | HFD | 19 | Аденосквомозний | ER−/PR- |
| М20 | HFD | 20 | Аденосквомозний | ER−/PR- |
| М27 | HFD | 22 | Епітеліальний | ER−/PR- |
| М72 | HFD | 24 | Епітеліальний | ER−/PR- |
| М26 | HFD | 25 | Аденосквомозний | ER−/PR- |
| М37 | HFD | 28 | Осередок шпинделя | ER−/PR- |
| М37 | HFD | 28 | Епітеліальний | ER−/PR- |
| М47 | HFD | 28 | Осередок шпинделя | ER +/PR+ |
| М80 | HFD | 34 | Епітеліальний | ER−/PR- |
| M84 | HFD | 47 | Епітеліальний | ER−/PR- |
| М46 | LFD | 28 | Аденосквомозний | ER−/PR- |
| М34 | LFD | 42 | Епітеліальний | ER−/PR- |
Пухлини, що розвинулись у мишей, яким годували HFD, мали середню латентність 25,9 ± 2,4 тижні порівняно з 35 тижнями для пухлин LFD. Крім того, існувала підмножина пухлин HFD, які розвинулися до самої ранньої пухлини у мишей, що годувались LFD (вік 28 тижнів) (Таблиця 2). У цій ранній підгрупі переважали аденосквамозні пухлини (4/6). Ранні пухлини мали середню латентність 20,9 ± 1,1 тижнів, а пізно розвиваються пухлини HFD мали середню латентність 33 ± 3,7 тижнів.
Раніше ми спостерігали, що HFD сприяє розвитку пухлини у мишей BALB/c за рахунок посиленої проліферації, ангіогенезу та вербування альтернативно активованих макрофагів М2 [7], [8]. Щоб визначити основу просування HFD пухлини в цьому дослідженні, пухлини аналізували на проліферацію, ангіогенез та вербування макрофагів. Пухлини, що розвинулись у FVB-мишей, які годували LFD та HFD, мали подібні рівні проліферації (HFD = 8,3 ± 1,0%, LFD = 8,7 ± 2,4%), ангіогенез (HFD = 16,2 ± 1,2%, LFD = 19,1 ± 4,6%) та подібні рівні загальних макрофагів у пухлинах (HFD = 31,8 ± 5,7, LFD 31 ± 18,4. Однак спостерігалася тенденція до збільшення кількості внутрішньопухлинних макрофагів M2 у пухлинах, що розвинулися на HFD (5,2 ± 1,5) порівняно з LFD (1,2 ± 0,4) (P = .24) (Рисунок 2).
Дієта з високим вмістом жиру виявила тенденцію до збільшення внутрішньопухлинних макрофагів М2, виміряних подвійним фарбуванням F4/80-Arg1 (P = .24). LFD (n = 2), HFD (n = 8).
HFD сприяє розвитку пубертатного протоку та проліферації епітеліальних клітин
Встановивши, що HFD сприяє розвитку канцерогенного пухлини, ми прагнули вивчити ранні ефекти HFD на розвиток молочних залоз. Вже через 1 тиждень дієти HFD збільшив кількість TEB, високопроліферативних структур, виявлених на кінчиках зростаючих проток під час статевого дозрівання (Малюнок 3 A). Після 2 тижнів дієти у мишей, що годувались HFD, спостерігалося посилене протокове подовження (рис. 3, В і С). До 3 тижнів на дієті ріст протоків у мишей, яких годували LFD та HFD, було неможливо відрізнити, з однаковим рівнем подовження протоки та кількістю TEB (рис. 3, A та B). До 4 тижнів на дієті дистальне протокове подовження досягло межі пахової жирової прокладки як для мишей, що годувались LFD, так і HFD, і кількість TEB зменшилася так само в обох групах.
Дієта з високим вмістом жиру сприяє розвитку пубертатного протоки та проліферації клітин епітелію. (А) Дієта з високим вмістом жиру збільшила кількість кінцевих нирок (ТЕБ) (*, P Рисунок 4). Прискорений розвиток молочних залоз у мишей, що харчуються HFD, не було результатом раннього настання статевого дозрівання, оскільки не було значущої різниці середнього віку вагінального отвору у мишей, що годували LFD та HFD (29,3 ± 1,8 днів та 29,6 ± 2,3 днів відповідно).
Миші, яких годували дієтою з високим вмістом жиру протягом 2 тижнів, виявляли посилену клітинну проліферацію в нормальних епітеліальних структурах, як вимірювали шляхом включення 5-бром-2′-дезоксиуридину (BrdU) (*, P, Малюнок 5 A). Аналіз проліферації через 10 тижнів на дієті показав збільшення проліферації при гіперпластичних ураженнях порівняно з нормальною тканиною як у мишей, що годувались LFD, так і з HFD, з тенденцією до більшої проліферації уражень на HFD (P = .14) (Малюнок 5 B). Великі протоки показали значне збільшення проліферації серед мишей, що харчуються HFD. Не було жодних харчових відмінностей у розповсюдженні між різними структурами молочних залоз та гіперплазіями на 16 тижні дієти або щільності кровоносних судин на 10 або 16 тижні дієти (дані не наведені).
- Nrf2 пригнічує FGF21 під час тривалого ожиріння, спричиненого дієтою, при мишачому діабеті
- Стійкість моделі цукрового діабету 2 типу, викликаної дієтичним годуванням з низьким вмістом жиру
- Нова дієта для примхи сприяє посту - модна дієта радить їсти що-небудь, а потім голодувати
- Вчені розкривають, як дієта з високим вмістом жиру сприяє росту раку прямої кишки
- Reddit - кетонаука - Періодична дієта, що імітує піст, сприяє багатосистемній регенерації,