Безглютенова дієта може поліпшити симптоми обструктивного апное уві сні у дітей з целіакією
Анотація
Передумови
Збільшені мигдалини та аденоїди є основною етіологією обструктивного апное сну у дітей. Лімфатична гіперплазія є загальною як для OSA, так і для целіакії. Ми мали на меті дослідити вплив безглютенової дієти на симптоми OSA у дітей з целіакією.
Методи
Діти з целіакією у віці 2–18 років були завербовані до початку безглютенової дієти. Діти з негативною серологією целіакії, яким проводили ендоскопію шлунково-кишкового тракту за іншими показаннями, служили контролем. Усі учасники заповнили перевірений опитувальник щодо симптомів OSA та опитувач дитячого сну (PSQ) на початковому етапі та через 6 місяців.
Результати
Тридцять чотири дитини з целіакією (середній вік 6,6 ± 3,5 року) та 24 особи контролю (середній вік 7,3 ± 4,6 року), P = 0,5) були набрані. При прийомі на роботу між цими двома групами не було значних відмінностей у статі, індексі маси тіла чи сезоні. Частота позитивних результатів PSQ була вищою (більше симптомів, пов’язаних з OSA) у контрольній групі порівняно з групою целіакією як при наборі, так і під час 6-місячного спостереження (33,3% проти 11,8%, P = 0,046, і 16,7% проти 0, P = 0,014 відповідно). Результати PSQ значно покращилися в обох групах за 6 місяців спостереження (P
Передумови
Целіакія - це хронічний імунно-опосередкований системний розлад, спричинений постійною чутливістю до глютену та пов’язаних з ним білків у генетично сприйнятливих осіб. Його поширеність становить приблизно 1% від загальної сукупності [1, 2]. Мезентеріальна лімфаденопатія є потенційною частиною клінічного перебігу целіакії, з вирішенням після введення безглютенової дієти [3, 4]. Целіакія також була пов'язана з синдромом кавітації мезентеріальних лімфатичних вузлів [5].
Синдром обструктивного апное сну (OSA) характеризується періодичними епізодами обструкції верхніх дихальних шляхів під час сну, пов’язаними з періодичною гіпоксією, гіперкапнією та фрагментацією сну [6]. Поширеність OSA у дітей досягає 3% у кількох епідеміологічних дослідженнях [7]. Пік захворюваності у дітей віком від 2 до 8 років [8]. Основною етіологією OSA у дітей є аденотонзилярна гіпертрофія [9, 10]. Крім того, у дітей з ОСА може спостерігатися гіпертрофія лімфоїдних тканин в інших областях дихальних шляхів, таких як глибокі шийні лімфатичні вузли [11, 12]. Недавні дослідження показали, що потенційною частиною патофізіології OSA є локалізоване запалення в області носоглотки, включаючи збільшення проліферації запальних клітин, особливо Т-клітинних лімфоцитів [13, 14].
Целіакія та OSA мають спільні риси лімфатичної гіперплазії та місцевого запалення. Нещодавнє дослідження Паризі та співавт. [15] показали підвищену поширеність порушення дихання у сну у хворих на целіакію із зменшенням симптомів при введенні безглютенової дієти. Розглядаючи спільну особливість лімфатичної гіперплазії/місцевого запалення при обох розладах, ми мали на меті дослідити поширеність OSA у дітей з целіакією та визначити вплив безглютенової дієти на симптоми OSA при целіакії.
Методи
Усі процедури дослідження були затверджені інституційною комісією з огляду Медичного центру Тель-Авіва (Гельсінський комітет), а також отримана поінформована згода батьків для всіх учасників.
Зразок та процедура
До складу дослідницької групи входили діти віком від 2 до 18 років, яким було діагностовано целіакію та були прийняті на роботу в період з грудня 2014 року по вересень 2015 року в педіатричне відділення гастроентерології в дитячій лікарні “Дана-Двек” Тель-Авівського медичного центру Сураскі. Усі пацієнти проходили набір після діагностики перед початком безглютенової дієти. Діагноз целіакії базувався на поєднанні симптомів, пов’язаних із целіакією, позитивної серології (рівень антиткантильної трансглутамінази [TTG]> 10,0 Од/мл) та характерної гістології за даними Європейського товариства дитячої гастроентерології, гепатології та Настанови з питань харчування (ESPGHAN) для діагностики целіакії [16]. Здорові діти, яким зробили ендоскопію верхніх відділів шлунково-кишкового тракту за іншими показаннями і у яких була задокументована негативна серологія целіакії протягом останніх 3 місяців та нормальна гістологія дванадцятипалої кишки служили контролем. Групи були підібрані за віком, статтю та сезоном направлення. Діти з вродженими аномаліями, затримкою розвитку або іншими хронічними захворюваннями були виключені, як і діти, які отримували медичне/хірургічне лікування OSA.
Заходи
Ми зібрали демографічні дані, включаючи вік та стать, історію хвороби, зріст, вагу та індекс маси тіла (ІМТ), клінічні симптоми, рівні анти-TTG на початковому рівні та через 6 місяців після початку безглютенової дієти, гістологічні дані та оцінки Марша. Також був розрахований показник ІМТ Z [17].
Дані та статистичний аналіз
Аналізи проводили за допомогою SPSS (версія 21.0; SPSS Inc., Чикаго, Іллінойс). Порівняння між групами ненормально розподілених безперервних параметрів (вік, ІМТ та показники PSQ) проводили за допомогою непараметричного тесту Вілкоксона. Порівняння між до та після втручання проводили з парними тестами. Усі повідомили P-значення були двосторонніми, статистична значимість встановлена на
Результати
Учасники
Тридцять чотири дитини з целіакією (середній вік 6,6 ± 3,5 року) та 24 особи контролю (середній вік 7,3 ± 4,6 року), P = 0,5) були включені. П'ятнадцять пацієнтів (44,1%) у групі целиакии і 14 пацієнтів (58,3%), P = 0,29) у контрольній групі були чоловіки. Не було суттєвої різниці в показниках ІМТ z між двома групами (Таблиця 1).
Целіакія симптоми
Основними симптомами у чревній групі були біль у животі та затримка росту (9 пацієнтів, 26,5% для обох симптомів), анемія (5 пацієнтів, 14,7%) та діарея (4 пацієнти, 11,7%). Серологію целіакії проводили в рамках скринінгу (родичі першого ступеня хворих на целіакію) у семи безсимптомних пацієнтів (20,5%). Середній рівень антитіл до TTG у групі целиакии на момент встановлення діагнозу становив 275 ± 34 ОД/мл (діапазон 17–800 ОД/мл) і 23 ± 23 ОД/мл (діапазон 0–76 ОД/мл) через 6 місяців після початку безглютенової дієти. Шістнадцять пацієнтів (47%) мали нормальний макроскопічний вигляд дванадцятипалої кишки, тоді як у 18 пацієнтів (53%) були макроскопічні дані, що відповідають целіакії, головним чином гребінню дванадцятипалої кишки. Гістологія дванадцятипалої кишки у всіх пацієнтів, крім одного, продемонструвала атрофію ворсинок, гіперплазію крипт та збільшену кількість інтраепітеліальних лімфоцитів, що відповідає целіакії Марша 3. У одного пацієнта були виявлені дані, що відповідають целіакії Марша 2.
Елементи управління
До контрольної групи увійшли 24 пацієнти. Дванадцять з них (50%) мали болі в животі при нормальній гістології шлунка, 4 (16,7%) мали хелікобактер пілорі-позитивний гастрит, 2 (8,3%) мали хелікобактер пілорі-негативний гастрит, 3 (12,5%) мали блювоту (2 з висновками, що відповідають езофагіту, а 1 - із нормальною гістологією), а 3 (12,5%) - з відсутністю успіху (FTT) із нормальною гістологією. Усі пацієнти контрольної групи мали нормальний рівень анти-TTG, а також нормальну гістологію дванадцятипалої кишки.
Середній інтервал часу між двома PSQ становив 5,94 ± 1,25 місяців у групі целиакии і 5,95 ± 0,92 місяців у контрольній групі (P = 0,97). Більшість пацієнтів були завербовані та заповнили перший PSQ взимку (з листопада по березень 67,6 та 58,3% у целіакії та контрольній групі; P = 0,48), і завершив другий PSQ у незимній сезон (з квітня по жовтень, 79,4 та 75% у целіакії та контрольній групі, відповідно; P = 0,69).
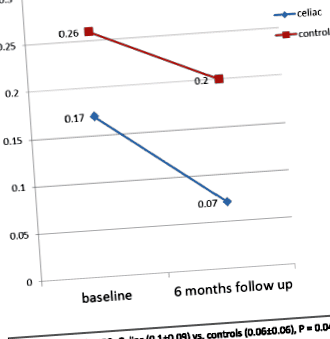
Частота позитивних результатів PSQ була вищою в контрольній групі порівняно з групою целіакією як на початку дослідження, так і під час спостереження. Чотири з 34 пацієнтів (11,8%) у групі целиакии і 8 з 24 пацієнтів (33,3%) у контрольній групі (P = 0,046) мали позитивний показник PSQ (≥0,33) на вихідному рівні. Через шість місяців жоден пацієнт у групі з целіакією та 4 з 24 (16,7%) пацієнтів у контрольній групі не мали позитивного показника PSQ (P = 0,014).
Загальні показники PSQ були значно нижчими у групі целиакии порівняно з контролем як на початковому рівні, так і під час 6-місячного спостереження. Під шкала PSQ (шкала хропіння та неуважності та гіперактивності) також була значно вищою для контролів порівняно з групою целіакії як на початковому, так і під час спостереження (Таблиця 2).
Як показано на рис. 1, загальний бал PSQ значно покращився в обох групах за 6-місячне спостереження порівняно з базовим рівнем (P Рис. 1
Середній загальний бал опитувальників дитячого сну (PSQ) на початку та на 6-місячному спостереженні
Лінійний регресійний аналіз з PSQ2 як залежною змінною та груповим призначенням (целіакія проти контролю), віком, BMI z шкалою та сезоном як незалежними змінними показав, що лише групове призначення було важливим предиктором для оцінки PSQ2 (Стор
Обговорення
Це перше перспективне контрольоване дослідження, яке досліджувало поширеність симптомів OSA у дітей з целіакією та вплив безглютенової дієти на ці симптоми. У цій когорті дітей показник ненормальних показників PSQ, що є переліком симптомів для дитячого ВОС, був значно нижчим серед дітей із целіакією порівняно з контролем за віком та статтю. Показники PSQ були нижчими в групі целиакии порівняно з контролем, тоді як покращення показників PSQ було виявлено в обох групах через 6 місяців, і вони були ще більшими в групі целиакии. Наші висновки протиставляються висновкам Паризі та ін. [15], який продемонстрував підвищену поширеність порушення дихання у сні у хворих на целіакію. Однак у їх дослідженні використовувався інший інструмент для оцінки сну та обсягу вибірки (n = 19) був меншим порівняно з цим у цьому дослідженні.
Загальний бал PSQ і рівень аномальних показників PSQ були значно нижчими у групі целиакии порівняно з контролем як на початковому рівні, так і під час спостереження. Як субскала хропіння, так і субскала уваги/поведінки були нижчими в групі целиакии порівняно з контролем. Ці відмінності не можна пояснити віком, ІМТ або сезоном оцінки, оскільки між цими параметрами між цими параметрами не було відмінностей. Одним із можливих пояснень цих висновків є збільшення поширеності симптомів OSA у контрольній групі через фактори, які не були виміряні в поточному дослідженні, такі як недоношеність, атопічні захворювання, куріння батьків або сімейний анамнез OSA. Однак ми припускаємо, що такі фактори могли б вплинути на обидві групи.
Поліпшення показників PSQ в обох групах під час 6-місячного спостереження може пояснюватися природною історією OSA, яка, як правило, покращується з віком. Дійсно, віковий діапазон нашої когорти знаходиться до верхньої межі пікової захворюваності на ОСА у дітей. Можливо, у деяких дітей протягом цього 6-місячного періоду спостерігалися покращення або навіть зникнення симптомів ОСА. Інше пояснення - зміна сезону. Більшість наших учасників були набрані взимку, і тому їх подальша оцінка проводилась навесні/влітку. Як було показано в попередніх звітах, симптоми OSA можуть змінюватися залежно від сезону, а зима зазвичай асоціюється з погіршенням симптомів OSA [21,22,23].
Хоча в нашому дослідженні показники PSQ були нижчими для групи целіакії, ступінь поліпшення симптомів, пов'язаних з OSA, була значно вищою для цих дітей у порівнянні з контролем. Цей висновок свідчить про те, що безглютенова дієта може зіграти певну роль у цьому поліпшенні, оскільки між цими двома групами не було різниці в часовому інтервалі чи сезонності. Цей висновок узгоджується з висновком Паризі та ін. [15], який також продемонстрував розлад дихання зі сном за допомогою безглютенової дієти. Потенційним поясненням цього висновку є поліпшення лімфатичної гіперплазії, яке асоціюється із целіакією та яке сприяє OSA у цих пацієнтів. Значне покращення рівня OSA у хворих на целіакію після встановлення безглютенової дієти піднімає питання про те, чи може безглютенова дієта покращити симптоми OSA у дітей із целіакією і, таким чином, служити допоміжною терапією для OSA або навіть замінити адетонтонсілектомію як першу лінію лікування ВСА для цих дітей.
Наше дослідження засноване на добре встановленому інструменті для виявлення симптомів OSA у дитячої популяції. Це перше перспективне контрольоване дослідження, яке продемонструвало можливу користь від безглютенової дієти на OSA у дітей з целіакією. Однак результати цього дослідження слід інтерпретувати в контексті кількох обмежень. По-перше, наші дані базуються на опитувальнику, а не на об’єктивних показниках OSA, таких як полісомнографія. По-друге, ми не оцінювали розмір аденоїдів та мигдалин. Крім того, контрольна група порівняно невелика через виключення пацієнтів із хронічними захворюваннями, але результати, отримані в цій когорті, все ж досягли рівня значущості. Більше того, у трьох пацієнтів контрольної групи був ФТТ, що саме є потенційним проявом OSA. Ми вирішили включити цих трьох пацієнтів у дослідження, оскільки вони мали аналогічні показники PSQ, як у контрольної групи. Більше того, як зазначалося раніше, аналіз даних після виключення цих трьох пацієнтів не змінив результатів дослідження.
Підводячи підсумок, у дітей з целіакією було виявлено менше симптомів, пов’язаних з OSA, але ступінь поліпшення стану після введення безглютенової дієти була значно вищою у групі целіакії порівняно з контролем. Отримані нами дані свідчать про те, що безглютенова дієта може покращити симптоми, пов’язані з ОСА, у дітей з целіакією. Потрібні подальші дослідження, щоб визначити, чи може дієта без глютену зменшити потребу в аденоїдектомії та/або тонзилектомії у дітей з целіакією та ОСА.
Висновки
Діти з целіакією мали менше симптомів, пов'язаних з OSA, ніж контролі, але ступінь поліпшення стану після введення безглютенової дієти була значно вищою. Ці результати свідчать про те, що безглютенова дієта може покращити симптоми, пов'язані з ОСА, у дітей з целіакією.
- Ефективність безглютенової дієти лише при одужанні від залізодефіцитної анемії у дорослих хворих на целіакію
- Дієта без глютену набирає популярності, незважаючи на відсутність зростання целіакії
- Дієта без глютену від дітей; s Національні діти; s Національний
- Дорослі діти, хворі на целіакію, впливали лише на кілька років на безглютенову дієту в дитинстві -
- Безглютенова дієта - нова стратегія лікування болючих симптомів ендометріозу PubMed