Антоціани з їстівних плодів Eugenia brasiliensis як потенційні терапевтичні засоби для лікування ХОЗЛ
Гема Флорес
† Департамент біологічних наук, Леманський коледж та випускний центр, Міський університет Нью-Йорка, 250 Bedford Park Boulevard West, Бронкс, Нью-Йорк 10468, Сполучені Штати Америки
§ Instituto de Fermentaciones Industriales, Consejo Superior de Investigaciones Científicas (CSIC), c/Juan de la Cierva 3, 28006 Мадрид, Іспанія
Кейван Дастмалчі
† Департамент біологічних наук, Леманський коледж та випускний центр, Міський університет Нью-Йорка, 250 Bedford Park Boulevard West, Бронкс, Нью-Йорк 10468, Сполучені Штати Америки
Стурлейні Пауліно
† Департамент біологічних наук, Леманський коледж та випускний центр, Міський університет Нью-Йорка, 250 Bedford Park Boulevard West, Бронкс, Нью-Йорк 10468, Сполучені Штати Америки
Кетлін Уелен
† Департамент біологічних наук, Леманський коледж та випускний центр, Міський університет Нью-Йорка, 250 Bedford Park Boulevard West, Бронкс, Нью-Йорк 10468, Сполучені Штати Америки
‡ Медичний факультет, Коледж лікарів та хірургів, Колумбійський університет, 630 W, 168th Street, P&S 9-449, Нью-Йорк, Нью-Йорк 10032, Сполучені Штати Америки
Абдулайе Дж. Дабо
‡ Медичний факультет Коледжу лікарів та хірургів Колумбійського університету, 630 Вт, 168-а вулиця, P&S 9-449, Нью-Йорк, Нью-Йорк 10032, Сполучені Штати Америки
Курт А. Рейнертсон
† Департамент біологічних наук, Леманський коледж та випускний центр, Міський університет Нью-Йорка, 250 Bedford Park Boulevard West, Бронкс, Нью-Йорк 10468, Сполучені Штати Америки
Роберт Ф. Фороньї
‡ Медичний факультет, Коледж лікарів та хірургів, Колумбійський університет, 630 W, 168th Street, P&S 9-449, Нью-Йорк, Нью-Йорк 10032, Сполучені Штати Америки
Жанін М. Д Арміенто
‡ Медичний факультет, Коледж лікарів та хірургів, Колумбійський університет, 630 W, 168th Street, P&S 9-449, Нью-Йорк, Нью-Йорк 10032, Сполучені Штати Америки
Едвард Дж. Кеннеллі
† Департамент біологічних наук, Леманський коледж та випускний центр, Міський університет Нью-Йорка, 250 Bedford Park Boulevard West, Бронкс, Нью-Йорк 10468, Сполучені Штати Америки
Анотація
Дев'ять антоціанів (1-9) з їстівних плодів Eugenia brasiliensis були ідентифіковані за допомогою ВЕРХ-PDA та LC-MS, і сім з них вперше описані в цьому бразильському фрукті. Два основних антоціани, дельфінідин (8) і ціанідин (9), вивчали їх інгібуючу активність щодо виробництва хемокіну інтерлейкіну-8 (IL-8) до та після обробки клітин сигаретним димним екстрактом (CSE). У необроблених клітинах кількість IL-8 не змінювалося після обробки ціанідином та дельфінідином у концентраціях 0,1–10 М. Обидва дельфінідини (8) і ціанідин (9) зменшила продукцію IL-8 у оброблених клітинах, при 1 М та 10 М, відповідно. Дельфінідин (8) продемонстрував інгібування IL-8 у клітинах, оброблених CSE, залежно від дози.
1. Вступ
На додаток до своєї ролі рослинних вторинних метаболітів, антоціани привернули увагу як функціональні пігменти в харчових барвниках (He & Giusti, 2010). Інтерес до антоціанів посилився в останні роки через їх можливу користь для здоров'я як дієтичних антиоксидантів (Leiris J. & Martin, 2008). Численні дослідження показали, що вони можуть мати позитивний вплив на здоров'я людини (Lila, 2004). Антоціани володіють широким спектром біологічної активності, включаючи протизапальну активність (Longo & Vasapollo, 2006), зниження ризику розвитку ішемічної хвороби серця (Basu, Rhone & Lyons, 2010), вазопротекторні ефекти (Bell & Gochenaur, 2006), цитотоксичність (Shin et al., 2009), протидіабетичні ефекти (Nizamutdinova et al., 2009) та профілактика дисфункції адипоцитів, що призводить до ожиріння (Wei et al., 2011). Деякі позитивні ефекти антоціанів можуть бути пов'язані з їх сильною антиоксидантною активністю, як було продемонстровано в дослідженнях in vitro та in vivo (Tsoyi et al., 2008).
Кілька дослідників в останні роки вказували на роль дієти у профілактиці ХОЗЛ (Keranis et al., 2010). Епідеміологічні дослідження показали, що споживання фруктів та овочів у зворотному відношенні до захворюваності на низку захворювань, включаючи рак та ХОЗЛ (Stan, Kar, Stoner & Singh, 2008). Gauliard et al. (2008) виявили, що фракція малинового соку, збагачена антоціанами, може бути корисною для лікування ХОЗЛ. Ми припускаємо, що фітохімікати, як і антоціани, можуть бути корисними для лікування ХОЗЛ. На цьому шляху в патенті нашої лабораторії ми запропонували два антоціани - ціанідин-3-глюкозид та дельфінідин-3-глюкозид як нові перспективні методи лікування ХОЗЛ (D’Armiento, Reynertson, Kennelly & Wallace, 2008). В рамках нашого постійного дослідження антиоксидантних сполук із тропічних фруктів, що мають терапевтичну дію на ХОЗЛ, була досліджена E. brasiliensis (Dastmalchi, Flores, Petrova, Pedraza-Penalosa & Kennelly; Flores, 2011; Reynertson et al., 2006). Основне завдання цього дослідження полягає у виявленні антоціанів у цій рослині та вивченні їх потенційних переваг для лікування ХОЗЛ.
Eugenia brasiliensis Lamarck, широко відоме як "груміксама" або бразильська вишня, - це дерево з прибережних бразильських лісів, яке належить до роду Eugenia з сімейства Myrtaceae. Це один з найбільших родів родини Myrtaceae і налічує близько 350 видів (Fischer, Limberger, Henriques & Moreno, 2005). Декілька видів Євгенії вирощують для отримання їстівних плодів, а інші використовують у народній медицині. Традиційно листя, плоди та кора деревини E. brasiliensis є в’яжучим, сечогінним засобом і приймаються для лікування ревматизму (Revilla, 2002). Петровський та ін. (2008) повідомили про пригнічення набряку вух гідроалкогольного екстракту, фракцій та сполук, виділених з E. brasiliensis, у відповідь на місцеве нанесення олії кротону на вухо миші.
Плоди E. brasiliensis бузково-червоного кольору, характерні для плодів, багатих антоціанами. Раніше ми повідомляли про наявність ціанідин-3-глюкозиду та дельфінідин-3-глюкозиду в цій рослині (Reynertson, Yang, Jiang, Basile & Kennelly, 2008). Однак антоціановий склад E. brasiliensis більше не повідомляється в літературі. Для перевірки потенційного терапевтичного ефекту основних антоціанів, виявлених на ХОЗЛ, їх оцінювали на інгібуючу активність IL-8 в клітинах епітелію малих дихальних шляхів людини (SAE) до та після лікування CSE.
2. Матеріали та методи
2.1. Загальні експериментальні процедури
Для колонкової хроматографії використовували Sephadex LH-20 (25–100 мкм) (Pharmacia Fine Chemicals, Piscataway, Нью-Джерсі, США). Аналізи ТШХ проводили на пластинах RP-18 F254 (товщина шару 200–270 мкм, EMD Chemicals Inc., Гіббстаун, Нью-Джерсі, США), із сполуками, візуалізованими шляхом розпилення розчином ваніліну (1,0 г ваніліну в 10 мл концентрованого H2SO4 і 90 мл EtOH). Розчинники для хроматографії, ВЕРХ-клас MeOH, мурашина кислота та ацетонітрил були отримані від J.T. Бейкер (Філіпсбург, Нью-Джерсі, США). MeOH класу GR, етилацетат та н-бутанол постачали VWR Inc. (Bridgeport, PA, США). Ультрачисту воду готували за допомогою системи Millipore Milli-RO 12 plus (Millipore Corp., Бедфорд, Массачусетс, США).
Тролокс був придбаний у Sigma Chemical-Aldrich (Сент-Луїс, Міссурі, США). Сіль 2,2'-азинобіс (3-етилбензотіазолін-6-сульфонату) діаммонію (ABTS) була отримана від TCI-Ace (Токіо, Японія). Дельфінідин-3-глюкозид, ціанідин-3-глюкозид, ціанідин-3-арабінозид, мальвідин-3-глюкозид, дельфінідин та ціанідин постачаються компанією Chromadex (Irvine, CA, USA).
2.2. Рослинний матеріал
Плоди E. brasiliensis збирали у парку фруктів та спецій (Homestead, FL, США). Плоди заморожували та відправляли кур’єром на ніч на сухому льоду до лабораторії, де зберігали в холодному (−20 ° C) темному сховищі до обробки. Зразки ваучерів були підготовлені, ідентифіковані та здані на зберігання в Герборій Стір Нью-Йоркського ботанічного саду (Бронкс, Нью-Йорк, США).
2.3. Підготовка екстракційного розчинника
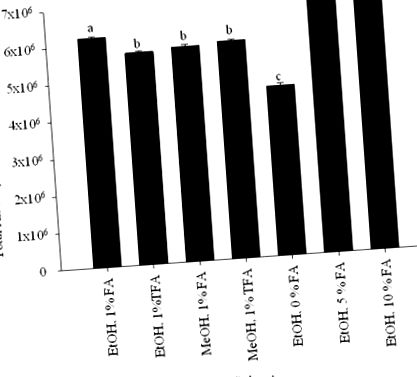
Вплив варіації розчинника на загальну екстракцію антоціану був оптимізований завдяки варіації трьох параметрів: типу органічного розчинника; тип кислоти; і кількість використаної кислоти. Суміш органічного розчинника/води/кислоти (70: 29: 1, об/об/об) розглядали для скринінгу, використовуючи MeOH та EtOH як органічні розчинники, а трифторуксусну кислоту та мурашину кислоту як кислоти. Концентрації кислоти, що перевіряються, включають 0, 1, 5 та 10 об’ємних частин.
2.4. Вилучення зразків
Антоціани Eugenia brasiliensis екстрагували три рази сумішшю EtOH/вода/мурашина кислота (70: 25: 5, об./Об.) При кімнатній температурі за допомогою блендера протягом 5 хв за екстракцію, і об'єднаний екстракт сушили у вакуумі. Екстракт суспендували у воді і послідовно тричі розподіляли етилацетатом, а потім н-бутанолом. Об'єднані етилацетатні та н-бутанолові перегородки сушили у вакуумі та аналізували за допомогою ВЕРХ.
2.5. Фракціонування
Перегородку н-бутанолу, збагачену антоціанами, фракціонували над колоною Sephadex LH-20 з використанням MeOH (0,1% мурашиної кислоти) в якості елюентів і збирали 39 фракцій. Ці фракції об'єднували у сім на основі аналізу ТШХ RP-18 (70:30 H2O, 5% мурашина кислота/ацетонітрил). Всі фракції аналізували за допомогою ВЕРХ і тестували в аналізі ABTS. Фракцію 4, що містить антоціани, аналізували за допомогою LC-TOF, і ідентифікували дев’ять антоціанів.
2.6. ВЕРХ-КПК
Для збору та обробки даних була використана система рідинної хроматографії A Waters (Мілфорд, штат Массачусетс, США), оснащена модулем розділення 2695 та детектором фотодіодного масиву 2996 (PAD), з'єднаним з Waters Empower (версія 5.0). Розділення проводили на колонці Synergi Hydro-RP 80A розміром 250 × 4,6 мм, 4 мкм (Торранс, Каліфорнія, США). Розчинники елюції А (1% водний розчин мурашиної кислоти) та В (ацетонітрил) застосовували наступним чином: швидкість потоку, 1 мл/хв; ізократичний 95% В протягом 10 хв, від 95–90% протягом 6 хв, від 90–85% протягом 10 хв і від 85–75% протягом 15 хв. Потім композицію змінювали до початкового стану через 5 хв і витримували протягом 10 хв. Антоціани виявляли шляхом контролю елюції при 520 нм.
2.7. LC-MS аналізи антоціанів
Мас-спектрометрія з електророзпилювальною іонізацією високої роздільної здатності (HR-ESI-MS) проводилася за допомогою мас-спектрометра LCT Premier XE TOF (Waters, Manifold, MA, USA), оснащеного ESI-інтерфейсом і керованого програмним забезпеченням MassLynx V4.1. Мас-спектри отримували як в позитивному, так і в негативному режимі в діапазоні m/z 100–1000. Напруги капілярів встановлювали на рівні 3000 В (позитивний режим) та 2800 В (негативний режим) відповідно, а напруга конуса становила 20 В. Газовий азот використовували як для небулайзера, так і для його розчинення. Швидкість десольвації та конусоподібного газу становила 600 та 20 л/год відповідно. Температура розчинення становила 400 ° C, а температура джерела - 120 ° C. Використовуваною аналітичною колонкою була колонка розміром 250 × 4,6 мм, 4 мкм Synergi Hydro-RP 80A (Торранс, Каліфорнія, США). Застосовували той самий розчинник для елюції та спосіб, що і описаний вище для ВЕРХ-PDA.
2.8. Аналіз ABTS
Антиоксидантну активність перегородок етилацетату та н-бутанолу та фракцій вимірювали за допомогою аналізу ABTS • + (Re et al., 1999). Використовували зчитувач мікропланшетів Molecular Devices Versamax (Саннівейл, Каліфорнія, США). Цей аналіз заснований на утворенні вільнорадикального катіону ABTS • + шляхом взаємодії водного розчину ABTS (7 мМ) з K2S2O8 (2,45 мМ, кінцева концентрація) при температурі навколишнього середовища в темряві протягом 12-16 годин. Перед використанням цей розчин розбавляли EtOH до поглинання 0,700 0,020 при 734 нм. У кінцевому об’ємі 200 л реакційна суміш скомпрометувала 198 л розчину ABTS • + і 2 л зразка при різних концентраціях. Поглинання при 734 нм вимірювали з інтервалом у 5 хв протягом 40 хв. Подібним чином реакційну суміш стандартної групи отримували змішуванням 198 л розчину ABTS • + та 2 л тролоксу. Знижуюча здатність ABTS виражалася як еквівалентна антиоксидантна здатність Trolox (TEAC, ммоль Trolox/г зразка) через різні інтервали часу. Кверцетин використовували як позитивний контроль.
2.9. Іммуноаналіз ІЛ-8
Людські клітини SAE культивували згідно з інструкціями постачальника (Lonza, Walkersville, MD, США) та підтримували в контрольованій атмосфері повітря 5% СО2 при 37 ° C. Для експериментів використовували 80% зливних клітин SAE у проходах 2 - 5. CSE був підготовлений із використанням модифікованого протоколу (Laurent, Janoff & Kagan, 1983). Коротко кажучи, вакуумний насос Барнета, що працює при постійному потоці, використовувався для виділення диму однієї сигарети дослідницького класу 3R4F (Університет Кентуккі, Лексінгтон, США) через 25 мл сольового розчину, забуференного фосфатом Дульбекко. Цей розчин (100% CSE) доводили до рН 7,4, фільтрували, розводили невеликим середовищем росту дихальних шляхів до кінцевої концентрації 5% і негайно додавали до клітин.
Клітини обробляли 5% CSE або чистими сполуками або попередньо обробляли чистими сполуками за 1 год до 5% впливу CSE. Життєздатність клітин оцінювали після впливу CSE за допомогою набору alamarBlue (Invitrogen, Карлсбад, Каліфорнія, США) відповідно до технічних вимог виробника. Через 24 год вимірювання IL-8 людини в супернатантах культури клітин проводили методом ІФА (R&D Systems Inc., Міннеаполіс, Міннесота, США).
2.10. Статистичний аналіз
Дані виражаються як середні значення ± 95% довірчого інтервалу. Дисперсійний аналіз проводили методом одностороннього дисперсійного аналізу (ANOVA) із значними різницями середніх значень, визначених за допомогою t-критерію Стьюдента. Для статистичного аналізу використовувався пакет програмного забезпечення JMP Statistics версії 8 (SAS Institute Inc., NC).
3. Результати та обговорення
Ми ідентифікували дев'ять антоціанів з E. brasiliensis, і два основні компоненти антоціанів, знайдені в цій категорії, були протестовані на їх інгібування IL-8 у клітинах SAE до і після обробки CSE.
3.1. Вилучення антоціанів
Екстракційний розчинник для антоціанів був оптимізований для збільшення можливості виявлення антоціанів, що присутні в невеликих кількостях. Загальний вміст антоціану був апроксимований загальним підсумовуванням площ піків, що спостерігаються при 520 нм під час ВЕРХ-УФ-аналізу для оптимізації виявлення цих сполук.
Оптимізацію екстракції проводили з використанням MeOH та EtOH як органічних розчинників та трифтороцтової кислоти та мурашиної кислоти як кислот у суміші органічний розчинник/вода/кислота (70: 29: 1, об/об/об). Поєднання EtOH та мурашиної кислоти з водою забезпечило значну найбільшу загальну площу піку при 520 нм (рис. 1). РН екстракційного розчинника є фактором, що забезпечує відповідні умови екстракції антоціанів. Екстракція плодової м’якоті E. brasiliensis з концентрацією мурашиної кислоти 5 і 10% дає найвищий рівень антоціанів (рис. 1). Оскільки суттєвої різниці в загальній площі антоціану не виявлено, коли до розчинника додавали 5 або 10% мурашиної кислоти, або в кількості піків антоціану, 5% було обрано як концентрацію кислоти. Тому пульпу E. brasiliensis екстрагували EtOH/вода/мурашина кислота (70: 25: 5, об./Об.), А отриманий екстракт суспендували у воді і розподіляли етилацетатом та н-бутанолом. Перегородки етилацетату та н-бутанолу аналізували за допомогою ВЕРХ. Перегородку н-бутанолу, багату антоціаніном, розділяли над Sephadex LH-20, отримуючи сім фракцій. Кожну фракцію аналізували за допомогою ВЕРХ та оцінювали на їх антиоксидантну активність.
Загальний вміст антоціану при 520 нм E. brasiliensis проти системи розчинників, що використовується для екстракції. На основі цих результатів для екстракції E. brasiliensis була обрана суміш EtOH/вода/мурашина кислота (70: 25: 5, об./Об.). Дані представлені у вигляді середніх значень ± 95% меж довіри (n = 3). Стовпчики з однаковими малими літерами (a – d) суттєво не відрізняються (P> 0,05).
3.2. ВЕРХ-КПК
Сім фракцій, отриманих від E. brasiliensis, аналізували за допомогою ВЕРХ-PDA і контролювали при 520 нм. Фракція 4 виявилася збагаченою антоціанами (рис. 2) і тому була обрана для композиційного аналізу.
- Біополімер з їстівних морських безхребетних Потенційне функціональне харчування - ScienceDirect
- Поведінкове лікування ожиріння у пацієнтів із синдромом Прадера-Віллі SpringerLink
- Новий спосіб підвищити привабливість фруктів та овочів - комунікації щодо їжі та здоров’я
- Нове лікування хворобливого викривлення пеніса - The New York Times
- Бехчет; s Лікування хвороби, поради щодо способу життя та причини