Аналог оксинтомодуліну збільшує витрати енергії через рецептор глюкагону
Анотація
Гормон кишечника оксинтомодулін (ОХМ) спричиняє втрату ваги, зменшуючи апетит та збільшуючи витрати енергії. Для лікування ожиріння розробляється кілька аналогів. Однак, як саме працює оксинтомодулін, залишається суперечливим. OXM може активувати як рецептори глюкагону, так і GLP-1, але конкретних рецепторів не виявлено. Вважається, що аноректичний ефект виникає переважно через активацію рецепторів GLP-1, але на сьогоднішній день офіційно не підтверджено, який рецептор відповідає за збільшені витрати енергії.
Ми розробили OX-SR, аналог OXM з пролонгованим випуском. Це призводить до значного і стійкого збільшення витрат енергії у щурів, виміряних непрямою калориметрією. Тепер ми показуємо, що це збільшення витрат енергії відбувається за рахунок активації рецептора глюкагону. Блокада рецептора GLP-1 за допомогою Exendin 9–39 не блокує збільшення споживання кисню, спричиненого OX-SR. Однак, коли активність рецептора глюкагону втрачається, витрати енергії не збільшуються. Тому активність рецепторів глюкагону, як видається, є суттєвою для впливу OX-SR на витрати енергії. Розробка майбутніх аналогів «подвійних агоністів» потребуватиме ретельного збалансування діяльності GLP-1 та рецепторів глюкагону для отримання оптимальних ефектів.
1. Вступ
Оксинтомодулін (OXM) - це 37 амінокислотний пептид, що продукується нейроендокринними L-клітинами клубової кишки. Він складається з 29 амінокислот глюкагону плюс октапептидний хвіст. Наразі жодного конкретного рецептора OXM не виявлено. OXM дійсно активує рецептор глюкагону, хоча і менш сильно, ніж нативний глюкагон, завдяки октапептидному хвосту. Той самий хвіст дозволяє OXM активувати рецептор GLP-1, але також менш сильно, ніж природний GLP-1 [1], [2], [3], [4]. Крім того, октапептидний хвіст уповільнює очищення OXM від кровообігу порівняно з глюкагоном [5]. OXM продукується дією субтилізину/кексину типу 1 пропротеїну конвертази PCSK1 на пептид проглукагону. OXM секретується з кишечника разом з GLP-1 у відповідь на споживання поживних речовин. Як і GLP-1, OXM є інкретином, безпосередньо викликаючи вивільнення інсуліну з клітин островів підшлункової залози.
Усі доступні на сьогодні способи лікування ожиріння - дієтичні, фармакологічні та хірургічні - зменшують споживання їжі. Однак початкова втрата ваги через зменшення споживання їжі пов'язана з падінням енергетичних витрат, що обмежує загальну втрату ваги [6], [7], [8]. І навпаки, стани, де збільшуються енергетичні витрати, такі як тиреотоксикоз або вплив холоду, супроводжуються компенсаторною гіперфагією, яка має подібний обмежуючий ефект на втрату ваги [9], [10]. Короткотермінові дослідження показують, що введення екзогенного ОХМ може зменшити масу тіла людини [4], [5]. Ефективність OXM, порівняно з іншими методами лікування ожиріння, зумовлена його здатністю як зменшувати споживання їжі, так і збільшувати енергетичні витрати. Впливаючи на обидві сторони рівняння енергетичного балансу, OXM пропонує засоби для ефективного та стійкого схуднення.
Механізм, що лежить в основі аноректичного ефекту ОХМ, добре відомий. Він централізовано опосередковується за допомогою активації рецепторів GLP-1, підтвердженої як фармакологічною блокадою рецептора GLP-1, так і за допомогою нокаутованих мишей рецептора GLP-1 [2], [11], [12]. Однак механізм, за допомогою якого він збільшує витрати енергії, залишається суперечливим, і як рецептори глюкагону, так і GLP-1 причетні.
Невизначеності щодо того, який рецептор збільшує витрати енергії, сприяє складність безпосереднього вимірювання ефекту витрат енергії від OXM. У згаданих вище дослідженнях використовуються сурогатні маркери витрат енергії: порівняння втрати ваги із споживанням їжі або активності симпатичного нерва при НДТ. Дійсно, жодні дослідження на сьогоднішній день не показали збільшення споживання кисню після введення OXM. Це не було пояснено повністю, але може відображати відносну нечутливість більшості метаболічних клітин [16], поєднану з коротким періодом напіввиведення OXM, що вимагає багаторазових щоденних ін'єкцій OXM. Значне збільшення витрат енергії у гризунів було виміряно безпосередньо за допомогою декількох різних аналогів OXM [17], [18], [19]. Відтворюваність цих результатів додає достовірності думці про те, що OXM впливає на витрати енергії.
Аналоги все частіше використовуються для дослідження фізіології пептидних гормонів, оскільки маніпуляції з природними пептидами можуть збільшити період напіввиведення та ефективність гормонів [17], [19]. Ми розробили аналог OXM з тривалим випуском, OX-SR. Це відрізняється від нативного OXM на 5 амінокислот між залишками 16 і 27. Ці зміни дозволяють OX-SR утворювати підшкірне депо, дозволяючи вводити як одну добову підшкірну ін’єкцію. Ми безпосередньо виміряли витрати енергії, спричинені цим аналогом у метаболічних клітинах, і порівняли це з ефектами інгібування як рецепторів глюкагону, так і GLP-1. Тому нам вдалося ефективно визначити відносний внесок цих рецепторів у вплив витрат енергії на OXM.
2. Методи
2.1. Пептиди
OX-SR та OX-SR-Glu3 були синтезовані компанією Insight Biotechnology Ltd. (Middlesex, Великобританія) з використанням методології твердофазного пептидного синтезу (SPPS) та очищені за допомогою фази препаративної ВЕРХ із зворотною фазою. Чистота пептидів була більше 95%. Протягом усього часу OX-SR та OX-SR-Glu3 вводили у розчиннику на основі цинку. Оксинтомодулін, GLP-1, глюкагон та екзендін 9–39 були придбані у компанії Bachem (Бубендорф, Швейцарія). OX-SR-Glu3 має ту саму пептидну структуру, що і аналог OXM тривалої дії OX-SR, із заміною глутамінової кислоти в положенні 3 для усунення активності пептиду на рецепторі глюкагону [6].
2.2. аналіз накопичення цАМФ
Клітини CHO-K1, які стабільно надмірно експресують людський рецептор глюкагону (hGCGr), були придбані у Invitrogen Life Technologies (Пейслі, Великобританія), тоді як клітини CHO, що надмірно експресують людський рецептор GLP-1, вироблялися вдома [7]. накопичення cAMP вимірювали за допомогою динамічного аналізу cAMP 2 (Cisbio Assays, Codolet, Франція), дотримуючись протоколу виробника.
2.3. Дослідження на тваринах
Усі проведені процедури з тваринами були схвалені Британським міністерством внутрішніх справ відповідно до Закону про тварини (наукові процедури) 1986 року (ліцензії на проекти 70/7236 та 70/7596). Всюди використовували самців щурів Wistar (Charles River, Margate, UK). Тварин оселили в середовищі з контрольованою температурою з освітленням 12:12 год: темний цикл, світло світиться о 07:30. Для встановлення витрат енергії була використана Комплексна лабораторна система моніторингу тварин (CLAMS - Columbus Instruments, Коламбус, Огайо). Тварин поміщають у метаболічні клітини, з постійним вимірюванням споживання кисню, вироблення вуглекислого газу, рухової активності, а також споживання їжі.
2.4. Фармакокінетичні дослідження
Внутрішньовенну фармакокінетику пептидів вимірювали, як описано раніше [20]. Коротше кажучи, кожен пептид вводили через катетер стегнової вени, введений в наркоз щура (n = 3). Пептиди вводили при концентрації 30 нмоль/мл і швидкості 0,3 мл/год. Регулярні проби брали з катетера яремної вени протягом 100 хв. Для визначення фармакокінетики після підшкірної ін’єкції щурам вводили одноразову підшкірну дозу, складену в цинку 1,4 мкмоль/кг пептиду. Зразки крові відбирали через заздалегідь визначені інтервали протягом 7 днів через венекцію хвоста. Рівні пептидів визначали за зразками крові за допомогою власної RIA [21], і встановлювали фармакокінетичні властивості.
2.5. Дослідження з подачею пари, щоб продемонструвати ефект витрати енергії OX-SR
Щурів рандомізували на три групи (n = 8) за масою тіла (в середньому 414 г). Контрольна та пептидна групи отримували щоденні ін’єкції SC транспортного засобу та OX-SR (40 нмоль/кг) протягом 3 днів о 0830, починаючи з 0-го дня. Група, що отримувала пару, отримувала щоденні ін’єкції фізіологічного розчину з 1-го дня, але споживання їжі було обмежено середнє споживання групи OX-SR протягом попередніх 24 годин. Споживання їжі та вага тіла вимірювали щодня о 08:30. Більш важкі тварини використовувались у дослідженні парного вигодовування порівняно з подальшими дослідженнями CLAMS, оскільки вони мали менші варіації в щоденному споживанні їжі, покращуючи якість дослідження, коли тварин годували означає споживання їжі групи лікування.
2.6. Вимірювання енергетичних витрат після гострого введення OX-SR в CLAMS
Таблиця 1
Порівняння фармакокінетичних та фармакодинамічних особливостей OXM, OX-SR та OX-SR-Glu3.
| накопичення цАМФ EC50 (нМ) на рецепторі глюкагону ± SEM [співвідношення порівняно з глюкагоном] | 3,46 ± 1,5 [7,8] | 2,17 ± 0,6 [4,8] | 20,8 ± 2,5 [46] |
| накопичення цАМФ EC50 (нМ) у рецепторі GLP-1 ± SEM [співвідношення порівняно з GLP-1] | 136,6 ± 29,1 [17] | 91,2 ± 16,1 [11] | 74,7 ± 31,5 [9,5] |
| Період напіввиведення після внутрішньовенного введення (хв) | 12.1 | 15.9 | |
| Час до досягнення пікової концентрації в плазмі після підшкірного введення (години) | 0,5 | 3 | |
| Час до невизначуваних рівнів у плазмі після підшкірного введення (дні) | 1 | 6 |
Подібним чином, у рецепторі GCG рівні EC50 OXM, OX-SR та OX-SR-Glu3 були вищими, ніж природні GCG. GCG був на 7,8 разів потужнішим, ніж OXM, на 4,8 x потужнішим, ніж OX-SR, і принаймні на 46 разів потужнішим, ніж OX-SR-Glu3.
Ці результати показують, що хоча OX-SR є менш потужним, ніж споріднені гормони як рецепторів глюкагону, так і GLP-1, він трохи потужніший, ніж OXM, на 1,59 x та 1,50 x відповідно.
Ці дані також демонструють, що існує мінімальна активація рецептора глюкагону OX-SR-Glu3, а також те, що OX-SR трохи менш потужний на рецептор GLP-1, ніж версія Glu3, що відповідає іншим дослідженням, що порівнюють аналоги OXM з перемикачем Glu3 [22].
3.2. Фармакокінетичні дослідження
Після внутрішньовенної інфузії розраховували, що період напіввиведення OXM та OX-SR у плазмі крові становив 12,1 та 15,9 хв відповідно. При введенні підшкірно OXM досягав пікової концентрації в плазмі через 30 хв і не виявлявся протягом 24 годин; на противагу цьому рівні OX-SR продовжували зростати до 3 год і залишались у цій концентрації протягом 24 год, перш ніж повільно падати протягом наступних 6 днів (Таблиця 1).
3.3. Дослідження з парним годуванням показує, що OX-SR збільшує витрати енергії
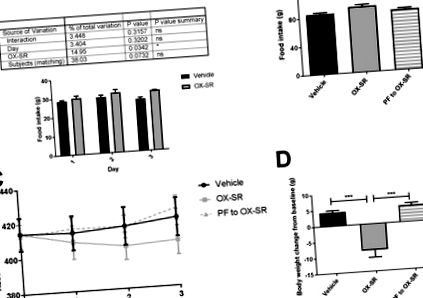
3-денне дослідження парного годування з використанням OX-SR. Щоденне споживання їжі (A), кумулятивне споживання їжі (B), щоденна абсолютна вага тіла (C) та остаточна зміна маси тіла від вихідного рівня (D) у самців щурів Wistar після 3 днів ін’єкцій транспортного засобу, OX-SR (40 нмоль/кг) або годування в парі до групи OX-SR. Їжу та масу тіла вимірювали щодня о 08:30. N = 8. Середня початкова маса тіла в кожній групі становила 414 г. Дані відображаються як середнє значення ± SEM. Статистичний аналіз, проведений із використанням двостороннього ANOVA для щоденного споживання їжі за допомогою тесту множинних порівнянь Сідака, та одностороннього ANOVA із пост-хок-тестами Тесту багаторазового порівняння Тукі для загального споживання їжі та зміни маси тіла, * p Рис. 2 A-B). Не було значної різниці в руховій активності між групами протягом періоду підвищених енергетичних витрат (рис. 2 F-G), що демонструє, що підвищена фізична активність не пояснює підвищених енергетичних витрат. Споживання їжі також було значно зменшене: воно зменшилось більш ніж на 60% протягом 12 годин після ін’єкції та на 40% через 24 години після ін’єкції (p Рис. 2 C). Коефіцієнт дихального обміну значно зменшився за допомогою OX-SR з 0,96 до 0,90 протягом 12 год після введення пептиду (p Рис. 2 E). Протягом 24 год зміна маси тіла суттєво різнилась між двома групами; група транспортних засобів набрала в середньому 7 г маси тіла (2,6% від базової лінії), а група OX-SR втратила 2,6 г маси тіла (1% від базової лінії) (p Рис. 2 D). Така втрата ваги пов’язана зі зменшенням споживання їжі та збільшенням витрат енергії.
Вплив блокади рецепторів GLP-1 на ефекти енергетичних витрат OX-SR. Споживання кисню протягом 12 годин (A), споживання їжі протягом 24 годин (B), зміна маси тіла протягом 24 годин (C), середнє значення RER протягом 12 годин (D) та загальна рухова активність протягом 12 годин (E) після ін’єкції транспортного засобу або OX-SR (40 нмоль/кг) у щурів, одноразово розміщених у клітинах з метаболізмом CLAMS. Раніше щурам імплантували підшкірні міні-осмотичні насоси, що містять фізіологічний розчин або EX9-39. Тварини мали вільний доступ до стандартних лабораторних чау протягом усього часу. N = 8. Дані, виражені як середнє значення ± SEM. Статистичний аналіз, проведений із використанням звичайного двостороннього ANOVA з тестом багаторазового порівняння Сідака.
3.6. Порівняння витрат енергії після введення OX-SR та OX-SR-Glu3
Тоді як OX-SR збільшив споживання кисню на 8% протягом 12 годин порівняно з транспортним засобом (p Рис. 4 A). Це показало, що для збільшення витрат енергії для OX-SR потрібна активність рецепторів глюкагону. Примітно, що хоча OX-SR не суттєво впливав на споживання їжі, OX-SR-Glu3 пригнічував споживання їжі протягом 24 годин порівняно з транспортними засобами та групами OX-SR (рис. 4 B), що представляє потужний аноректичний ефект GLP-1 активація рецепторів. Група транспортних засобів отримала в середньому 4 г маси тіла за 24 год після підшкірної ін’єкції; як групи OX-SR, так і OX-SR-Glu3 набрали менше ваги, ніж контрольна група, причому різниця була значною між групами транспортних засобів та групами OX-SR-Glu3 (p Рис. 4 C). Ці результати свідчать про те, що зменшення споживання їжі гостріше впливає на масу тіла, ніж збільшення витрат енергії. Суттєвої різниці в руховій активності між групами не було. RER суттєво пригнічувався як у групах OX-SR, так і в групах OX-SR-Glu3 протягом 12 годин після ін’єкції пептиду (p Рис. 4 D).
- Активізуйте енергію та настрій BodyStart Огляд таблеток Keto Slimina - Storm Ventures Group
- Надайте останні рецепти для схуднення Найкращі здорові світи - енергія Фосетта
- Пожвавити енергію та настрій 🔊 Краплі для схуднення мл - CREA-RS
- Спіронолактон для схуднення чи справді працює гуру енергетики здоров’я
- Роль закусок в енергетичному балансі в підході до поведінки в біології The Journal of Nutrition Oxford Academic