Аберрантна регуляція нейронального нейронального кальцію при старінні та хворобі Альцгеймера
Анотація
1. Клітинний і молекулярний ландшафт мозку при хворобі Альцгеймера (AD)
Іншими ознаками Aβ- та тау-краєвидного ландшафту мозку AD є зменшення кількості синапсів та загибель нейронів. Існує кілька рядків доказів, які вказують на синапси як на місця, де нейродегенеративний процес починається з нашої ери. APP транспортується аксонально і накопичується в пресинаптичних терміналах, і дані свідчать про те, що Aβ виробляється у великій кількості в синаптичних терміналах [9,10]. Синапси особливо вразливі до дисфункції та постійних пошкоджень, спричинених Aβ, як було продемонстровано в електрофізіологічних експериментах, в яких вплив шматочків мозку на Aβ погіршує синаптичну пластичність [11,12], а також дослідження культивованих нейронів та ізольованих синаптичних терміналів, які показали, що Aβ може погіршити синаптичні мембранні транспортери іонів та глюкози, а також можуть порушити міохондріальну біоенергетику [13, 14]. Нещодавні дослідження високої роздільної здатності in vivo з двофотонною мікроскопією чітко продемонстрували тісну фізичну зв'язок між агрегатами Aβ та дегенерацією невритів та синапсів [15]. Крім того, Aβ погіршує транспорт аксонів, що може сприяти накопиченню Aβ у нейронах, дисфункції нейрональної мережі та транснейрональному поширенню нейродегенеративного процесу при AD [16, 17].
2. Старіння мозку I: окислювальний та метаболічний стрес компрометує обробку нейронів Ca 2+
Супутнє окислювальне пошкодження нейронів під час старіння мозку є прогресуючим порушенням функції мітохондрій. Візуалізаційні дослідження регіонального енергетичного метаболізму головного мозку у людей продемонстрували гіпометаболізм в гіпокампі та лобовій корі під час старіння, що передбачає подальший розвиток когнітивних порушень та БА [32,33]. Дослідження мітохондрій, виділених з мозку гризунів різного віку, дали докази того, що здатність мітохондрій генерувати АТФ порушується з плином віку і що мітохондрії зі старих клітин головного мозку виявляють збільшення опосередкованих вільними радикалами пошкоджень [34]. Порушення клітинного енергетичного обміну може зробити нейрони вразливими до екситотоксичних пошкоджень [35], особливо коли нейрони стикаються з додатковими стресами накопичення Aβ і тау [36].
Нейрони використовують багато однакових механізмів передачі сигналів Ca 2+ і відновлення трансмембранних градієнтів Ca 2+, як і інші типи клітин, включаючи: керовані напругою канали Ca 2+ і Ca 2+ -ATP-азу в плазматичній мембрані; рецептори різних лігандів, які зв’язані з гідролізом фосфоліпідів інозитолу та вивільненням Ca 2+ із IP3-чутливого ендоплазматичного ретикулума (ER) Ca 2+; ER-канали рецепторів ріанодину, які опосередковують викид Ca 2+, індукований Ca 2+; та системи поглинання та вивільнення Ca 2+ у мітохондріях (див. [37] та [38] для огляду). Крім того, нейрони також мають унікальні системи для локальної сигналізації Ca 2+ в синапсах, включаючи; пресинаптичні керовані напругою канали Ca 2+, зв’язані з апаратом синтезу мембрани синаптичної везикули [39]; постсинаптичні збудливі канали рецепторів глутамату, які коливаються або Na + (рецептори AMPA), або Ca 2+ (рецептори NMDA) [40,41]; і Ca 2+ -зв’язуючі білки [42].
Дослідження моделей культури тварин і клітин чітко показали, що здатність нейронів належним чином регулювати клітинний рівень Са 2+ і динаміку порушується як окислювальним стресом, так і порушенням клітинного енергетичного обміну [43]. Перекисне окислення ліпідів мембрани має особливо руйнівний ефект на гомеостаз Ca 2+ нейронів. Перекисне окислення ліпідів зазвичай відбувається, коли рівні клітинного супероксидного аніонного радикала та пероксиду водню підвищуються у присутності навіть незначних кількостей Fe 2+ або Cu +, що призводить до утворення гідроксильного радикала [23]. Гідроксильний радикал атакує подвійні зв’язки в ліпідах мембрани, утворюючи тим самим цілий ряд альдегідів. Альдегідний продукт перекисного окислення ліпідів 4-гідроксиноненал (HNE) може зіграти особливо помітну роль у порушенні нейронального гомеостазу Ca 2+ при старінні та БА через його здатність ковалентно модифікувати білки на залишках цистеїну, лізину та гістидину. На експериментальних моделях було продемонстровано, що HNE погіршує функцію принаймні 4 білків, які, як відомо, відіграють важливу роль у передачі сигналів Ca 2+ нейронів: плазматична мембрана Na +/K + -ATPase; плазматична мембрана Ca 2+ -ATPase; нейрональний транспортер глюкози GLUT3; напружені канали Ca 2+ [44–46]; і транспортер глутамату в астроцитах [47].
Зниження рівня АТФ і НАД +, основних енергетичних субстратів у нейронах, пов’язане з віковою когнітивною дисфункцією та АД. Ці енергетичні субстрати особливо важливі для функціонування та виживання нейронів, оскільки нейрони повинні споживати велику кількість енергії для швидкого відновлення градієнтів іонів після синаптичної активації та генерації потенціалу дії. Коли рівень клітинної енергії знижується в нейронах, що різко відбувається під час ішемічного інсульту і більш підступно під час старіння та при БА, внутрішньоклітинні рівні Са 2+ залишаються підвищеними в результаті тривалого надходження через глутамат- і напружено-змінені канали в поєднанні з порушення активності іонно-рухової АТФази [48–50]. Виснаження NAD + можна запобігти введенням нікотинаміду, тим самим дозволяючи нейронам підтримувати внутрішньоклітинний рівень Са 2+ на досить низькому рівні, щоб запобігти пошкодженню та смерті [51].
3. Старіючий мозок II: порушення можливостей запобігання та усунення клітинної шкоди
За яким механізмом (механізмами) фізичні вправи та обмеження дієтичної енергії захищають мозок від вікових когнітивних порушень та БА? Кілька досліджень показали, що фізичні вправи [62] та обмеження енергії [63,64] збільшують вироблення мозкового нейротрофічного фактора (BDNF). Це, ймовірно, сприяє сприятливому впливу фізичних вправ та обмеження енергії на пізнання, оскільки BDNF відіграє важливу роль у синаптичній пластичності та нейрогенезі, і BDNF може захищати нейрони від окисних та метаболічних порушень (див. [65, 66] для огляду). Обмеження дієтичної енергії, фізичні вправи та BDNF можуть захищати нейрони від дисфункції та смерті в експериментальних моделях, в яких пошкодження нейронів опосередковується Ca 2+, включаючи екситотоксичні напади, ішемічний інсульт та AD [60, 67–69]. Докази того, що сигналізація BDNF погіршується при АД, включають: зниження рівня мРНК і білка BDNF у вразливих регіонах мозку хворих на АД порівняно з віковими суб'єктами контролю [70]; негативний зв’язок між концентрацією BDNF у лікворі та когнітивною функцією у осіб похилого віку [71]; зниження рівня BDNF, пов’язаного зі станом агрегації Aβ у мозку, у трансгенних моделях мишей AD [72]; та Aβ погіршує ретроградний оборот/сигналізацію BDNF [73].
AD та інші основні вікові нейродегенеративні розлади включають аномальні внутрішньоклітинні накопичення білків, які дещо відрізняються серед порушень: тау та Aβ при AD, α-синуклеїн при хворобі Паркінсона та Huntingtin при хворобі Хантінгтона. Збільшення доказів свідчить про те, що порушені клітинні механізми «вивезення сміття» сприяють накопиченню аномальних білків. Дві основні системи вивезення сміття, протеасома та апарат для аутофагії/лізосоми, стають непрацездатними в AD [90, 91]. Надмірне підвищення рівня внутрішньоклітинного Са 2+ може погіршити функцію протеасом і аутофагію [92, 93], з одного боку, тоді як порушення активності протеасоми та аутофагії може призвести до порушення регуляції клітинного гомеостазу Са 2+ [94, 95], з іншого боку.
4. Порушення гомеостазу нейрону Ca 2+ амілоїдним β-пептидом
Дослідження зразків тканин головного мозку у пацієнтів з АД та тваринних моделей АД підтверджують роль порушення нейрональної (особливо синаптичної) регуляції Са 2+ у нейротоксичній дії Aβ. Повідомляється про докази гіперактивації кальпаїнів (Ca 2+ -залежних протеаз) у нейронах, що перенесли нейрофібрилярну дегенерацію при AD [105, 106]. Візуалізація відкладень Aβ та внутрішньоклітинних рівнів Ca 2+ у нейронах мозку мишей-мутантів APP дала переконливі докази того, що Aβ спричиняє відхилене підвищення рівня Ca 2+ у невритах [107]. Подальше дослідження забезпечило докази того, що активація Ca 2+ -залежної фосфатази кальциневрину опосередковує Aβ-індуковану втрату хребта та дендритну дегенерацію [108]. Повідомляється, що підвищення рівня Са 2+ через опосередковані рецепторами глутамату спричинює зміни тау, подібні до тих, що спостерігаються в нейрофібрилярних клубках [109], що вказує на ключову роль аберрантної нейронної регуляції Са 2+ у нейродегенеративному процесі при БА.
5. Секретована форма APP, отримана з α-секретази, стабілізує нейрональний гомеостаз кальцію
6. Мутації пресеніліну-1 та збурений ендоплазматичний ретикулум Ca 2+ при АД
Виявлено численні сім'ї, в яких переважно успадкований ранній початок розвитку АД викликаний помилковою мутацією гена пресеніліну-1 [118]. Уражені люди, як правило, стають симптоматичними, коли їм перебуває 40–50 років. Пресенілін-1 є ферментативним компонентом ферментного комплексу γ-секретази, який розщеплює АРР для генерування Aβ, а мутації пресеніліну-1, що викликають AD, збільшують продукцію Aβ 42 [119]. Мутації пресеніліну-1 можуть негативно впливати на нейрони, збільшуючи продукцію Aβ 42, який потім порушує регуляцію Ca 2+ нейронів, як описано у розділі 4 вище. Однак численні дані свідчать про те, що мутації презеніліну-1, що викликають АД, можуть порушити іншу функцію презеніліну-1, функції регулювання гомеостазу Ca 2+ ендоплазматичного ретикулума (ER).
Молекулярна основа порушеної обробки ER Ca 2+, спричиненої мутаціями пресеніліну-1, ще не встановлена, але останні результати свідчать про те, що принаймні деякі мутації призводять до втрати нормальної функції обробки Ca 2+ дикого типу пресенілін-1. Ту та ін. [132] повідомив, що пресенілін-1 дикого типу утворює канали витоку Са 2+ в мембрані ER, і що мутації пресеніліну-1 порушують цю запропоновану функцію пресеніліну-1. Останній висновок, здається, дає пояснення попереднім доказам того, що пул ER Ca 2+ аномально збільшений у нейронах, що експресують мутантний пресенілін-1. Інші дослідження надали докази того, що презенілін-1 взаємодіє з рецептором IP3 в ER і що мутації пресеніліну-1 змінюють активність клітинного рецептора з метою посилення його відкриття та вивільнення Ca 2+ з ER [133]. Результати електрофізіологічних записів струмів рецепторів IP3 в лімфобластах, отриманих від людей з мутаціями презеніліну-1, що викликають АД, або нейронами кори від мутантних мишей прееніліну-1 продемонстрували, що мутації пресеніліну-1 збільшують час перебування каналів рецепторів IP3 у відкритому стані. Режим серійної зйомки Ca 2+ [134].
7. Залучення мітохондріальних порушень до аберантного поводження з нейронами Ca 2+ при БА
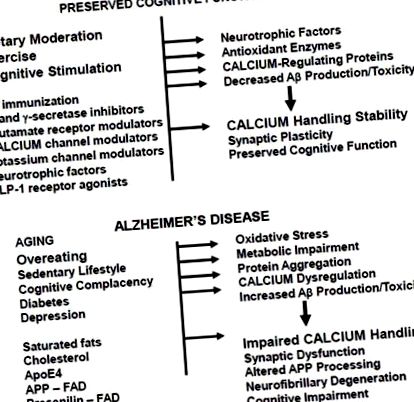
8. Висновки та наслідки для нових підходів до профілактики та лікування АД
Інгібітори холінестерази, які можуть забезпечити тимчасове поліпшення когнітивних функцій, є найбільш широко призначеним препаратом для хворих на АД. В даний час основна увага в програмах розробки лікарських препаратів у фармацевтичній промисловості та наукових колах спрямована на запобігання виробленню Aβ шляхом націлювання на γ- та β-секретази або підвищення кліренсу Aβ з використанням підходів до імунотерапії [8, 148]. На жаль, проте нещодавнє клінічне випробування фази III інгібітора γ-секретази не тільки не мало сприятливого ефекту, але натомість прискорило когнітивний спад у хворих на АД [149]. Випробування імунотерапії β також виявили розчарування важкими побічними ефектами у багатьох хворих на АД, які проходили активну імунізацію [150], і в недавньому дослідженні пасивної імунізації, в якому моноклональне антитіло до β вводили хворим на АД, не спостерігалося значного впливу антитіла до первинний аналіз ефективності [151].
Подяка
Ця стаття була написана як оригінальна оглядова стаття та не мала на меті бути всебічним оглядом. Тому ми вдячні тим науковцям, які зробили внесок у цю сферу досліджень, багато з яких цитуються в інших останніх оглядових статтях (див. Оглядові статті, цитовані нижче). Ця робота була підтримана Програмою внутрішніх досліджень Національного інституту старіння (NIH).
Виноски
Заява видавця: Це PDF-файл нередагованого рукопису, який прийнято до друку. Як послуга для наших клієнтів ми надаємо цю ранню версію рукопису. Рукопис пройде копіювання, набір версій та перегляд отриманого доказу, перш ніж він буде опублікований у остаточній формі. Зверніть увагу, що під час виробничого процесу можуть бути виявлені помилки, які можуть вплинути на вміст, і всі юридичні застереження, що стосуються журналу, стосуються.
- 28 порад, що засвоюються харчуванням для хворих на хворобу Альцгеймера
- Хвороба Альцгеймера 7 стадій хвороби
- Експериментальна кетогенна дієта при хворобі Альцгеймера була щільною та насиченою харчовими продуктами
- Кальцій у хронічних захворюваннях нирок Міфи та реалії Американське товариство нефрології
- Баланс кальцію при хронічній хворобі нирок