Осолений порошок Salicornia europaea та його активний компонент, трансферулова кислота, чинять ефекти ожиріння, пригнічуючи фактори, пов’язані з адипогенною хворобою.
Мд. Махбубур Рахман
дослідницький центр, KNOTUS Co. Ltd, Гурі-Сі, Кьонгі-До, Республіка Корея;
Мун-Джин Кім
дослідницький центр, KNOTUS Co. Ltd, Гурі-Сі, Кьонгі-До, Республіка Корея;
b Коледж ветеринарної медицини та Інститут ветеринарних наук Кангвонського національного університету, Чунчхон, Канвон, Республіка Корея;
Джин-Хен Кім
дослідницький центр, KNOTUS Co. Ltd, Гурі-Сі, Кьонгі-До, Республіка Корея;
Сок-Хо Кім
c Департамент досліджень біопродуктів, Knotus Life Science Inc, Jeongeup, Республіка Корея;
Хьон-Кю Го
дослідницький центр, KNOTUS Co. Ltd, Гурі-Сі, Кьонгі-До, Республіка Корея;
Мі-Хян Квеон
d Дослідницький центр, корпорація Phyto, Сеул, Республіка Корея
До-Хен Кім
дослідницький центр, KNOTUS Co. Ltd, Гурі-Сі, Кьонгі-До, Республіка Корея;
Анотація
Контекст:Показано, що Salicornia europaea (Amaranthaceae) (SE) зменшує ожиріння, але залишається проблемою як харчова добавка через високий вміст солі (25–35% NaCl).
Завдання: Це дослідження досліджувало ефекти ожиріння та механізм дії знесоленого порошку SE (DSP).
Матеріали і методи: Щурів Sprague – Dawley (n = 50) розділили на нормальну контрольну групу (NC), індуковану дієтою (HFD) групу контролю ожиріння (HFD) та групи HFD, яким спільно вводили DSP (250 та 500 мг/кг) або екстракту гарцинії камбоджійської (Clusiaceae) (GE, 200 мг/кг, стандартний контроль) перорально щодня протягом 12 тижнів.
Результати: Маса тіла була значно зменшена при одночасному застосуванні DSP (596,51 ± 19,84 кг, 4,60% та 562,08 ± 9,74 кг, 10,10% відповідно) та GE (576,00 ± 11,29 кг, 7,88%) щодо групи HFD (625,25 ± 14,02 кг) і супроводжувався зменшенням жирової маси в животі та рівнем ліпідів у сироватці крові, без впливу на споживання корму. Щоб знайти основний механізм проти ожиріння, трансферулова кислота (ТФК) була визначена головним інгредієнтом та досліджена щодо того, чи послаблює вона адипогенність у клітинах 3T3L-1. TFA, отриманий DSP, пригнічував диференціацію адипоцитів та накопичення внутрішньоклітинних ліпідів. TFA також регулює зниження експресії гена, пов'язаного з адипогенезом, білка 1, що зв'язує регулюючий елемент стеролу, активованого проліфератором пероксисоми рецептора γ, білка-α та посилювача CCAAT/енхансера та синтази жирних кислот.
Висновки: Ці висновки свідчать про те, що DSP можна розглядати для використання як харчову добавку з метою контролю ожиріння через його ожиріння та антиадипогенні властивості.
Вступ
Ожиріння пов'язане з низкою розладів здоров'я, включаючи дисліпідемію, діабет, серцево-судинні захворювання, захворювання жовчного міхура, цереброваскулярні захворювання, обструктивне апное сну, порушення менструального циклу та деякі типи раку (Haslam and James 2005). Це виникає внаслідок дисбалансу між споживанням та витратою енергії, що може призвести до патологічного зростання адипоцитів (Yuan and Piao 2011). Рівень ожиріння стрімко зростає і досягає тривожних рівнів у всьому світі через звички в сучасному способі життя, такі як фізична бездіяльність, сидіння на стільцях для роботи, перегляд телевізора та споживання калорій (Haslam and James 2005; Malik et al. 2013; Abid et al. 2016).
Адипогенез та диференціація адипоцитів важливі для ожиріння і включають складну послідовність змін у експресії генів та зберіганні ліпідів (Yuan and Piao 2011). Контроль адипогенезу або ожиріння є важливим для запобігання ускладнень та поліпшення здоров'я пацієнтів із ожирінням. В даний час ліки, доступні для лікування ожиріння, обіцяють короткочасну користь, однак ожиріння повертається після припинення прийому ліків. Більше того, ці ліки мають ряд побічних ефектів. Таким чином, нещодавні зусилля з додаткового лікування ожиріння були зосереджені на функціональних продуктах харчування та їх біоактивних сполуках (Hasani-Ranjbar et al. 2013; Ko et al. 2015; Pichiah and Cha 2015; Abid et al. 2016; Guo et al. 2016 ).
Гарцинія камбоджійська (Clusiaceae) - добре відома і популярна гіполіпідемічна рослинна рослина (Marquez et al. 2012; Vasques et al. 2014). Він легко доступний на ринках як харчова добавка і містить гідроксилимонну кислоту (HCA) як активну речовину. Це дослідження досліджує послаблюючий вплив DSP на збільшення маси тіла та ожиріння вісцерального апарату (загальний жир у животі, вісцеральний жир у черевній порожнині та підшкірно-жировий жир) у моделі ожирілих щурів у порівнянні з гарцинією камбоджійською. Щоб визначити основний механізм, який бере участь в ефекті ожиріння, трансферулова кислота (ТФК) була визначена за допомогою ВЕРХ-аналізу як найпоширеніший компонент у ЦСП, а також було досліджено, чи може ТФК, отримана з ЦСП, послабити адипогенність та адипогенні фактори у мишачих 3T3L-1адипоцитах.
Матеріали і методи
Підготовка дезінсольованої солевої солі (DSP) та аналіз компонентів DSP методом ВЕРХ
Свіже листя, гілки та стебла СЕ (20,0 кг) були зібрані із західного узбережжя Південної Кореї в кінці серпня 2015 р. Зразки були перевірені професором Сун-Ае Ю з Департаменту біології та медицини Пай Чай Університет (Теджон, Корея). Зразок ваучера був зданий у морозильну камеру, розташовану в науково-дослідному центрі корпорації Phyto (Сеульський національний університет, Південна Корея). Зразки очищали водопровідною водою та ліофілізували за допомогою морозильної сушарки (EYELA FDV-2200, Токіо, Японія). Ліофілізований СЕ подрібнювали за допомогою блендера (EBR98045, Стокгольм, Швеція), а порошкоподібний СЕ (3,6 кг) знесолювали екстракцією водою і центрифугували (Kim et al. 2016).
Гранули, отримані в результаті центрифугування, ліофілізували і подрібнювали у дрібнодисперсний порошок розміром менше 150 меш, використовуючи ультрацентробежний млин (ZM200, Hann, Німеччина). Отриманий DSP (2,4 кг) містив 74,3% харчових волокон, 9,1% білка, 4,3% жиру та 0,71% натрію (таблиця 1). Поживний аналіз DSP був проведений та сертифікований Корейською асоціацією медичних добавок (Bundang-gu, Gyeonggi-do, Республіка Корея). Коротко кажучи, загальний вміст вуглеводів розраховували як суму безводних цукрів, яку визначали за допомогою фенольно-сірчанокислого методу (Dubois et al. 1956). Загальний вміст білка визначали з використанням методу перетравлення білків/мікро-Кілдаля (Willis et al. 1996), тоді як вміст натрію та загальний вміст харчових волокон аналізували за допомогою індуктивно зв'язаної плазми (ICP) та ферментативно-гравіметричних методів, відповідно. Калорійність та інші другорядні компоненти визначали згідно з методами Асоціації офіційних аналітичних хіміків (AOAC) (Prosky et al. 1985).
Таблиця 1.
Хімічний склад порошку знесоленого Salicornia europaea (DSP).
| Калорійність | 224,89 Ккал/100г |
| Харчові волокна | 74,27% |
| Сирий білок | 9,13% |
| Сирий жир | 4,36% |
| Зола | 6,23% |
| Натрію | 0,71% |
| Сахарид | ND |
| Насичені жирні кислоти | 0,45% |
| Транс жирна кислота | > 0,01% |
| Холестерин | ND |
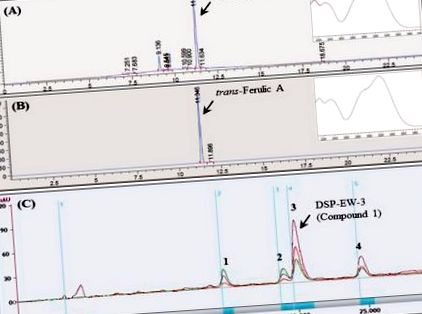
Порівнюючи час утримування ВЕРХ та λ-максимуми УФ-поглинання справжніх фенольних сполук (Sigma Co), основна сполука 1 був ідентифікований як трансферулова кислота (TFA) (рис. 1 (A, B)). Розчинний у метанолі DSP-EW (800 мг/мл) очищали багаторазовою препаративною ВЕРХ (LC-Forte, YMC, Кіото, Японія), оснащеною підготовчою колоною Triart C18 (20 × 250 мм, 5 мкм, YMC, Кіото, Японія) та градієнтний елюент MeOH та води з отриманням чистого TFA (DSP-EW-3, з'єднання 1, 128 мг) RT: 19,5–21,2 хв, а також інші незначні пікові сполуки також були визначені як кавова кислота, р- кумарова кислота та ізорамнетін-3-β- d -глюкозид (рис. 1 (С)). Для подальшої ідентифікації визначали молекулярну масу очищеного DSP-EW-3 (З'єднання 1) за допомогою ESI-MS. DSP-EW-3, розчинений у метанолі, іонізували методом розпилювальної іонізації (150 ∼ 2000 м/з), а спектри ESI-MS отримували на мас-спектрометрі LC-ESI (Thermo Finnigan LTQ, програмне забезпечення X-калібру, версія 2.1.0; Thermo Finnigan, Сан-Хосе, Каліфорнія, США) як з позитивним, так і з негативним режимами.
Аналітичні та препаративні ВЕРХ профілі знесоленого порошку Salicornia europaea L. (DSP). (A) Аналітичний профіль ВЕРХ DSP-EW; (B) аналітичний профіль ВЕРХ справжньої трансферулової кислоти; (C) Багаторазовий профіль підготовчої ВЕРХ DSP-EW; (1) кавова кислота; (2) р-кумарова кислота; (3) трансферулова кислота; (4) ізорамнетин-3-β- D -глюкозид.
Результати ESI-MS, m/z 195,2 [M + H] та m/z 193,4 [M-H], показали, що молекулярна маса сполуки 1, DSP-EW-3 був таким же, як у трансферулової кислоти (MW, 194, C10H10O4) (рис. 2). Легкодоступний екстракт гарцинії камбоджійської (GE) (Pure GARCINIA Cambogia ®, Fusion Diet Systems Inc., Sandy, UT), що містить 60% гідроксилимонної кислоти (HCA), використовували як позитивний контроль (200 мг/кг). Були відібрані вищі дози простого DSP (250, 500 мг/кг) порівняно з GE.
ESI-MS спектри DSP-EW-3 (з'єднання 1) (зверху, позитивний; знизу, негативний).
Тварини та експериментальний дизайн
Для цього дослідження були використані білі самці щурів Sprague – Dawley (Orient Bio, Gapyeong, Gyeonggi-do, Корея). Щурів утримували в контрольованому середовищі з температурою 23 ± 2 ° C і вологістю 50 ± 5% при 12-годинному циклі світло/темрява. До початку експерименту їжа та вода були доступні за бажанням. Через тиждень адаптивного годування середня маса тіла становила 222 ± 2 г. Ожиріння викликали за допомогою 60% дієти з високим вмістом жиру (HFD) протягом 12 тижнів, тоді як нормальній контрольній групі (NC) давали звичайну дієту. Щурів (n = 50) розподіляли порівну на п'ять груп: нормальний контроль (NC), оброблений фізіологічним розчином у збіжному обсязі, група HFD (модель з ожирінням щурів, що годувала HFD, група HFD + DSP-250 (спів- вводили DSP-250 мг/кг перорально щодня з HFD), групу HFD + DSP-500 (одноразовий DSP-500 mg/kg щодня перорально) та групу HFD + GE-200 (GE з одночасним введенням, 200 мг DSP та GE змішували з дистильованою водою та вводили (10 мл/кг маси тіла) свіжою шляхом перорального введення. Всі експериментальні протоколи були схвалені комісією з догляду за тваринами та використання KNOTUS Co. Ltd. Корея (Сертифікат номер: IACUC 16-KE-097).
Вимірювання жиру в животі у живих тварин
Неінвазивні параметри ожиріння черевної порожнини, такі як загальний жир на животі (TAF), вісцеральний жир на животі (VAF) та об’єм підшкірного черевного жиру (SAF), вимірювались у живих тварин за допомогою тривимірної мікро-комп’ютерної томографії (мікро-КТ). Вимірювання мікро-КТ проводили на Scanco Viva CT 80 (Scanco Medical AG, Бассерсдорф, Швейцарія) протягом 12 тижнів згідно з інструкціями виробника. Для сканування щурів знеболювали за допомогою 1% інгаляції ізофлурану та розміщували на спині обличчям вгору та головою вперед. Обидві задні кінцівки були витягнуті та закріплені на тримачі для зразка з кутом 90 ° між стегновою кісткою та хребтом з повністю витягнутими ногами.
Для кількісної оцінки вісцерального та підшкірного жиру ділянку між проксимальним кінцем поперекового хребця L1 і дистальним кінцем L6 сканували при ізотропному розмірі вокселя 18 мкм (енергія 70 кВп, інтенсивність 114 мкА, 31,9 мм FOV/діаметр, 200 мс час інтеграції). Вибір енергії сканування та розміру вокселя (приріст сканування) базувався на оптимізації часу сканування та деталей тканини та мінімізації впливу радіації відповідно до вказівок компанії. Кожен параметр був проаналізований за допомогою 3D-реконструкції мікро-КТ, створених за допомогою програмного забезпечення для обробки зображень (Scanco Medical, Bassersdorf, Швейцарія).
Вимірювання біохімічних показників сироватки крові
Приблизно 1 мл крові відбирали з яремної вени тварин за допомогою вакуаторних пробірок, що містять активатор згустку, через 8 тижнів та 12 тижнів після індукування ожиріння. Коагуляцію дозволяли здійснювати при кімнатній температурі приблизно від 15 до 20 хв, а потім сироватку відокремлювали центрифугуванням при 3000 об/хв протягом 10 хв і зберігали при -20 ° С до аналізу. Рівні тригліцеридів у сироватці крові (TG), загального холестерину (TC), ліпопротеїдів високої щільності (HDL) та ліпопротеїдів низької щільності (LDL) вимірювали за допомогою приладу Hitachi 7180 (Hitachi, Токіо, Японія). Рівень сироваткового рівня холестерину ліпопротеїдів дуже низької щільності (ЛПНЩ) розраховували за формулою: ЛПНЩ = TG/5 (Friedewald et al. 1972; Rahman et al. 2017). Атерогенний індекс (ШІ) є корисним інструментом для оцінки серцево-судинних розладів, пов’язаних з ліпідами сироватки крові, і вимірювався із використанням співвідношення TC/HDL (Grover et al. 1999; Rahman et al. 2017).
Культура клітин та диференціація адипоцитів
Попередні адипоцити мишей 3T3-L1 культивували при 37 ° C та вологості 95% з атмосферою 5% CO2 в модифікованому середовищі орела Дульбекко (DMEM) як живильне середовище разом з 10% плодової бичачої сироватки (FBS), 2 мл л -глютамін, 50 од/мл пеніциліну та 50 мкг/мл стрептоміцину, який інкубували протягом 3 днів для злиття. На цей момент (0-й день) середовище для диференціації (DM) (DMEM, що містить 10% FBS, 2 мл 1 -глутаміну, 50 од/мл пеніциліну, 50 мкг/мл стрептоміцину, 0,5 мМ IBMX, 1 мкМ дексаметазону та 1,7 мкМ інсуліну) додавали протягом 6 днів і змінювали з інтервалом у 3 дні. На шостий день середовище для диференціювання замінили індукційним середовищем (DMEM, що містить 10% FBS, 2 мл 1 -глутаміну, 50 од/мл пеніциліну, 50 мкг/мл стрептоміцину, 1,7 мкМ інсуліну). NC-середовище обробляли лише культуральним середовищем та середовищем для диференціювання та індукції (DMI). Решта груп отримували різні концентрації TFA разом із середовищем диференціювання та індукції (DMI +10, 50, 100, 500 мкМ TFA) між днями 0 та 9. Цитотоксичний ефект TFA на клітини 3T3-L1 оцінювали МТТ аналіз. Концентрації TFA становили 0–500 мкМ, і клітинна токсичність у цьому діапазоні не спостерігалась.
Аналіз тригліцеридів та фарбування олійно-червоного кольору
Для дослідження антиадипогенних ефектів DSP попередні адипоцити 3T3-L1 обробляли очищеним DSP TFA протягом 9 днів (дні від 0 до 9). Вплив TFA на індукцію маркерів кінцевої диференціації оцінювали в кінці диференціації (день 9). Для визначення вмісту клітинних ліпідів клітини збирали і лізували в буфері для лізису (25 мМ сахарози, 20 мМ трис-HCl, 1 мМ ЕДТА та 1 мМ ЕГТА). Вміст клітинних тригліцеридів вимірювали за допомогою комерційного набору для кількісного визначення тригліцеридів (Abcam, MA) відповідно до інструкцій виробника.
Накопичення ліпідів у цитоплазмі аналізували за допомогою набору для фарбування Oil Red O згідно із запропонованим виробником протоколом (Lifeline Cell Technology, Карлсбад, Каліфорнія). Забарвлені краплі ліпідів у клітинах переглядали та візуалізували за допомогою мікроскопа Observer A1 (Carl Zeiss, Єна, Німеччина) зі збільшенням 100 ×. Значення поглинання елюйованого розчину Олійного червоного О вимірювали в адипоцитарному рефлекторному накопиченні крапель ліпідів у цитоплазмі, а також вміст нейтральних ліпідів. Після фотографування забарвлений культуральний барвник, що утримувався в клітинах, елюювали ізопропанолом і кількісно визначали зі швидкістю поглинання 540 нм за допомогою багатопластинчастого зчитувального спектрофотометра (BioTek Instruments, VT).
Виділення РНК та ПТ-ПЛР у реальному часі
Вплив DSP на пов'язану з адипогенезом клітинну експресію факторів транскрипції SREBP1, PPAR-γ, C/EBPα та FAS досліджували в лізатах клітин 3T3L-1 за допомогою RT-PCR. Загальну клітинну РНК виділили з адипоцитів 3T3-L1, використовуючи простий синій набір (iNtRON, INC., Теджон, Корея), і використовували в режимі реального часу RT-PCR із використанням системи виявлення ПЛР CFX96TM в реальному часі (Bio-Rad Laboratories, Геркулес, Каліфорнія). Зворотну транскрипцію загальної РНК проводили з наборами зворотної транскрипції кДНК (Applied Biosystems, CA), і реакційна суміш містила 2 мкл матричної кДНК, 10 мкл 2 × SYBR Primix Ex Taq і 200 нМ праймерів у кінцевому обсязі. 20 мкл.
Реакції денатурували при 95 ° С протягом 30 с, а потім піддавали 45 циклам при 95 ° С протягом 5 с і 60 ° С протягом 20 с. Після завершення реакційного циклу температуру підвищували з 65 ° C до 95 ° C зі швидкістю 0,2 ° C/15 с. Флуоресценцію вимірювали кожні 5 с для побудови кривої плавлення. Контрольний зразок, який не містив матричної ДНК, запускали з кожним аналізом, і всі визначення проводили принаймні в двох примірниках для забезпечення відтворюваності. Справжність ампліфікованого продукту визначали шляхом аналізу кривої плавлення. Всі дані були проаналізовані за допомогою програмного забезпечення для аналізу Bio-Rad CFX Manager версії 2.1 (Bio-Rad Laboratories). Цільну кДНК ампліфікували за допомогою сенсорного праймера та антисмислових праймерів, як показано в таблиці 2 .
Таблиця 2.
Послідовності праймерів, використовувані для реального часу RT-PCR оцінки експресії генів.
- Диферелін Порошок для тривалого вивільнення для ін’єкцій
- Порівняння; Топ 7; Відгуки про сироватки гіалуронової кислоти
- Гліколева кислота та інші кислоти - Ірина Органічний догляд за шкірою
- Інженерний мікробний метаболізм жирних кислот для біопалива та біохімікатів - ScienceDirect
- Порошок екстракту виноградних кісточок UK bulk ™