Жир2 діє через регуляторний комплекс WAVE, щоб керувати колективною міграцією клітин під час обертання тканин
Анна Юлія Сквар
1 Інститут нейробіології Мюнстерського університету, 48149 Мюнстер, Німеччина
Клаус Брінкманн
1 Інститут нейробіології Мюнстерського університету, 48149 Мюнстер, Німеччина
Баою Чень
2 Кафедра біофізики та Медичний інститут Говарда Хьюза, Південно-західний медичний центр Техаського університету в Далласі, Даллас, штат Техас 75390
Тім Штейнбахер
3 Науково-дослідна група, пов’язана з інститутом “Клітинна адгезія та полярність клітин”, Мюнстерський університет, 48149 Мюнстер, Німеччина
4 Інститут медичної біохімії Мюнстерського університету, 48149 Мюнстер, Німеччина
5 Центр молекулярної біології запалення, Мюнстерський університет, 48149 Мюнстер, Німеччина
Клаус Ебнет
3 Дослідницька група, пов’язана з інститутом “Клітинна адгезія та полярність клітин”, Мюнстерський університет, 48149 Мюнстер, Німеччина
4 Інститут медичної біохімії Мюнстерського університету, 48149 Мюнстер, Німеччина
5 Центр молекулярної біології запалення, Мюнстерський університет, 48149 Мюнстер, Німеччина
Майкл К. Розен
2 Кафедра біофізики та Медичний інститут Говарда Хьюза, Південно-західний медичний центр Техаського університету в Далласі, Даллас, штат Техас 75390
Свен Богдан
1 Інститут нейробіології Мюнстерського університету, 48149 Мюнстер, Німеччина
Пов’язані дані
Анотація
Спрямовані рухи клітин під час морфогенезу вимагають скоординованої взаємодії між мембранними рецепторами та актиновим цитоскелетом. Регуляторний комплекс WAVE (WRE) є консервативним регулятором актину. Тут ми виявили, що нетиповий кадгерин Fat2 вербує WRC до базальних мембран триклітинних контактів, де утворюється новий тип плоскополяризованого батогоподібного виступу актину. Втрата функції Fat2 або її взаємодія з ВКР порушує триклітинні випинання і призводить до утворення неполяризованих філоподій. Ми надаємо додаткові докази молекулярної мережі, в якій рецептор тирозин фосфатази Длар взаємодіє з WRC, щоб зв’язати позаклітинний матрикс, мембрану та цитоскелет актину під час подовження яйцеклітини. Наші дані розкривають механізм, за допомогою якого інформація про полярність може передаватися від мембранного рецептора до ключового регулятора актину для контролю міграції колективних фолікулів під час подовження яйцеклітини. Візуалізація обертових ацинулів молочної залози MCF10A у прямому ефірі також наводить на думку про еволюційний збережений механізм, що керує обертальними рухами в епітеліальному морфогенезі.
Вступ
Колективні та спрямовані руху клітин необхідні для різноманітних процесів розвитку у тварин. Недавні досягнення у візуалізації живих зображень та умовах культивування ex vivo яєчників Drosophila melanogaster призвели до відкриття нового типу морфогенетичного руху, який керує подовженням яєць під час оогенезу мух (Haigo and Bilder, 2011; Bilder and Haigo, 2012). Подовжуючі фолікули, так звані яєчні камери, обертаються навколо своєї передньо-задньої осі (A-P) на початкових етапах оогенезу. Коли клітини фолікула мігрують навколо своєї окружної осі, вони створюють поляризовану ECM (Haigo and Bilder, 2011). Запропоновано планарно-поляризовану ECM як молекулярний корсет, який обмежує радіальне розширення та змушує подовжувати яйцеклітину (Haigo and Bilder, 2011; Bilder and Haigo, 2012). Як і ECM, базальний актиновий цитоскелет утворює корсет, що складається з паралельних пучків актину, вирівняних перпендикулярно осі A-P. Таким чином, терміни та орієнтація обертання фолікула збігаються з утворенням планарної поляризованої ECM та базального актинового цитоскелета.
Які молекули керують глобальним обертанням яєчної камери? Два останні дослідження розкрили важливу роль гомологічного верпроліну сімейства WASP, що активує комплекс Arp2/3, та його партнера по взаємодії Ena/стимульований вазодилататором фосфопротеїн (Ena/VASP) в подовженні яєчної камери, двох відомих ключових регуляторів актину, що сприяють одно- міграція клітин у різних системах (Cetera et al., 2014; Chen et al., 2014b). WAVE утворює гетеропентамерний комплекс, регуляторний комплекс WAVE (WRC), що включає білок Abelson, що взаємодіє Abi, Kette/Nap1, зокрема білок 1, пов'язаний з Rac1 (Sra-1), і клітину-попередника гемопоетичних стовбурів 300 (HSPC300; Eden et al., 2002; Chen et al., 2010). Втрата або WRC, або його збережена взаємодія з Ena у дрозофіли призводить до аномальної форми, круглих яєць (Cetera et al., 2014; Chen et al., 2014b). Мічення мембрани in vivo за допомогою пастки Neuroglian-GFP виявило, що клітини фолікула, що мігрують, утворюють мембранні виступи, що розширюються у напрямку обертального руху (Cetera et al., 2014). WAVE та Ena збагачені на кінчиках цих мембранних виступів, і запропоновано модель, в якій WAVE визначає протрузійний край кожної фолікулярної клітини, а WAVE-залежні ламеліподії керують колективною міграцією клітин фолікула (Cetera et al., 2014). Послідовно, РНК-опосередковане виснаження Abi у всіх клітинах фолікула повністю блокує обертання яєчної камери (Cetera et al., 2014).
Враховуючи порушений планарно-поляризований базальний актиновий цитоскелет у мутантах fat2/kugelei, було запропоновано, що Fat2 може контролювати альтернативний шлях PCP у клітинах фолікула (Bilder and Haigo, 2012). Дослідження локалізації з міченим GFP трансгеном надалі підтримують цю ідею (Viktorinová et al., 2009; Gates, 2012). Повідомляється, що трансген Fat2-GFP локалізується в триклітинних з’єднаннях в яєчних камерах, що розвиваються, до стадії 5, і одночасно із запропонованим початком обертання яєчної камери, Fat2 переміщується до відстаючого краю клітин (Viktorinová et al., 2009; Gates, 2012). Однак нещодавні аналізи живих знімків демонструють, що обертання яєчної камери починається набагато раніше, перш ніж може спостерігатися асиметрична локалізація Fat2-GFP (Cetera et al., 2014). Таким чином, релокалізація Fat2, здається, не є повчальним сигналом для спрямованої міграції клітин фолікула.
У клітинах ссавців найбільш схожий ортолог жиру ссавців (Fat1) локалізується на кінчиках мембранних виступів і контактів клітина-клітина, де він регулює сполучну динаміку актину та полярність клітин за допомогою білків Ena/VASP (Moeller et al., 2004; Tanoue and Такеїчі, 2004). Однак у цитоплазматичному хвості білка дрозофіли Fat2 відсутні всі три місця зв'язування EVH1, які опосередковують зв'язування Ena/VASP жиру ссавців Fat1, що припускає, що дрозофіла Fat2 може бути пов'язана з цитоскелетом актину альтернативним шляхом. Нещодавно ми описали новий механізм, який безпосередньо пов'язує WRC з різноманітними молекулами клітинної адгезії, іонними каналами та рецепторами, пов'язаними з G-білком (Chen et al., 2014a). Всі ці трансмембранні рецептори містять консервативний мотив пептиду, взаємодіючу рецепторну послідовність WRC (WIRS), яка безпосередньо пов'язує збережену поверхню взаємодії на WRC, утворену субодиницею Sra-1 та Abi (Chen et al., 2014a). У мух порушення зв’язуючої поверхні WIRS у Abi призводить до порушення орієнтації аксонів фоторецепторів, дефектної морфології яєць та часткової жіночої стерильності (Chen et al., 2014a). Тут ми ідентифікуємо атиповий кадгерин Fat2 як новий ліганд WIRS і досліджуємо молекулярний шлях, в якому Fat2 і Dlar діють через WRC для контролю міграції колективних клітин під час оогенезу дрозофіли.
Результати
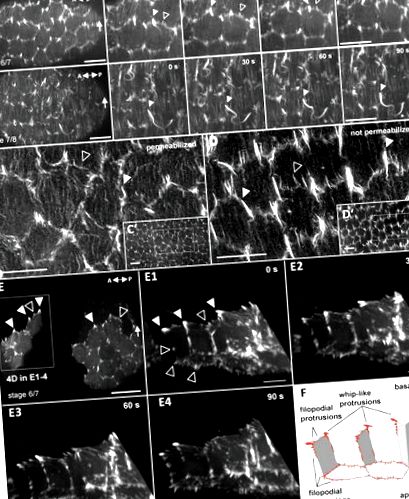
Клітини фолікула утворюють два різні типи багатих актином виступів, що стимулюють колективну міграцію клітин під час обертання яєчної камери
WRC накопичується в триклітинних контактах залежно від Fat2
- Докази змін у установці оптимального перекладу перекладу eIF4B, eIF4F та
- Кристали для схуднення; Цілющі кристали Купуйте кристали Кварцовий колектив
- Формула 1 запровадить нову мінімальну вагу водія в 2019 році
- Лінія вирізу на Кевіні Кіснера; ставка, Дастін Джонсон; їзди, і ще одне порушення PGA Tour наркотиків Golf
- Огляди клубу схуднення Focus, рейтинги центрів схуднення поблизу 5610 West Riverpark Drive, Sugar