Докази варіацій в комплексі ініціалізації оптимального перекладу: рослини eIF4B, eIF4F та eIF (iso) 4F диференціально сприяють трансляції мРНК 1, [OA]
Анотація
Ініціювання синтезу еукаріотичного білка вимагає численних факторів, щоб правильно зв’язати і розташувати мРНК на рибосомі 40S. Перш ніж взаємодіяти рибосома 40S і мРНК, група факторів ініціації еукаріотичного фактора ініціювання 4 (eIF4), eIF4A, eIF4B та eIF4F, функціонує в АТФ-залежному розмотуванні вторинної структури в 5 'нетранслируемой області (UTR) мРНК (для огляду див. Dever, 2002; Mathews, 2002; Sonenberg and Dever, 2003; Pestova et al., 2007; Gallie, 2007). eIF4A, одиничний поліпептид (приблизно 50 кД), є прототипом DEAD/H гелікази та має мотиви зв'язування АТФ та гелікази (для огляду див. Rogers et al., 2002). eIF4B - це РНК-зв’язуючий білок (приблизно 59 кД), який функціонує для посилення геліказної активності eIF4A та eIF4F (Bi et al., 2000; Rogers et al., 2001). Комплекс, що зв’язує кришку, eIF4F, складається з двох субодиниць, eIF4E (приблизно 24 кД) і eIF4G (приблизно 200 кД). eIF4E є білком, що зв'язує шапку, і eIF4G взаємодіє з кількома компонентами поступальної машини, включаючи eIF3, eIF4A та полі (А) зв'язуючий білок (PABP; для огляду див. Prévôt et al., 2003). Рослини мають другу форму eIF4F, eIF (iso) 4F, яка має подібну активність до eIF4F, але складається з генетично відмінних субодиниць eIF (iso) 4G (приблизно 86 кД) та eIF (iso) 4E (приблизно 24 кД; Браунінг, 1996).
eIF4B був виділений із ретикулоцитів кроликів (Trachsel et al., 1977; Benne and Hershey, 1978), дріжджів (Saccharomyces cerevisiae; Altmann et al., 1993; Coppolecchia et al., 1993), Drosophila melanogaster (Hernandez et al., 2004) та рослин (Browning et al., 1989; Metz et al., 1999). Він стимулює трансляцію мРНК, гідроліз АТФ та розмотувальну активність eIF4F та eIF4A (Grifo et al., 1983, 1984; Ray et al., 1985; Abramson et al., 1987, 1988a, 1988b; Browning et al., 1989; Rozen et al., 1990; Lorsch and Herschlag, 1998; Bi et al., 2000; Rogers, et al., 2001; Khan and Goss, 2005). eIF4B також відіграє роль у опосередкованому трансляції пікорнавірусної внутрішньої рибосоми (Meyer et al., 1995; Ochs et al., 1999, 2002; Rust et al., 1999), припиненні трансляції мРНК-господаря простого герпесу (Doepker та ін., 2004), та відновлення поліцистронної РНК вірусу мозаїки цвітної капусти (Park et al., 2004). eIF4B є мішенню для деградації під час апоптозу (Bushell et al., 2000). Такі звіти свідчать про важливу роль eIF4B у ініціюванні перекладу. Однак порушення єдиного гена дріжджів eIF4B не є смертельним. Це призводить до фенотипу, чутливого до холоду і повільно зростаючого (Altmann et al., 1993; Coppolecchia et al., 1993). Подібним чином, пригнічення РНК-інтерференції одного гена дрозофіли eIF4B свідчить про те, що eIF4B необхідний під час голодування, але не є важливим для виживання в оптимальних умовах (Hernandez et al., 2004). На відміну від інших факторів ініціювання, eIF4B погано зберігається у рослин, тварин та грибів на рівні амінокислотної послідовності. Таким чином, eIF4B, швидше за все, зберігається на рівні структури та/або функції.
Регіон, відповідальний за димеризацію in vitro пшениці з зв'язуванням eIF4B та РНК, розташований у кінці С білка і з'єднує два тандемних місця взаємодії eIF4A та PABP (Cheng et al., 2008). Часткова димеризація пшениці eIF4B in vitro стимулюється у присутності цинку (Cheng et al., 2008).
Як ссавці, так і пшениця eIF4B сильно фосфорильовані (Duncan and Hershey, 1985, 1989; Manzella et al., 1991; Gallie et al., 1997; Le et al., 1998, 2000), що свідчить про роль у регуляції синтезу білка. S6 кіназа та інші представники сімейства кіназ AGC фосфорилюють Ser-405 та/або Ser-422, два сайти, що реагують на сироватку у ссавців eIF4B (Raught et al., 2004; Shahbazian et al., 2006; van Gorp et al., 2009). Наразі невідомо, чи існують подібні сайти на заводі eIF4B. У рослинах eIF4B взаємодіє з PABP (Le et al., 1997, 2000; Bi and Goss, 2000; Luo and Goss, 2001; Khan and Goss, 2005; Cheng and Gallie, 2007), і ця взаємодія стимулюється наявністю цинку. Цинк також надає специфічність зв'язування PABP з eIF4B в порівнянні з eIF (iso) 4G (Cheng et al., 2008). Стан фосфорилювання як eIF4B, так і PABP є важливим для їх взаємодії (Le et al., 2000). Рослина eIF4B демонструє більш високе зв’язування з поліпуринами, хоча зв’язуватиме і поліпіримідини (Gallie and Tanguay, 1994; Cheng and Gallie, 2006). Взаємодія eIF4B та PABP підвищує активність АТФази та РНК-гелікази комплексу eIF4A/eIF4B/eIF (iso) 4F. Це свідчить про те, що PABP може стимулювати сканування мРНК комплексом eIF4 і тим самим збільшити швидкість ініціювання трансляції (Bi and Goss, 2000). Спорідненість до зв'язування з кришкою eIF (iso) 4F та спорідненість до полі (А) PABP також посилюються завдяки цим взаємодіям (Le et al., 1997; Wei et al., 1998; Khan and Goss, 2005). Таким чином, взаємодія між PABP, eIF4B та eIF (iso) 4F може забезпечити деяким обмеженим та поліаденильованим мРНК конкурентну трансляційну перевагу (Bi and Goss, 2000; Khan and Goss, 2005).
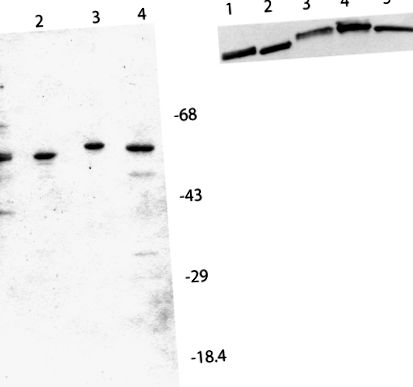
SDS-PAGE та західний аналіз препаратів eIF4B, що використовуються в аналізах трансляції in vitro. A, Кожна смуга містить приблизно 2 мкг білка. Провулок 1, рідна пшениця eIF4B; доріжка 2, рекомбінантна пшениця eIF4B; доріжка 3, рекомбінантний арабідопсис eIF4B2; доріжка 4, рекомбінантний арабідопсис eIF4B1. Маркери молекулярної ваги відповідають зазначеним. Гель фарбували блискучим синім кумасі. B, Полівініліденфтористий блот інкубували з 1/1000 розведенням споріднених очищених кролицьких антитіл Arabidopsis eIF4B2 протягом ночі при 4 ° C. Друге антитіло до пероксидази хрону кози проти кролика 1/25000 (лабораторії Кіркегора та Перрі) інкубували протягом 2 годин при кімнатній температурі (Browning et al., 1990). Реактивні смуги антитіл візуалізували за допомогою хемілюмінесценції (SuperSignal; Pierce) і піддавали впливу плівки. Доріжка 1, рідна пшениця eIF4B (0,9 мкг); доріжка 2, рекомбінантна пшениця eIF4B (0,3 мкг); доріжка 3, нативний Arabidopsis eIF4B (5 мкг); доріжка 4, рекомбінантний арабідопсис eIF4B2 (0,3 мкг); доріжка 5, рекомбінантний арабідопсис eIF4B1 (0,3 мкг).
Антитіла до арабідопсису eIF4B
Антитіла до арабідопсису eIF4B2 вирощували у кроликів. Антисироватки перехресно реагували з нативним AteIF4B, рекомбінантним AteIF4B1, а також з нативним і рекомбінантним пшеничним eIF4B (рис. 2B). Антисироватки eIF4B2 також перехресно реагували з С-кінцевим фрагментом деградації AteIF4B1 (дані не показані).
Аналіз гель-фільтрації пшениці та арабідопсису eIF4B
Попередні дослідження з використанням гель-фільтрації показали, що ссавці (Methot et al., 1996b) та пшениця eIF4B (Metz et al., 1999) можуть існувати як гомодимери. Для визначення нативного місісу в низькій (0,1 м KCl) і високій солі (0,5 м KCl) проводили гель-фільтрацію FPLC із використанням колонки Sephacryl S-200HR (діапазон розділення 5000-250 000 молекулярних ваг) для рідної та рекомбінантної пшениці eIF4B, як а також ізоформи Arabidopsis eIF4B. Ми не виявили доказів того, що об’єм елюції відрізнявся між низьким та високим вмістом солі для будь-якої з ізоформ eIF4B (Таблиця I). Крім того, всі ізоформи елюювались з точністю до 1,0-1,5 мл одна від одної, що свідчило про те, що вони мали подібні пані. що eIF4B утворює димери, як повідомлялося раніше (Metz et al., 1999), або не має кулястої форми і афективно рухається в середовищі гель-фільтрації.
Таблиця I.
Аналіз гель-фільтрації FPLC Sephacryl S-200 пшениці та ізоформ eIF4B Arabidopsis
- Докази використання тетрацикліну в стародавньому Нубійському блозі
- Ексенатид захищає від індукованої глюкозою та ліпідами ендотеліальної дисфункції
- Продукти харчування спеціального випуску Продукти рослинного походження
- FreeTrial B Комплексні огляди для схуднення Bioschwartz Colon Cleanser Detox для огляду схуднення
- Грамотність здоров’я у складному середовищі цифрових медіа Досвід пацієнтів із ожирінням дітей