Збільшення надходження в їжу фосфору з харчових добавок: потенціал негативного впливу на здоров’я кісток 1, 2, 3
Ейдзі Такеда
4 Кафедра клінічного харчування, Інститут біологічних наук про здоров'я, Вища школа Токусіма, місто Токусіма, Токусіма, Японія; і
Хіронорі Ямамото
5 Департамент охорони здоров'я та харчування, факультет людського життя, Університет Джин-Ай, місто Ечізен, Фукуї, Японія
Хісами Яманака-Окумура
4 Кафедра клінічного харчування, Інститут біологічних наук про здоров'я, Вища школа Токусіма, місто Токусіма, Токусіма, Японія; і
Ютака Такетані
4 Кафедра клінічного харчування, Інститут біологічних наук про здоров'я, Вища школа Токусіма, місто Токусіма, Токусіма, Японія; і
Анотація
Вступ
Прийом фосфору необхідний для росту та мінералізації кісток. Фосфор рясно надходить у раціон через м’ясо, зернові та молочні продукти. У багатьох країнах дієтичне споживання фосфору вище (1, 2), ніж рекомендована добова норма, і фосфор, як фосфорні солі, додається в їжу як харчова добавка. Показано, що велике споживання фосфору пригнічує збільшення концентрації 1,25-дигідроксивітаміну D [1,25 (OH) 2D] 6 у сироватці крові у відповідь на низьке споживання кальцію в їжі. Крім того, фосфор вважається основним харчовим джерелом кислоти (3). Продовжується дискусія про те, чи надмірне споживання фосфору негативно впливає на масу та щільність кісткової тканини. Тому в цьому огляді обговорюється роль надмірного надходження в їжу фосфору з натуральної їжі та оброблених продуктів харчування для здоров’я кісток.
Поточний стан знань
Споживання фосфору та здоров’я кісток.
Приблизно 80–90% мінерального вмісту кісток складається з кальцію та фосфору, а 85% фосфору, що міститься в організмі, знаходиться в скелеті. Адекватне споживання фосфору має важливе значення для багатьох біологічних процесів, включаючи мінералізацію скелета, але вважається, що надмірне споживання може мати шкідливий вплив на кістки. Фосфор може безпосередньо спричиняти апоптоз у культивованих остеобластах, а також збільшення концентрації паратгормону (ПТГ) (4). Дієти з високим вмістом фосфору та низьким вмістом кальцію призводять до зменшення всмоктування кальцію в кишечнику, зменшення концентрації кальцію в сироватці крові та стимулювання секреції ПТГ, що, в свою чергу, призводить до резорбції кісток, щоб повернути кальцію в сироватці до гомеостатичних концентрацій. Періодичне введення людського ПТГ збільшує кісткову масу у людей та щурів (5, 6), але постійно високі концентрації ПТГ знижують мінеральну щільність кісткової тканини. Показано, що фосфор з високим вмістом їжі спричиняє втрату кісткової маси у тварин (7).
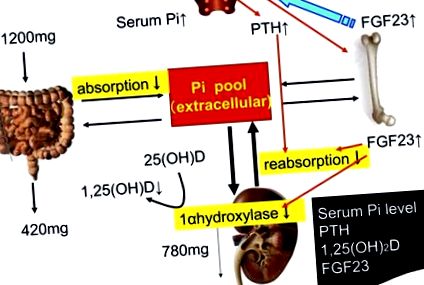
У дослідженнях на тваринах та людях спостерігалося стійке підвищення рівня ПТГ після споживання фосфору (8, 9). На додаток до кількох природних джерел фосфору в молочних продуктах, м'ясі, цільних зернах, горіхах та яйцях, використання фосфорних добавок у харчовій промисловості є загальним явищем, що ще більше збільшує споживання фосфору (10, 11). Фосфор з неорганічних добавок поглинається майже повністю (12) і може мати ефекти, що відрізняються від ефектів природного фосфору (13, 14). Було підраховано, що фосфорні добавки можуть додавати до раціону до 1 г фосфору, залежно від вибору їжі, у США (12). На основі недавнього звіту, типовий пацієнт на гемодіалізі в Європі споживає щонайменше 100–300 мг додаткового фосфору з добавок (15). Фосфор безпосередньо регулює виробництво 1,25 (OH) 2D клітинами нирок у культурі (16) та in vivo (17) ( Рис. 1 ).
Обмін фосфору у людини. Високе споживання фосфору в їжі підвищує концентрацію фосфору в сироватці крові, що стимулює секрецію ПТГ та секрецію FGF23. І PTH, і FGF23 індукують фосфатурію. PTH та FGF23 активують та інгібують синтез 2D 1,25 (OH), що підвищує та зменшує ефективність поглинання фосфору в кишечнику відповідно. PTH також стимулює секрецію FGF23, тоді як FGF23 інгібує секрецію PTH. FGF23, фактор росту фібробластів 23; Пі, неорганічний фосфат; ПТГ, паратгормон; 1,25 (OH) 2D, 1,25-дигідроксивітамін D; 25 (OH) D, 25-гідроксивітамін D.
Фактор росту фібробластів у сироватці крові (FGF23) переважно секретується остеоцитами і є головним фактором регуляції фосфорного гомеостазу (18, 19). FGF23 досягає своєї клітинної специфічності в нирках та паращитовидних залозах шляхом зв’язування в присутності його обов’язкового трансмембранного білкового корецептора Klotho, що збільшує спорідненість FGF23 до всюди експресованих рецепторів FGF (20). FGF23 діє на нирку, викликаючи фосфатурію, знижений синтез 1,25 (OH) 2D і потенційно коригує високі концентрації фосфору та 1,25 (OH) 2D. Було показано, що введення рекомбінантного FGF23 пригнічує експресію та секрецію гена ПТГ у щурів з нормальною функцією нирок та in vitro в культурах органів паращитовидних залоз щурів у щурів з нормальною функцією нирок (21).
Навантаження фосфором і кістковий метаболізм.
Ми дослідили гострий ефект перорального навантаження фосфору на ПТГ та FGF23, щоб з'ясувати їх роль у швидкому регулюванні сироваткового фосфору (23). У першому дослідженні 8 здоровим добровольцям чоловічої статі по черзі подавали 1 з 3 тестових страв, що містять 200 мг кальцію та різні кількості фосфору [400 мг (P400), 800 мг (P800) та 1200 мг (P1200)] як обід.
Виділення фосфору з сироваткою та сечею фосфору значно збільшилось і залежно від дози протягом 1 год після прийому Р400, Р800 та Р1200. Кальцій у сироватці крові не змінювався, оскільки споживання фосфору збільшувалось. Подібним чином рівень кальцію в сироватці крові знизився після прийому фосфору 1995 мг, але не змінився після прийому 1245 мг фосфору (22). Концентрація ПТГ у сироватці крові суттєво зросла через 1, 2 та 4 години після прийому їжі Р800 та Р1200 порівняно з такою після їжі Р400. ПТГ у сироватці крові показав двофазну криву через 1–2 та 4–6 год після прийому Р1200 і був значно вищим, ніж після прийому Р400. Сироватка FGF23 значно зросла через 8 годин після прийому Р1200 порівняно з прийомом як Р400, так і Р800 (23). Ці дані вказують на те, що ПТГ може бути пов'язаний із швидкою адаптацією фосфорного гомеостазу, але що FGF23 може не бути.
Навантаження кальцію та фосфору та метаболізм кісток.
У тварин, які харчуються дієтою з низьким співвідношенням кальцію та фосфору, було виявлено вторинний гіперпаратиреоз, втрату кісток та остеопенію (24). Навіть велике споживання кальцію (1680 мг/добу) не протидіяло впливу дієтичного споживання фосфору на здорових жінок (1). На відміну від цього, коли споживання фосфору перевищувало дієтичні норми (700 мг/добу), пероральне споживання кальцію знижувало концентрацію ПТГ у сироватці крові та резорбцію в кістках, що було обумовлено збільшенням споживання фосфору (22). Крім того, було виявлено, що високе співвідношення кальцію та фосфору є сприятливим для мінералізації кісток у дорослих щурів та людей-учасників (25–27). Отже, дієтичне співвідношення кальцію та фосфору вважається маркером для прогнозування здоров’я та/або якості кісток, незалежно від абсолютного споживання обох елементів окремо (1,28).
Отже, у нашому другому дослідженні вплив варіації споживання кальцію з високим споживанням фосфору на гомеостаз кальцію та фосфору в сироватці крові досліджували шляхом подачі 1 з 3 тестових страв, що містять 1200 мг фосфору та різного споживання кальцію [400 мг (Са400), 600 мг Ca600) та 1000 мг (Ca1000)] (29). Фосфор у сироватці крові збільшився до тієї ж концентрації після прийому всередину 3 прийоми їжі, а високі концентрації підтримувались протягом 8 год після прийому їжі. Не було значущих відмінностей у сироватці крові 1,25 (OH) 2D між групами, навантаженими кальцієм. Залежні від часу зміни рівня ПТГ у сироватці крові продемонстрували двофазну криву з піками через 1 та 6 год після прийому Ca400. Цікаво, що другі піки через 6 год ПТГ після Ca600 та Ca1000 були значно придушені та зникли у порівнянні з такими після Ca400 ( Рис. 2А ). Ці дані суперечать даним попереднього дослідження, проведеного в іншій етнічній групі (1). Після прийому кожного з 3 прийомів їжі сироватка FGF23 не змінювалась протягом 8 год (рис. 2В). Це означає, що необхідне достатнє споживання кальцію з їжею, щоб мінімізувати вплив високого споживання фосфору на секрецію ПТГ та FGF23.
Концентрація FGF23 та PTH у сироватці крові після фосфатно-кальцієвого навантаження. Здоровим чоловікам по черзі подавали 1 з 3 тестових страв, що містять 1000 мг фосфору та різну кількість кальцію [400 мг (Са400), 600 мг (Са600) та 1000 мг (Са1000)], поданих на обід. Вимірювали постпрандіальні зміни концентрацій ПТГ та FGF23 у сироватці крові. Прийом 1000 мг кальцію при великому споживанні фосфору (1200 мг) пригнічує другий пік підвищення рівня ПТГ та FGF23 у сироватці крові. Дані отримані за посиланням 29. FGF23, фактор росту фібробластів 23; ПТГ, паратгормон.
Короткочасне високе споживання фосфору та метаболізм кісток.
Феррарі та ін. (30) продемонстрували, що навантаження фосфором протягом 3 днів збільшувало сироватковий FGF23 вранці після голодування, незважаючи на нормальний фосфор у сироватці крові. Вони також продемонстрували, що зміни FGF23 позитивно корелювали зі змінами 24-годинної екскреції фосфору з сечею та негативно корелювали зі змінами максимальної реабсорбції фосфору, хоча ПТГ не було. Крім того, концентрація FGF23 у сироватці крові не корелювала з фосфором вранці натщесерце.
Нещодавно Мартін та співавт. (31) продемонстрували, що безпосередній вплив фосфору на ПТГ не залежав від збільшення фосфору в сироватці крові, припускаючи, що додаткові сигнали, що надходять з боку шлунково-кишкового тракту, сприятимуть швидкій реакції. Ці фактори можуть також опосередковувати перший пік рівня ПТГ у сироватці крові у нашому першому дослідженні. З іншого боку, другий пік, ймовірно, був опосередкований збільшенням рівня фосфору в сироватці крові після навантаження фосфором в їжу. Дослідження, які оцінювали короткочасні ефекти дієти з низьким вмістом фосфору або добавок до фосфору, не змогли знайти зміни рівня FGF23 у здорових людей через 6 год (23) або через 2–3 дні (30).
Тривале споживання фосфору та здоров’я кісток.
Споживання фосфору корелювало з переломами ламкості кісток у бразильському населенні (32). Було продемонстровано, що на кожні 100 мг фосфору ризик переломів зростав на 9%. Крім того, було показано, що більш високі концентрації фосфатів у сироватці крові та менша мінеральна щільність кісток стегна не залежать від міцності та якості кісток та пов’язані з підвищеними показниками кальцифікації судин, що сприяє пошуку ефективних стратегій профілактики та лікування, які можуть одночасно зменшити ці модифікуються фактори ризику у літніх людей (33). Ці спостереження свідчать про те, що довготривале навантаження фосфором з їжею та тривала гіперфосфатемія можуть бути важливими негативними регуляторами стану здоров’я кісток.
Високе співвідношення кальцію до фосфору та здоров’я кісток.
Концентрації ПТГ не збільшувались внаслідок високого споживання фосфору в їжі разом із достатньою кількістю кальцію, де зменшення вільного іонізованого кальцію компенсувалося дієтою (32). Чим вище споживання кальцію, тим рідше фосфор у сироватці перевищував верхню контрольну межу. Це свідчить про те, що поглинання фосфору зменшується із збільшенням споживання кальцію, хоча і недостатньо, щоб запобігти надмірній концентрації фосфору в сироватці. У дослідженнях, в яких споживання кальцію було адекватним (1000 мг) або високим (1995 мг), велике споживання фосфору не суттєво підвищувало концентрацію фосфору в сироватці крові (34, 35). Можливо, це пов’язано із зменшенням поглинання фосфору через утворення в кишечнику комплексу фосфату кальцію. Басабе Туеро та ін. (36) дійшов висновку, що велике споживання кальцію (> 1000 мг/добу) та співвідношення кальцію до фосфору> 0,74 пов'язані з кращою щільністю мінеральних речовин у кістках у молодих жінок. Ці висновки відповідають попереднім епідеміологічним дослідженням (37, 38). Таким чином, несприятливий вплив на секрецію ПТГ від високого споживання фосфору спостерігався лише тоді, коли споживання кальцію було недостатнім.
Споживання молочної їжі та здоров’я кісток.
Перероблена їжа та здоров’я кісток.
Стійкість FGF23 до звичного надлишку споживання фосфору.
Зв'язок між попереднім переломом ламкості кісток та вищим фосфатом у сироватці крові була описана у осіб з нирковою недостатністю (54, 55). У міру зниження функції нирок та розвитку хронічної хвороби нирок збільшення затримки фосфату призводить до збільшення рівня фосфору та FGF23 у сироватці крові (56). Тим часом зменшення всмоктування кальцію, спричинене зменшенням 2D-секреції 1,25 (OH), призводить до зменшення вмісту кальцію в сироватці крові та збільшення рівня ПТГ. Таким чином, тенденція до розвитку гіперфосфатемії у хворих на хронічну хворобу нирок на деякий час затримується через високий рівень FGF23 та ПТГ, що компенсується зменшенням реабсорбції ниркового фосфату та зменшенням всмоктування фосфату в кишечнику. Врешті-решт, оскільки функція нирок продовжує знижуватися, розвивається відверта гіперфосфатемія.
В культурі органів паращитовидної залози було показано, що FGF23 знижує секрецію ПТГ і ПТГ-мРНК у контрольних або ранніх хронічних захворювань нирок, але не у хворих із запущеною хронічною хворобою нирок (57). Рекомбінантний FGF23 не зумів знизити рівень ПТГ у сироватці крові у паращитовидних залозах щурів із запущеною хронічною хворобою нирок (58). Таким чином, підвищений FGF23 не зміг зменшити ПТГ при встановленому хронічному захворюванні нирок через зниження регуляції його рецепторного гетеродимерного комплексу Klotho-FGFR1c (59). Ці результати демонструють стійкість паращитовидної залози до FGF23 при запущеному хронічному захворюванні нирок.
Висновки
FGF23 пригнічує експресію та секрецію гена ПТГ у паращитовидній залозі щурів з нормальною функцією нирок (21). Середній рівень ПТГ у сироватці крові був майже у 2 рази вищим, а середні концентрації кальцію в сироватці нижчі серед загальної популяції з найвищим загальним споживанням фосфору порівняно з такими з найнижчим споживанням (14). Ці висновки відповідають попереднім інтервенційним дослідженням (60, 61), які передбачають розвиток стійкості до FGF23 шляхом звичного надлишку споживання фосфору ( Рис.3 ). Через значне споживання фосфору в їжі та сучасну тенденцію до зростання споживання перероблених продуктів харчування в західних країнах, ці результати мають важливе значення для громадського здоров'я. Тому припускають, що надмірне споживання дієтичного фосфору може погіршити здоров'я кісток, що опосередковується резистентністю до FGF23, як у здорових популяцій, так і у хворих на хронічну хворобу нирок.
Процес, що призводить до стійкості до FGF23 за рахунок звичного надходження фосфору та/або низького вмісту кальцію. Надмірне надходження в їжу фосфору може погіршити стан здоров’я кісток, що опосередковується стійкістю до FGF23. FGF23, фактор росту фібробластів 23; Пі, неорганічний фосфат; ПТГ, паратгормон; 1,25 (OH) 2D, 1,25-дигідроксивітамін D.
Подяка
Усі автори прочитали та схвалили остаточний рукопис.
Виноски
6 Використовувані скорочення: BALP, специфічна для кісток лужна фосфатаза; FGF23, фактор росту фібробластів 23; ПТГ, паратгормон; U-Cr, виведення креатиніну з сечею; U-NTx, сечовий N-кінцевий телопептид колагену I типу; 1,25 (OH) 2D, 1,25-дигідроксивітамін D.
- Наявність домашньої їжі, споживання їжі батьками та сімейні харчові звички впливають на дієту
- Впуск; Оцінки дієтичного ризику харчових продуктів; Служби регулювання харчових продуктів Безпека харчових продуктів
- Чи занадто багато фосфору в їжі загрожує вашим ниркам Центр науки в суспільних інтересах
- Дефіцитні рецептори лептину щури-цукери із ожирінням зменшують споживання їжі у відповідь на системну реакцію
- Як харчова безпека пов’язана з дієтичною поведінкою Аналіз з низьким рівнем доходу, етнічно