Загальна трансплантація калової мікробіоти полегшує індукований дієтою стеатогепатит у мишей за рахунок корисної регуляції мікробіоти кишечника
Предмети
Анотація
Вступ
Примітно, що упередженість печінково-інфільтруючих Т-клітин разом із виділеними цитокінами відіграє ключову роль у запаленні та прогресуванні NASH 7. Тим часом мікробіота кишечника відіграє важливу роль у підтримці гомеостазу адаптаційної імунної системи та регулює функції Т-клітин, що частково може бути пов’язано з такими метаболітами, як коротколанцюгові жирні кислоти (СКЖК) 8,9,10. Таким чином, ми провели це дослідження та висунули гіпотезу, що FMT покращує екосистеми мікробіоти шлунково-кишкового тракту, регулює метаболіти кишечника, такі як коротколанцюгові жирні кислоти, та виправляє дисбаланс імунної системи печінки, що призводить до послаблення дієти з високим вмістом жиру (HFD). стеатогепатит у мишей.
Матеріали і методи
Експерименти на тваринах
Самці мишей C57BL/6 без специфічних патогенів (SPF) (SLAC Laboratory animal co., LTD, Шанхай, Китай) розміщувались у високоефективних клітинах з фільтруванням повітря, що містять тверді частинки, зі стерилізованими підстилками та годували автоклавною чау і водою ad libitum. Усі експерименти на тваринах були схвалені Інституційним комітетом з догляду та використання тварин лікарні Сіньхуа, яка є афілійованою особою при Шанхайській медичній школі університету Цзяо Тун, і всі експерименти проводились відповідно до Керівництва Національної дослідницької ради з догляду та використання лабораторних тварин.
Мишей випадковим чином розподіляли на три групи (по 12 мишей на групу). Контрольну групу годували стандартним чау протягом 16 тижнів. Групу з HFD годували HFD (88% стандартна дієта, 10% сало та 2% холестерину) протягом 16 тижнів. Групу з HFD + FMT годували HFD протягом 16 тижнів та лікували FMT протягом останніх 8 тижнів. Всім мишам давали комбінацію пеніциліну (2000 Од/мл) та стрептоміцину (2 мг/мл) (Sigma Aldrich, США) у питній воді протягом 3 днів для видалення корінних мікроорганізмів кишечника. Після такої обробки з контрольної групи відразу після дефекації збирали 200 мг свіжого стільця, який ресуспендували у 5 мл фізіологічного розчину, перемішували на вортексі протягом 3 хв і давали відстоятися самопливом протягом 2 хв, і свіжий стілець збирали щодня . Трансплантацію мишам-реципієнтам досягали шляхом промивання 200 мкл супернатанту із зразка калу один раз на день протягом 8 тижнів 11 .
Кожну мишу зважували раз на тиждень і розраховували щотижневе споживання їжі на мишу для різних груп. Мишей приносили в жертву через 16 тижнів і збирали кров від серця натще. Тканини печінки, тонкої кишки, вміст сліпої кишки та епідидимальної жирової тканини кожної миші або фіксували в 4% розчині параформальдегіду, заморожували в гелі оптимальної температури різання, або заморожували в рідкому азоті і зберігали при -80 ° C.
Мікробний аналіз калу
Аналізи сироватки
Аланінамінотрансферазу натще (ALT), аспартатамінотрансферазу (AST) та глюкозу в крові (FBG) вимірювали за допомогою автоматизованого аналізатора (Sysmex CHEMIX-180, Японія). Сироватковий інсулін (набір ELISA для інсуліну для щурів/мишей, Merck-Millipore) вимірювали за допомогою імуноферментного аналізу, концентрацію ендотоксину миші в сироватці вимірювали за допомогою імуноферментного аналізу (Mouse ET ELISA Kit, Trust Specialty Zeal) та зразки і стандарти оброблялись відповідно до інструкцій виробника. Оцінку моделі гомеостазу на інсулінорезистентність (HOMA-IR) розраховували за рівнянням: FBG (ммоль/л) × інсулін (мО/л)/22,5. Індекс чутливості до інсуліну (ISI) розраховували за рівнянням: 1/(FPG (ммоль/л) × інсулін (мО/л)).
Вимірювання тригліцеридів та холестерину в печінці
Внутрішньопечінкові тригліцериди (TG) та холестерин вимірювали за допомогою набору для аналізу тригліцеридів або набору для аналізу холестерину (Applygen Technologies Inc., Пекін, Китай). Потім зразки та стандарти обробляли відповідно до інструкцій виробника. Кінцеві концентрації тригліцеридів та холестерину коригували на вміст білка.
Гістологічний аналіз
Парафінові альдегідні парафінові зрізи печінки та тонкої кишки фарбували гематоксилін-еозином для патологічного аналізу або трихромним плямою Массона від фіброзу. Оцінювали показник безалкогольної жирної активності печінки (NAS) і заморожені зрізи печінки фарбували олійно-червоним O. Для іммугогістохімічного фарбування використовували зрізи, вбудовані у парафін. Застосовували кон'юговане з пероксидазою хрону вторинне антитіло і реакцію візуалізували за допомогою 3,3'-діамінобензидину тетрагідрохлориду. Скла були забарвлені гематоксиліном. Позитивні області кількісно визначали за допомогою зображення J2x. Анти-Foxp3 та анти-ZO-1 антитіла були придбані у Abcam (MA, США), а IFN-γ, IL-4, IL-17 та IL-22 - у Bioworld (MN, США).
Кількісна ланцюгова реакція полімерази в реальному часі (qPCR)
Загальну РНК екстрагували з печінки, тонкої кишки або епідидимального жиру за допомогою Trizol (D9108B, Takara, Далянь, Китай) і реверсивно транскрибували в кДНК, використовуючи Primescript RT Master Mix (RR036A, Takara, Dalian, Китай). QPCR у реальному часі проводили на ПЛР-системі реального часу Applied Biosystems 7500 із використанням SYBR Premix Ex Taq (Tli RnaseH Plus) (RR420A, Takara, Далянь, Китай). Праймери для цільових генів були синтезовані компанією Sangon Biotech (Шанхай, Китай). Послідовності праймерів для генів наведені в додатковій таблиці 1. Специфічність праймера підтверджена кривою дисоціації за допомогою програмного забезпечення SDS 7500 системи. Як внутрішній контроль використовували гліцеральдегід 3-фосфатдегідрогеназу (GAPDH).
Вестерн-блот-аналіз
Печінку лізували в крижаному буферному аналізі радіоімунопреципітаційного аналізу (RIPA), що містив інгібітори протеази та фосфатази (фенілметилсульфонілфторид, PMSF) (Beyotime, Шанхай, Китай). Загальний білок вимірювали методом білкового аналізу біцинонінової кислоти (BCA, Beyotime, Шанхай, Китай). Виявлено Foxp3, IFN-γ, IL-4, IL-17, IL-22 та рецептори інсуліну (IR, Abcam) у печінці, а актин використовували як контроль навантаження. Імунні комплекси виявляли за допомогою іммоболонного західного хемілюмінесцентного субстрату HRP (Millipore Corporation, Billerica, MA). Діапазони були кількісно визначені Image Lab версії 2.0.1 (Bio-Rad, Геркулес, Каліфорнія).
Кількісна оцінка вмісту сліпої кишки в коротколанцюгових жирних кислотах
Для визначення рівня SCFA проводили аналітичну рідинну хроматографію високого тиску (ВЕРХ, Agilent 1200, Wilmington, DE, США). Коротше кажучи, стандартні розчини ацетату, пропіонату та бутирату (усі фірми Sigma-Aldrich) готували при різних концентраціях (3-6000 нг/мл). Ці розчини аналізували за допомогою ВЕРХ, а вміст сліпої кишки розчиняли в 0,1% мурашиної кислоти та аналізували аналогічним чином для вимірювання загальної концентрації всіх трьох вільних жирних кислот 11 .
Статистичний аналіз
Результати представлені як середнє із стандартною похибкою середнього значення (SEM). Призма Graph Pad (версія 6.01) була використана для проведення всіх статистичних тестів. Порівняння проводили за допомогою одностороннього аналізу дисперсійного тесту (ANOVA) та Post hoc Student-Newman – Kuels аналізів, коли> 2 групи. Результати вважалися статистично значущими при стор
Результати
Вплив FMT на масу тіла, HOMA-IR та сироваткові трансамінази
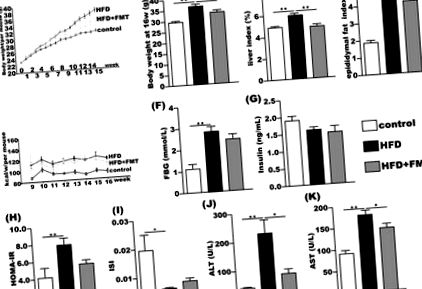
Після 16 тижнів експерименту миші групи HFD набрали більше маси тіла, ніж контрольна група. Індекс печінки та індекс жиру епідидиму були значно збільшені на 20% та 125%, відповідно, порівняно з контрольною групою. Після 8 тижнів втручання FMT маса тіла, індекс печінки та індекс жиру епідидиму в групі HFD + FMT значно зменшились порівняно з групами HFD (рис. 1A – D). Однак тижневе споживання енергії не показало значної різниці між групами HFD та HFD + FMT (рис. 1Е). FBG був суттєво підвищений у групі HFD порівняно з контрольною групою, але не виявив суттєвої різниці між групою HFD та HFD + FMT (рис. 1F). Рівень інсуліну в сироватці крові суттєво не змінювався серед трьох груп (рис. 1G). HOMA-IR було збільшено, а ISI зменшено в групі HFD порівняно з групою контролю, але HOMA-IR та ISI не були значно покращені в групі HFD + FMT порівняно з групою HFD (рис. 1H, I). Рівні ALT і AST у сироватці крові значно підвищувались у групі з HFD порівняно з контрольною групою та значно зменшувались після 8-тижневого втручання FMT (рис. 1J, K).
Поліпшення ФМТ на мікробіоти кишечника та збільшення концентрацій бутирату в вмісті сліпої кишки
Щоб виявити вплив HFD та FMT на структуру мікробіоти, ми секвенували бактеріальну 16S рРНК на вихідному рівні та через 16 тижнів. Проводили незважені аналізи PCoA, PCoA та NMDS, щоб надати огляд складу мікробіоти кишечника шести груп тварин на початковому етапі та наприкінці випробування. Побудовані показники не вказували на виявлену різницю у складі мікробіоти серед груп до втручання, але чітко відокремлювали мишей 16w-HFD від контрольних мишей 16w, причому група 16w-HFD + FMT розподілялася між ними. Це вказувало на те, що втручання FMT змістило загальну структуру мікрофлори кишечника, порушеної HFD, до структури контрольних мишей (рис. 2А-С). Крім того, ієрархічний кластерний аналіз показав, що спільноти 1w-control, 1w-HFD, 1w-HFD + FMT та 16w-control спільноти об'єднуються, а потім кластеруються з 16w-HFD + FMT та 16w-HFD спільнотами по порядку (рис. . 2D).
Шістнадцять тижнів годування HFD спричинили широкомасштабні зміни в структурі мікрофлори кишечника на рівні типу порівняно з контролем. Відмічено збільшення кількості Бактероїдетів (63,1% проти. 52,9%) та зменшення кількості актинобактерій (0,04%) проти. 0,15%) та фірмами (35,8%) проти. 44,6%). Однак втручання FMT пом'якшило зменшення актинобактерій та твердих речовин, спричинене HFD, та індуковане HFD збільшення Bacteroidetes. На рівні роду, Лактобактерії, Christensenellaceae_некультурні, Prevotellaceae_uncultured були зменшені в групі HFD порівняно з контролем, і всі вони були скасовані шляхом втручання FMT. Втручання FMT зменшило кількість Одорибактер і Осцилібактер порівняно з групою HFD (рис. 2E, F). Аналіз LefSe також показав, що втручання FMT було пов'язане зі змінами на рівні роду (рис. 2G, H).
Концентрації ацетату та пропіонату у вмісті сліпої кишки не показали різниці між трьома групами (рис. 2I, J). Концентрація бутирату в вмісті сліпої кишки не показала різниці між контрольною та групою HFD, але була значно збільшена в групі HFD + FMT (рис. 2К).
Втручання FMT покращило щільне з'єднання та морфометрію тонкої кишки та ендотоксемію
Фарбування ВІЛ показало, що пошкодження слизової оболонки кишечника, спричинене HFD, полегшено втручанням ФМТ (рис. 3А). Імуногістохімія та qPCR продемонстрували, що експресія ZO-1 у тонкому кишечнику значно збільшилася після втручання FMT порівняно з групою HFD (рис. 3B, C). Крім того, рівень ендотоксину в сироватці крові був суттєво підвищений у групі HFD, але був знижений після втручання FMT (рис. 3D).
Лікування ФМТ послаблює індукований ВЧЧ стеатогепатит
Частота розвитку стеатогепатиту, спричиненого хронічним годуванням із СНВ, становила 100% у групі із СНВ. Фарбування ВІН в печінці показало, що в контрольній групі не спостерігалося накопичення ліпідів, і помітне накопичення ліпідів спостерігалось у групі з ВЧС, що було значно послаблене лікуванням ФМТ (рис. 4А). Цей результат був додатково підтверджений фарбуванням олійно-червоного кольору O (рис. 4B). Середня оцінка NAS за печінкою становила 6,90 ± 0,233 у групі HFD і була знижена до 4,58 ± 0,260 після втручання FMT (рис. 4C). Внутрішньопечінковий вміст ТГ та вміст холестерину збільшувались приблизно у 4 рази та у 17 разів відповідно у групі з HFD порівняно з контрольною групою. Це збільшення було значно зменшено після втручання FMT (рис. 4D, E). МРНК PPAR-α в печінці зросла в 2 рази після HFD порівняно з контрольною групою, але була зменшена втручанням FMT. Не було різниці в печінковій мРНК PPAR-γ між групами HFD та контрольної групи, але вона була значно збільшена в групі HFD + FMT (рис. 4F).
Хоча фарбування печінки Массона не виявило фіброзу у всіх трьох групах (рис. 4G), рівні мРНК пов’язаних із фіброзом генів у печінці, таких як TGF-β1, α-SMA, Smad7 та Smad2, були збільшені вдвічі більше у групі HFD, ніж у групі контролю, тоді як втручання FMT зменшувало експресію цих генів у печінці (рис. 4Н). МРНК TLR4 та Myd88 у печінці також суттєво збільшились у групі HFD порівняно з контрольною групою та були придушені втручанням FMT (рис. 4H). А рівень білка рецептора інсуліну в печінці значно збільшився після втручання FMT порівняно з групою HFD (рис. 4I, J).
Вплив FMT на внутрішньопечінковий імунітет
Рівні мРНК TNF-α, MCP-1, IL-1β, IL-2 та IL-6 у печінці були підвищеними в групі HFD порівняно з контрольною групою, і всі вони були знижені втручанням FMT (рис. 5А ).
Порівняно з контрольною групою, рівень печінкового білка Foxp3, IL-4 та IL-22 у групі HFD значно знизився, а експресія IFN-γ та IL-17 значно збільшилася. Втручання FMT ефективно скасувало ці незбалансовані імунні фактори, що збільшило рівні Foxp3, IL-4 та IL-22 та зменшило IFN-γ та IL-17 у печінці (рис. 5B, C).
Експресія Foxp3, IFN-γ, IL-4, IL-17 та IL-22 в печінці також була виявлена за допомогою імуногістохімічного фарбування. Результати показали, що Foxp3, IL-4 та IL-22 були зменшені, тоді як IFN-γ та IL-17 були відносно збільшені в групі HFD порівняно з контрольною групою. Це було скасовано втручанням FMT (рис. 5D – I).
Вплив FMT на епідидимальну жирову тканину
МРНК PPAR-α та PPAR-γ у жировій тканині епідидимуму були значно знижені в групі HFD порівняно з контрольною групою та значно підвищені після втручання FMT (рис. 6А). Крім того, рівні мРНК TNF-α та MCP-1 у жировій тканині епідидимуму були підвищені в групі HFD порівняно з контрольною групою, яка була придушена втручанням FMT (рис. 6B).
Обговорення
У цьому дослідженні ми продемонстрували, що мікробіота кишечника та внутрішньопечінкові цитокінові профілі у мишей були суттєво порушені 16-тижневим HFD. Однак 8-тижневе втручання FMT певною мірою скорегувало порушення мікробіоти кишечника і збільшило вироблення бутирату в вмісті сліпої кишки разом з корекцією дисбалансу про- та протизапальних цитокінів та реверсії стеатогепатиту у мишей, які годували хронічно з HFD. Ці результати показали, що ФМТ може мати глибокі наслідки для лікування НАСГ.
Наше дослідження має наступні обмеження. По-перше, ми не проводили метаболомічний аналіз вмісту сліпої кишки. Цей аналіз був би корисним для з’ясування впливу FMT на мишей. По-друге, ми провели лише секвенування рРНК 16-ї мікробіоти кишечника. Секвенування цілого геному було б більш точним для пошуку внутрішніх взаємодій з точки зору функції генів.
Підводячи підсумок, наші результати показали, що FMT послаблював HFD-індукований стеатогепатит у мишей. до цього часу пацієнти, які проходять ФМТ, в основному проходять ендоскопію, тому неможливо проводити ФМТ на високій частоті. Наш результат підтверджує можливий спосіб перорального прийому ФМТ за допомогою більш економічних та зручних методів, таких як капсули з фекаліями, які досліджуються у людини. Слід розглянути можливість розробки терапевтичних стратегій, спрямованих на мікробіом, щоб відкрити двері для нових способів профілактики та лікування НАСГ.
Список літератури
Рінелла, М. Е. Безалкогольна жирова хвороба печінки. Джама 313(2263), 5370–73, doi: 10.1001/jama.2015.5370 (2015).
Gkolfakis, P., Dimitriadis, G. & Triantafyllou, K. Мікробіота кишечника та неалкогольна жирова хвороба печінки. Хепатобіліарні та підшлункові захворювання 14, 572–581 (2015).
- Змінна деградація хряща у мишей з індукованою дієтою метаболічною дисфункцією, їжею для роздумів -
- Виразковий дерматит у мишей C57BL6NCrl на дієті з низьким або високим вмістом жиру з або без
- Ефекти проти ожиріння Тонгбі-сан в індукованій дієтою з високим вмістом жиру моделі миші з ожирінням BMC
- Що їдять польові миші Дізнайтеся про харчові звички польових мишей
- Що їдять миші Мишачі дієти Terminix