Ефекти проти ожиріння Тонгбі-сан у моделі ожиріння мишей із ожирінням, спричиненою дієтою
Анотація
Передумови
Нещодавно було відзначено, що натуральні рослинні препарати можуть бути ефективними для лікування ожиріння. Тонгбі-сан (ТБС) - традиційне ліки, яке зазвичай застосовується при дизурії (тобто при болючому сечовипусканні), містить три трави, Cyperus rotondus L., Цитрусові уншіу Маркович, і Кокос порія. У цьому дослідженні ми мали на меті вивчити, чи може TBS інгібувати індукований адипогенезом з високим вмістом жиру (HFD) у печінці та жировій тканині епідидиму мишей із ожирінням.
Методи
Самців мишей C57BL/6 N годували протягом 11 тижнів звичайною дієтою, HFD, HFD плюс орлістат 10 або 20 мг/кг або HFD плюс TBS 50 або 100 мг/кг. Щотижня перевіряли масу тіла та досліджували гістологічні дослідження тканин. Також оцінювали експресію генів, що беруть участь в адипогенезі.
Результати
Пероральне введення TBS суттєво зменшило масу тіла та зменшило вагу білої жирової тканини (WAT). Крім того, ми виявили, що TBS посилює експресію активованої аденозинмонофосфатом протеїнкінази (AMPK) та інгібує експресію факторів транскрипції, таких як CCAAT/білки, що зв'язують енхансер (C/EBP), регулюючий елемент стеролу білок 1 (SREBP1), а також активований проліфератором пероксисом рецептор γ (PPARγ) у печінці та епідидимальний ВАТ, виміряний кількісною ланцюговою реакцією полімерази зворотної транскрипції (qRT-PCR).
Висновок
Ці висновки демонструють, що ефекти ожиріння TBS можуть бути пов'язані з активацією AMPK.
Передумови
Ожиріння характеризується надмірним зростанням маси жирової тканини і швидко стає проблемою охорони здоров’я, яка зачіпає мільйони людей у всьому світі [1]. Жирова тканина вважається головним регулятором енергетичного гомеостазу [2]. Через дисбаланс між споживанням та витратою енергії ожиріння породжує надмірне зростання та розширення жирової тканини [3]. Біла жирова тканина (WAT) - це складний ендокринний орган, що складається з різних депо, включаючи підшкірні (наприклад, пахові) та внутрішньочеревні (наприклад, епідидимальні та мезентеріальні) депо WAT [4]. ВАТ належним чином поширюється для накопичення надлишкової енергії, однак під час ожиріння він може стати сильно дисфункціональним і не працювати для цих функцій. Нездорове розширення ВАТ корелювало з численними шкідливими наслідками, такими як запалення, гіпоксія, фіброз та порушення функції мітохондрій [5]. Таким чином, інгібування збільшення жирової тканини може бути важливою метою для запобігання та лікування ожиріння.
Процес, за допомогою якого генеруються зрілі адипоцити, адипогенез, сильно регулюється транскрипційними факторами, включаючи CCAAT/зв'язуючий енхансер білок α (C/EBPα), активований проліфератором пероксизоми рецептор γ (PPARγ) та регулюючий елемент стерину білок 1 (SREBP1). ) [6, 7]. PPARγ специфічно експресується в жировій тканині і діє як головний регулятор диференціації адипоцитів та метаболізму глюкози [8]. C/EBPα сильно експресується в жировій тканині та печінці як гризунів, так і людей [9], і повідомлялося, що миші-нокаути C/EBPα викидні для накопичення ліпідів в адипоцитах [10]. SREBP регулюють експресію багатьох ферментів, які беруть участь у синтезі холестерину, жирних кислот, триацилгліцеринів та фосфоліпідів. Отже, SREBP регулюють клітинний ліпогенез та ліпідний гомеостаз [11]. SREBP поділяються на три ізоформи: SREBP-1a, SREBP-1c та SREBP2 [12]. SREBP-1 в основному контролює експресію генів, що бере участь у метаболізмі жирних кислот і триацилгліцерину, тоді як SREBP-2 регулює в основному метаболізм холестерину [13].
Активована аденозинмонофосфатом протеїнкіназа (AMPK) є основним датчиком енергії, що визначається як протеїнкіназа, що активується збільшенням співвідношення енергії AMP/ATP [14]. AMPK також є гетеротримерним ферментом, який відіграє головну роль в енергетичному гомеостазі жирової тканини [15] і пов'язаний з регуляцією C/EBPα та PPARγ [16]. Крім того, SREBP1 також негативно регулюється AMPK [17]. Відповідно, ймовірно, що експресія AMPK є прихованою генною мішенню для придушення адипогенезу. У цьому дослідженні ми висунули гіпотезу, що активація AMPK може відігравати вирішальну роль у моделі миші, індукованої високим вмістом жиру (HFD), інгібуючи C/EBPα, PPARγ та SREBP1, таким чином пригнічуючи адипогенез.
Методи
Хімічні речовини та реактиви
TBS складається з C. rotundus Л., С. уншіу Маркович, і Кокос порія. Три трави були придбані у фармацевтичної компанії Nanum (Сеул, Республіка Корея). Трав'яні зразки були проведені для сенсорних досліджень згідно з «Корейською трав'яною фармакопеєю» професора Юн-Єоп Ча, і лише ті, що пройшли стандарт Корейської фармакопеї, були відібрані та використані для цього експерименту. TBS виготовляли із використанням пропорції цих трав 1: 1: 1 (по 400 г). Потім трави екстрагували у воді при температурі 99 ° C протягом 3 годин. Екстракт сушили ліофілізацією, і норму виходу розраховували на рівні 33,20% (33,20 г на 100 г рідкого екстракту). Порошок розчиняли в дистильованій воді для цього експерименту, а залишковий порошок зберігали при - 20 ° C. 30% HFD було отримано з Research Diets (Нью-Брансвік, Нью-Джерсі, США). Антитіла p-AMPK та AMPK були отримані з технології Cell Signaling Technology (Danvers, MA, США). PPARγ, C/EBPα, SREBP1, AMPK та олігонуклеотидні праймери гліцеральдегід-3-фосфатдегідрогенази (GAPDH) були придбані у Bioneer Corporation (Теджон, Республіка Корея), а SYBR Premix Ex Taq придбаний у Takara Bio Inc. (Otsu, Японія). Орлістат придбано Tokyo Chemical Industry Co. Ltd. (Токіо, Японія), а інші реагенти придбано у Sigma-Aldrich Co. LLC (Сент-Луїс, Міссурі, США).
Модель миші із ожирінням, спричиненою HFD
Аналіз сироватки
В кінці кожного експерименту зразки крові оброблених мишей збирали і центрифугували при 1000 ×g протягом 20 хв. Зібрану концентрацію в сироватці крові використовували для визначення загального холестерину (ТК), азоту сечовини в крові (BUN), аспартатамінотрансферази (AST) та аланінамінотрансферази (ALT) за допомогою ферментативних методів із комерційних наборів (BioVision; Milpitas, CA, USA).
Гістологічний аналіз
Печінку та жирову тканину епідидиму від представницької миші в кожній групі фіксували у 10% забуференному формаліні, вкладали у парафін і розрізали на ділянки товщиною 8 мкм. Деякі зрізи фарбували гематоксиліном та еозином (H&E) для гістологічного дослідження крапель ліпідів, а зображення отримували за допомогою мікроскопа Olympus SZX10 (Токіо, Японія).
Вестерн-блот-аналіз
Сегменти печінки або жирової тканини епідидиму суспендували у розчині для екстракції білка PRO-PREP ™ (Intron Biotechnology, Сеул, Республіка Корея) та інкубували протягом 20 хв при 4 ° C. Клітинний сміття видаляли мікроцентріфугуванням з наступним швидким заморожуванням супернатанту. Концентрацію білка визначали за допомогою реагенту для аналізу білка Bio-Rad (Bio-Rad, Hercules, CA, USA) відповідно до інструкцій виробника. Клітинні білки з оброблених та необроблених клітинних екстрактів електроблотували на мембрану з полівініліденфторидом після поділу через 10–12% SDS-PAGE. Блот інкубували протягом 1 години з блокуючим розчином (5% знежиреного молока) при кімнатній температурі з подальшою інкубацією протягом ночі з первинним антитілом (1: 1000) при 4 ° С. Плямки промивали три рази сольовим розчином, забуференним Tween 20/Tris (T/TBS), та інкубували з кон'югованим з пероксидазою хрону вторинним антитілом (1: 2000) протягом 2 годин при кімнатній температурі. Плямки знову тричі промивали T/TBS, а потім розробляли за допомогою посиленої хемілюмінесценції (GE Healthcare, Waukesha, WI, USA). Денситометричний аналіз проводили за допомогою програмного забезпечення Bio-Rad Quantity One.
Кількісний аналіз ланцюгової реакції полімерази в реальному часі (qRT-PCR)
Печінку та епідидимальну ВАТ гомогенізували, а загальну РНК виділили за допомогою реагенту Easy-Blue® відповідно до інструкцій виробника (Intron Biotechnology; Seongnam, Республіка Корея). КДНК синтезували згідно з раніше повідомленою процедурою [22]. Олігонуклеотидними праймерами для миші PPARγ були ATCGAGTGCCGAGTCTGTGG (вперед) і GCAAGGCACTTCTGAAACCG (реверс); для миші C/EBPα були GGAACTTGAAGCACAATCGATC (вперед) і TGGTTTAGCATAGACGTGCACA (реверс); для мишей SREBP1 були ATCGCAAACAAGCTGACCTG (вперед) і AGATCCAGGTTTGAGGTGGG (реверс); для мишей AMPK були GGTGGATTCCCAAAAGTGCT (вперед) і AAGCAGTGCTGGGTCACAAG (реверс); для GAPDH миші були GACGGCCGCATCTTCTTGT (вперед) і CACACCGACCTTCACCATTTT (в зворотному напрямку). Експресію гена розраховували за методом порівняльного порогового циклу (Ct).
Статистичний аналіз
Кожен результат виражається як середнє значення ± стандартне відхилення (SD) триразових експериментів. Статистичний аналіз проводився за допомогою програмного забезпечення для статистичного аналізу SPSS (версія 19.0; International Business Machines, Армонк, Нью-Йорк, США). Статистично значущі відмінності визначали, використовуючи дисперсійний аналіз та пост-хост-тест Даннета, та P-значення менше 0,05 вважали статистично значущими.
Результати
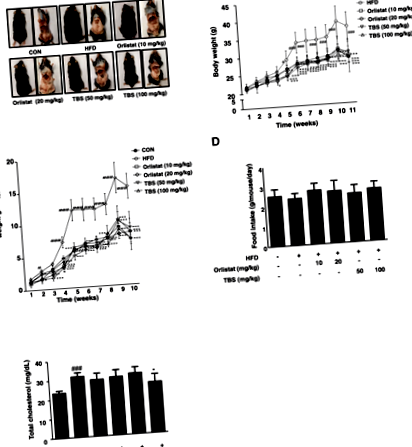
TBS пригнічував розмір жирової тканини та масу тіла у мишей з індукованим HFD ожирінням
TBS пригнічував загальну жирову масу у мишей з індукованим HFD ожирінням
На масу ВАТ впливає адипогенез - основний процес передіадипоцитарної диференціації у зрілі адипоцити [23]. Як показано на рис. 2а та b, була значна різниця у вазі епідидимальної ваги між групою CON та групою HFD. Групи, які отримували TBS, мали значно нижчі ваги, ніж групи HFD. Більше того, також була помітна різниця у вазі вісцерального ВАТ між групою CON та групою HFD. Групи, які отримували TBS, показали значно меншу вагу, ніж група HFD (рис. 2в та d). Маса епідидимальної, вісцеральної та загальної ВАТ зменшилась на 59,56, 64,17 та 55,03% відповідно у групі, яка отримувала TBS (100 мг/кг), порівняно з масою групи HFD (рис. 2).
TBS пригнічував індуковане HFD накопичення ліпідів у жировій тканині епідидиму
Для виявлення ефекту TBS на індуковане HFD накопичення ліпідів в епідидимальній ВАТ, з кожної групи готували зразки жирової тканини і фарбували розчином H&E. Як показано на рис. 3а, результати фарбування H&E для епідидимальної ВАТ з кожної групи, і дані показали, що накопичення ліпідів у епідидимальній ВАТ надзвичайно збільшилось у групі HFD порівняно з групою CON. Однак введення TBS суттєво зменшило накопичення ліпідів у мишей, що годували HFD. По-друге, середній діаметр адипоцитів у епідидимальній ВАТ збільшився у мишей, що годували HFD, і лікування TBS значно зменшило діаметр адипоцитів цих мишей (рис. 3b).
TBS пригнічує індуковану HFD експресію генів, пов’язаних з адипогенезом, у жировій тканині епідидиму
Для дослідження впливу TBS на експресію білка p-AMPK та рівні мРНК AMPK, PPARγ, C/EBPα та SREBP1 в епідидимальній WAT також проводили вестерн-блотинг та qRT-PCR. Як показано на рис. 4а, експресія білка фосфорилювання AMPK Thr172 у групі HFD не відрізнялася від такої у групі CON, тоді як групи, оброблені TBS, значно посилювали експресію p-AMPK Thr172 в епідидимальній ВАТ. Аналогічним чином, лікування TBS у дозі 100 мг/кг суттєво підвищувало рівень мРНК AMPK в епідидимальній ВАТ (рис. 4b). Крім того, спостерігалося збільшення експресії мРНК PPARγ, C/EBPα та SREBP1 групи HFD порівняно з групою CON, тоді як введення орлістату та TBS ефективно знижувало експресію мРНК PPARγ, C/EBPα та SREBP1 у епідидимальна ВАТ (рис. 4c, d та e).
TBS пригнічував індуковане HFD накопичення крапель ліпідів у тканині печінки
Лі та ін. повідомляли, що годування HFD помітно освітлювало колір печінки у моделі безалкогольної жирової хвороби печінки у щурів [24]. Щоб визначити вплив TBS на морфологію тканин печінки, зразки тканин спостерігали за допомогою макроскопічного аналізу. Як показано на рис. 5а, тканина печінки мишей у групі HFD зблідла порівняно з мишами в групі CON. Пероральне введення TBS (50 або 100 мг/кг) суттєво пригнічувало морфологічні зміни, що спостерігаються в тканині печінки, порівняно з такими у групі HFD. Групи, які отримували орлістат, також представили відновлену морфологію тканини печінки. Крім того, зразки тканин фарбували H&E. Як показано на рис. 5b, у групі HFD краплі ліпідів виглядали у вигляді невеликих вакуолей у клітинах печінки. Збільшення крапель ліпідів було більш вираженим у тканині печінки мишей, що належать до групи HFD, ніж у груп, які отримували TBS (50 або 100 мг/кг).
Вплив TBS на морфологію тканини печінки та накопичення ліпідів. (a) Макроскопічний аналіз тканини печінки миші. (b) Тканину печінки представницьких мишей у кожній групі фіксували, вкладали у парафін і фарбували розчином H&E. Зображення демонструються із початковим збільшенням 100x. ПРОТ: нормальна група дієти; HFD: дієтична група з високим вмістом жиру; Орлістат: група HFD плюс орлістат (10 або 20 мг/кг); TBS: група HFD плюс TBS (50 або 100 мг/кг). Шкала шкали становить 100 мкм
TBS пригнічував індуковану HFD експресію генів, пов’язаних з адипогенезом, у тканині печінки
AMPK діє головним перемикачем, який фосфорилює цільові ферменти, пов'язані з метаболізмом ліпідів у багатьох тканинах, включаючи печінку [25]. Експресія PPARγ, C/EBPα та SREBP1 індукується у печінці мишей, індукованих HFD [26,27,28]. У цьому дослідженні експресія білка печінкового p-AMPK та рівня мРНК печінкових AMPK, PPARγ, C/EBPα та SREBP1 досліджувалась у печінці мишей, які отримували HFD плюс TBS за допомогою вестерн-блоттінгу та qRT-PCR, відповідно. Експресія білка фосфорилювання AMPK Thr172 у печінці групи HFD була зменшена у порівнянні з групою CON і групи, оброблені TBS, посилювали експресію p-AMPK Thr172 (рис. 6а). Подібним чином, лікування TBS (100 мг/кг) суттєво підвищувало рівень мРНК AMPK у тканині печінки (рис. 6b). Більше того, експресія мРНК PPARγ, C/EBPα та SREBP1 була регульована вгору в групі HFD порівняно з такою у групі CON, а введення орлістату та TBS значно пригнічувало експресію мРНК печінкового PPARγ, C/EBPα та SREBP1 (рис. 6c, d та e).
Обговорення
Ожиріння - це багатофакторне захворювання, яке характеризується надмірністю ожиріння та надмірним споживанням харчових жирів [29]. Він також характеризується як стан хронічного запалення та гіпоксії жирової тканини, що призводить до порушення регуляції вироблення адипокіну та активації прозапальних шляхів, що може сприяти прогресуванню пухлини [30]. Захворювання, пов’язані з ожирінням, стали основною причиною смерті в сучасному суспільстві, і виявлено, що надмірне харчування пов’язане зі складними видами раку [31]. Відповідно, до ожиріння слід ставитися як до джерела багатьох захворювань. Поширені побічні ефекти традиційних фармакологічних методів лікування ожиріння та супутніх захворювань, такі як гіпертонія, серцева аритмія, запор, головний біль, стеаторея та дефіцит розчинних у ліпідах вітамінів та незамінних жирних кислот, сприяли збільшенню використання традиційних рослинних ліків як спосіб охорони здоров’я для цього стану, що загрожує життю [32]. Отже, природні сполуки, які є відносно безпечними, приділяють увагу лікуванню ожиріння. У цьому дослідженні ми мали на меті оцінити вплив TBS на масу тіла та експресію відповідних генів адипогенезу у мишей із ожирінням, індукованих ожирінням.
TBS - це один із традиційних рецептів азіатської медицини, витягнутий із репрезентативної корейської медичної книги «Donguibogam», і він широко застосовується для лікування дизурії, такої як інфекція сечовидільної системи, конкремент, хілурія та гематурія. Cyperus rotondus Л. і Цитрусові уншіу Маркович, основні компоненти туберкульозу, також є корисними для запобігання набору ваги та ожиріння відповідно [19, 20]. Відповідно, активні компоненти цих трьох трав можуть бути пов’язані з потужним ефектом TBS у мишей із ожирінням, що харчуються HFD.
Печінка здебільшого розглядається як важливий орган метаболізму ліпідів. Дисбаланс між відкладенням та видаленням ліпідів призводить до накопичення ліпідів у печінці, що пов'язано зі збільшенням печінкового ліпогенезу, посиленим поглинанням ліпідів та/або зменшенням експорту β-окислення тригліцеридів [41]. Тканина печінки мишей групи HFD зблідла, тоді як групи, які отримували TBS, покращували цей ознака токсичності тканин печінки (рис. 5а). Як показано на рис. 5b, накопичення ліпідів було сильно індуковане у мишей, які отримували HFD, але воно інгібувалось у мишей, які отримували TBS, як це спостерігається при зменшенні ліпідних крапель тканини печінки. Це означає, що в печінці мишей, які отримували TBS, було менше адипоцитів, ніж у мишей, яких годували HFD. Ці висновки підкреслюють той факт, що TBS також компетентний зменшувати накопичення ліпідів у тканині печінки, а також епідидимальну ВАТ.
У сукупності наші висновки показали, що TBS ефективно пригнічує накопичення ліпідів у печінці та жировій тканині епідидиму. Відновлення експресії AMPK, PPARγ, C/EBPα та SREBP1 бере участь у механізмі, що лежить в основі антиадипогенезних ефектів TBS (рис. 7). Враховуючи все це, подальші дослідження можуть сприяти нашому теперішньому усвідомленню ефективності ТБС, і використання ТБС як корисного кандидата для контролю ожиріння слід вивчати далі.
Механізм TBS. Ін’єкції TBS суттєво зменшували накопичення ліпідів, регулюючи експресію AMPK, PPARγ, C/EBPα та SREBP1 у печінці та білій жировій тканині епідидимальної тканини на ожиріній миші, індукованій HFD
- Вплив розширеної моделі паралельного процесу на повних солдатів; знання, ставлення та
- Аналіз транскриптома та метилому ДНК в мишачій моделі прогнозу ожиріння, спричиненого дієтою
- Молекулярні механізми наслідків потомства від ожиріння - FullText - Факти ожиріння 2013
- Вплив ожиріння матері на вивільнення ДНК без клітин плаценти в моделі миші - PubMed
- Вплив антиоксидантної добавки на мишачу модель хвороби Альцгеймера; Новини; Коледж ім