Взаємодія білків і полісахаридів
Пов’язані терміни:
- Біополімер
- Казеїн
- Пектин
- Полімери
- Краплі
- Білки
- Полісахариди
- Молочні білки
- Біополімери
Завантажити у форматі PDF
Про цю сторінку
Нанотехнології для харчових продуктів
III Використання білків у наномасштабних системах доставки
Використання взаємодії білок-полісахарид для формування інкапсуляційних систем, заснованих на коацервації, було зменшено до наномасштабу Хуангом та Цзянгом (2004). Їх дослідження з приводу оздоровчих флавоноїдів було зосереджено на найбільш активній формі, що міститься у зеленому чаї, епігалокатехінгалаті (EGCG). Зелений чай давно використовується як напій, але низька біодоступність завжди є проблемою. Тому ця група запропонувала інкапсуляцію чайних катехінів для підвищення їх стабільності та біодоступності. Вони використовували коацервати, утворені білково-полісахаридними комплексами, як недорогий метод інкапсуляції катехінів зеленого чаю на мікро- та нанорозмірному рівні.
Ю та ін. (2005) застосували пептидні нанотрубки як опори для іммобілізації ферментів. Вони капсулювали ліпазу всередину пептидних нанотрубок і виявили, що каталітична активність пов'язаних з нанотрубками ферментів насправді була вищою (> 33%), ніж вільна ліпаза при кімнатній температурі. Цікаво, що при 65 ° C активність ліпази в нанотрубках була на 70% вищою порівняно з вільними ліпазами. Вони показали, що фермент всередині нанотрубки може бути перероблений шляхом виготовлення магнітних нанотрубок із використанням суперпарамагнітних нанокристалів FePt, іммобілізованих на зовнішній стороні пептидних нанотрубок. Вони припустили, що посилення активності ліпаз у пептидних нанотрубках, ймовірно, індукується зміною конформації ліпаз у відкриту форму (ферментативно активна структура), оскільки ліпази адсорбуються на внутрішніх поверхнях пептидних нанотрубок.
Нохіро та ін. (2006) використовували казеїн для утворення нанорозмірних білкових міцел для утримання гідрофобних речовин. Група використовувала трансглутаміназу для утворення інцепсованих ANS міцел казеїну з розміром частинок 36 нм, які зберігали ≥50% ANS при обробці трипсином. Цей метод корисний для виготовлення прозорих пересичених розчинів шляхом солюбілізації гідрофобних речовин у функціональних продуктах харчування та фармацевтичних препаратах.
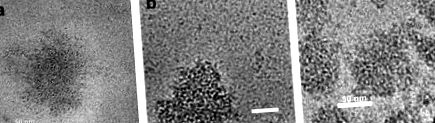
Одне з останніх понять, представлене Семо та співавт. (2006; керівник Ю. Лівні) - використання самозбірних міцел казеїну як нанокапсулярних носіїв. Автори зрозуміли, що міцели казеїну (СМ) є фактично нанокапсулами, створеними природою для доставки поживних речовин, таких як кальцій, фосфат та білок, до новонародженого. Таким чином, вони запропонували використовувати СМ як самостійно зібрану систему для нанокапсуляції та стабілізації гідрофобних нутрицевтичних речовин для збагачення харчових продуктів. Вітамін D2 використовували як модель гідрофобних нутрицевтичних сполук. D2-rCM та rCM мали подібну морфологію, яка також була типовою для природних СМ, як показано на мікрофотографіях Cryo-TEM (рис. 23.2).
Малюнок 23.2. Зображення Кріо-ТЕМ: (a) повторно зібраний CM (rCM), (b) вітамін D2, що містить rCM (D2-rCM), (c) природний CM у знежиреному молоці (неопубліковані набори; люб’язно надано доктором Лівні та доктором Даніно, Факультет біотехнології та харчової інженерії).
Повторно зібрані міцели мали середній діаметр 146 і 152 нм з і без вітаміну D2 відповідно, подібні до нормальних СМ, які зазвичай складають в середньому 150 нм. Було продемонстровано, що нутрицевтичну сполуку можна завантажувати в СМ, використовуючи природну тенденцію самозбірки бичачих казеїнів. Концентрація вітаміну в міцелі була приблизно в 5,5 разів більша, ніж у сироватці. Навіть у сироватці крові вітамін D2 містився лише у зв’язку з залишковими розчинними казеїнами. Дуже цікавим спостереженням було те, що морфологія та середній діаметр повторно зібраних міцел були подібними до таких у природних СМ. Частковий захист від руйнування вітаміну D2, спричиненого УФ-світлом, забезпечували міцели. Отже, це дослідження продемонструвало, що КМ може бути корисним як нанотранспортні засоби для закріплення гідрофобних нутрицевтиків у харчових продуктах. Такі нанокапсули можуть бути включені в молочні продукти, не змінюючи їх сенсорних властивостей.
Нещодавно Livney and Ron (2007) продемонстрували використання комплексів β-лактоглобулін – полісахариди для транспортування гідрофобних нутрицевтиків. Автори скористалися здатністю бета-лактоглобуліну зв'язувати гідрофобні молекули та додали вторинний захисний шар шляхом його комплексування із зарядженим полісахаридом. Вони показали, що, ретельно контролюючи дзета-потенціал частинки, можна отримати стабільний нанорозмірний носій. Однак слід зазначити, що в таких випадках навантаження біоактивної речовини у міхур було низьким, і ефект стабілізації ще не продемонстрований. Проте цей розумний контроль фізичних властивостей системи є чудовим прикладом для складання нанорозмірної капсульованої бульбашки, заснованої на контролі фізичних властивостей.
Том 2
Наташа Наяк, Харджиндер Сінгх, в Енциклопедії харчової хімії, 2019
Фактори, що впливають на взаємодію білків і полісахаридів
Фактори, що впливають на природу взаємодії білка ‒ полісахаридів та відповідні структури, що утворюються на основі цих взаємодій, можна класифікувати як зовнішні, внутрішні та переробні фактори. Ці фактори можна варіювати, щоб отримати бажані функціональні можливості для спеціальних програм (Таблиця 1).
Таблиця 1. Фактори, що впливають на взаємодію білка молока і полісахаридів
| Зовнішній | Коефіцієнт змішування (r) | Впливає на структуру утворених комплексів або коацерватів. Менший r призводить до утворення коацерватів, які швидко зливаються, тоді як вищий r - більш стабільних коацерватів. |
| Молекулярна концентрація | Коацервація може відбуватися у дуже розбавлених розчинах, тоді як термодинамічна несумісність сприяє більш концентрованим системам. | |
| рН | При рН> ізоелектричній точці (pI) білка виникає відштовхування між білком і полісахаридом. Поблизу pI утворюються розчинні комплекси, тоді як подальше зниження рН призводить до утворення коацерватів. | |
| Іонна сила | При високій концентрації солі мікроіони спричиняють зменшення електростатичної взаємодії, тоді як при низькій іонній силі перешкоди утворенню білково-полісахаридного комплексу мінімальні. | |
| Щільність заряду | Коацервація не відбувається при низькій густині заряду, тоді як осадження міжполімерних комплексів відбувається при дуже високій щільності заряду. Характер групи заряду (карбонільний проти сульфатований) впливає на силу взаємодії. | |
| Властивий | Молекулярна конформація | Підвищена гнучкість ланцюга та підвищена рухливість заряду призводять до міцнішого зв’язування. |
| Розподіл заряду | Рівномірно заряджені ланцюги утворюють великі однорідні фази, тоді як нерівномірний розподіл заряду призводить до утворення мезофази з міцелярною структурою. | |
| Молекулярна маса | Внутрішню структуру та кінцевий розмір комплексів/коацерватів можна контролювати, регулюючи молекулярну масу поліелектроліту. | |
| Обробка | Ножиці | Зсув може або спричинити реструктуризацію утворених комплексів, або може стабілізувати коацервати проти флокуляції. |
| Тиск | Тиск викликає часткову денатурацію білка, що посилює взаємодію під час утворення комплексу. | |
| Температура | Теплова денатурація збільшує молекулярну гнучкість, що призводить до сильніших електростатичних взаємодій, отримуючи більш стабільні комплекси. | |
| Підкислення | Тип використовуваного методу підкислення, наприклад, соляна кислота або глюконо-дельта-лактон, впливає на структуру утворених комплексів. |
Syrbe та співавт. (1998) виклали деякі основні правила для розуміння сукупного впливу рН та іонної сили на поведінку змішування білків-полісахаридних систем. Для білково-неіоногенних полісахаридних систем рН та іонна сила впливають лише на самоасоціацію білка. Несумісність безпосередньо корелює із самоасоціацією білка, яка є найвищою при pI білка і зменшується у напрямку до кислого та лужного рН. У змішаних системах несумісність у діапазоні рН, близькому до pI, пов’язана з низькою іонною силою, де обидва біополімери незаряджені, різниця в щільності заряду дорівнює нулю, а наявність солі пригнічує білкову самоасоціацію. Наявність заряджених карбоксильованих або сульфатованих груп призводить до того, що іонні полісахариди мають аніонну природу в діапазонах рН, що мають значення для їжі, де відбувається комплексоутворення з позитивно зарядженим білком.
Білково-полісахаридні взаємодії та перетравлення складних частинок
Вступ
В даний час існує значний інтерес до захисту біоактивних молекул від викидів у шлунку або кишечнику (Singh and Horne, 2009). У той же час добре відомо, що велика кількість полісахаридів (декстран, хітозан, хімічно модифікований крохмаль, альгінати, пектини, карагенан, ксантан та ін.) Стійкі до дії шлункових та кишкових ферментів та бактерій, хоча вони є специфічно гідролізується лише бактеріями товстої кишки. Отже, ці властивості полісахаридів можуть бути корисними, наприклад, для розробки покриттів та матричних матеріалів для специфічної доставки біоактивних молекул до товстої кишки (Macleod et al., 1999; Vandamme et al., 2002).
З літературних даних можна розпізнати два основних підходи до використання взаємодій білок-полісахарид для розробки чутливих до подразників «перемикаються» носіїв. Одним з них, яке було широко досліджено, є використання гідрофільних або гідрофобних одношарових або багатошарових покриттів на поверхнях крапель в (макро) емульсіях (розмір> 0,5 мкм), які можуть бути використані для мікрокапсулювання гідрофобних та/або гідрофільних нутрицевтиків (Бенічу та ін., 2004; McClements et al., 2008, 2009; Григор'єв та Міллер, 2009). Наприклад, Benichou et al. (2004) продемонстрували, що електростатичні комплекси ізоляту сироваткового білка (WPI) із ксантановою камедю можуть бути успішно використані як для ефективного багатошарового покриття крапель множинних (подвійних) емульсій, так і для контрольованого вивільнення вітаміну В1, захопленого у внутрішню водну фазу такого крапель при зміні рН зовнішньої водної фази.
Іншим перспективним підходом є використання нанокомплексів білок-полісахарид для захоплення біоактивних сполук. Zimet і Livney (2009) успішно застосували цей підхід для захоплення докозагексаєнової кислоти (DHA), використовуючи електростатичні нанокомплекси β-лактоглобуліну з низьким вмістом метокси пектину. Встановлено, що нанокомплекси мають виняткову колоїдну стабільність (дзета-потенціал більше негативний ніж -50 мВ, середній розмір частинок ≈100 нм) та захисну здатність від окислення DHA під час прискорених стрес-тестів: лише ≈5–10% втрачені протягом 100 годин при 40 ° C, порівняно з ≈80%, коли спостерігався незахищений DHA (Zimet і Livney, 2009).
Всі ці дані чітко показують, що взаємодії білок-полісахариди можуть бути використані як перспективний інструмент для регулювання здатності білок-полісахаридів поводитися як нанотранспорт для контрольованої доставки різних видів нутрицевтиків у певному місці дії із визначеною швидкістю, та/або у відповідь на певний тригер середовища (рН, іонна сила, температура, ферментативна дія).
Нанорозмірні розміри таких нанотранспортних засобів, типові для біополімерних молекул/асоційованих речовин, можуть запропонувати додаткові переваги, оскільки, як пропонував Акоста (2009), розмір систем доставки, особливо нижче 500 нм, дозволив обіцяти вирішити проблему. проблеми низької оральної біодоступності або неефективної доставки погано розчинних у воді нутріцевтиків/препаратів. Це є наслідком вдосконалення, заснованого на наступних факторах (Акоста, 2009; Семенова та Дікінсон, 2010): (1) очевидна розчинність активних інгредієнтів; (2) швидкість масообміну; (3) час утримання шлунково-кишкового тракту у слизу, що покриває кишковий епітелій; (4) швидкість викиду (через велику площу поверхні); та (5) безпосереднє поглинання частинок епітелієм кишечника (Horn and Rieger, 2001; Chen et al., 2006; Medina et al., 2007).
Дослідницька діяльність у галузі розробки систем доставки наночастинок для мікроелементів та нутрицевтиків, які можуть бути включені в харчові продукти, зросла майже в геометричній прогресії протягом останнього десятиліття (Ransley et al., 2001; Velikov and Pelan, 2008; McClements et al., 2008, 2009; Faulks and Southon, 2008; Augustin and Hemar, 2009; Semenova and Dickinson, 2010; Semenova et al., 2012). Однак фізико-хімічні фактори, що впливають як на сприйнятливість наноносіїв біополімерного комплексу до ферментативної дії в умовах змодельованих ГІ, так і на контрольоване вивільнення (біодоступність) захоплених нутрицевтиків з них досі чітко не зрозумілі.
У цій роботі зроблена спроба з'ясувати структурну основу, що лежить в основі засвоюваності (під дією шлункових та кишкових ферментів в модельованих умовах ШКТ in vitro) білково-полісахаридних нанокомплексів із залученням соєвого фосфатидилхоліну (ПК). Паралельно шукається більш проникливе розуміння загальності та відмінностей у поведінці нанокомплексів у шлунково-кишковому тракті in vitro на основі різних видів взаємодій білок-полісахариди, зокрема електростатичної (SCN + декстрансульфат) та ковалентної склеювання (SCN + MD).
Відзначається, що вибір поліненасиченого ПК (Lipoid S100 (лецитин)) як нутрицевтику зумовлений його властивостями як антивіковий засіб, чудовий захисний засіб проти пошкодження печінки (Kidd, 1996, 2000) та постачальник необхідних поліненасичені жирні кислоти (понад 80% легко окислюваних ненасичених вуглеводневих ланцюгів таких незамінних жирних кислот, як олеїнова, лінолева та ліноленова, табл. 6.1). Більше того, ПК також представляв інтерес, оскільки він може утворювати у водному середовищі ліпосоми, що реагують на навколишнє середовище, що може бути перспективним як додатковий носій як гідрофобних, так і гідрофільних здорових харчових інгредієнтів та ліків (Gennis, 1989).
Таблиця 6.1. Хімічний склад фосфатидилхоліну (ПК) (Lipoid S 100, Lipoid GmbH, Німеччина)
- Овес - огляд тем ScienceDirect
- Майонез - огляд тем ScienceDirect
- Заправка салату - огляд тем ScienceDirect
- Лист червоної малини - огляд тем ScienceDirect
- Картопляний крохмаль - огляд тем ScienceDirect