Вплив гіперфібриногенемії на судинну систему мишей C57BL/6 з атерогенною дієтою та без неї
З навчальної програми з генетики та молекулярної біології (A.A.G., S.T.L.), кафедра біостатистики (C.M., T.S., G.K.) та кафедра патології та лабораторної медицини (S.T.L.), Університет Північної Кароліни, Чапел-Хілл.
З навчальної програми з генетики та молекулярної біології (A.A.G., S.T.L.), кафедра біостатистики (C.M., T.S., G.K.) та кафедра патології та лабораторної медицини (S.T.L.), Університет Північної Кароліни, Чапел-Хілл.
З навчальної програми з генетики та молекулярної біології (A.A.G., S.T.L.), кафедра біостатистики (C.M., T.S., G.K.) та кафедра патології та лабораторної медицини (S.T.L.), Університет Північної Кароліни, Чапел-Хілл.
З навчальної програми з генетики та молекулярної біології (A.A.G., S.T.L.), кафедра біостатистики (C.M., T.S., G.K.) та кафедра патології та лабораторної медицини (S.T.L.), Університет Північної Кароліни, Чапел-Хілл.
З навчальної програми з генетики та молекулярної біології (A.A.G., S.T.L.), кафедра біостатистики (C.M., T.S., G.K.) та кафедра патології та лабораторної медицини (S.T.L.), Університет Північної Кароліни, Чапел-Хілл.
Ви переглядаєте останню версію цієї статті. Попередні версії:
Анотація
Завдання— Підвищений рівень фібриногену корелює з важким атеросклерозом, що визначається появою ішемічних подій, проте механістична основа цієї кореляції залишається невідомою. Для вивчення цього взаємозв'язку ми дослідили спонтанний та індукований дієтою атеросклероз у трансгенних мишей з гіперфібриногенемією (підвищений фібриноген).
Методи та результати - Звичайних і трансгенних мишей годували або атерогенною дієтою, або простою селекційною чау. Ми виміряли рівень фібриногену в плазмі крові та виявили вікове та залежне від дієти збільшення фібриногену. Через 8-12 місяців проводили підготовку та фарбування зрізів аорти, а також підраховували, вимірювали та оцінювали зрілість уражень, що містять ліпіди. Заповнені ліпідами відкладення спонтанно з’явились у невеликої кількості мишей на селекційній чау; типові ураження жирового прожилка з'явилися майже у всіх тварин, що харчуються дієтою. Морфометричний аналіз показав, що ні на кількість, ні на розмір уражень не впливали ні рівень фібриногену, ні генотип.
Висновки - Наші дані показали, що ні концентрація фібриногену, ні генотип не мали статистично значущого впливу на ініціювання, початковий ріст або раннє прогресування атеросклеротичних уражень.
Добре відомо, що підвищений рівень фібриногену корелює з важким атеросклерозом, що визначається появою ішемічних подій. Першим великим дослідженням, яке повідомило про цю кореляцію, було дослідження серця Нортвік-Парку, в якому в 1980 р. Meade та співавт. 1 продемонстрували значну зв'язок між серцево-судинною смертю та концентрацією фібриногену, яка не залежала від інших факторів ризику. З тих пір багато звітів пов’язують підвищений рівень фібриногену з усіма формами серцево-судинних захворювань (ССЗ). Дослідження Caerphilly/Speedwell показали, що підвищений рівень фібриногену корелює з ішемічною хворобою серця. 2 Дослідження в Гетеборзі повідомляло, що фібриноген асоціюється з інфарктом міокарда та інсультом, ішемічною хворобою серця та загальною смертністю. 3 Фрамінгемське дослідження показало, що різні ССЗ мають кореляцію з фібриногеном, включаючи інсульт, ішемічну хворобу та оклюзійну хворобу периферичних артерій. 4,5 Оскільки численні дослідження підтвердили ці висновки (див. Огляд 6), немає сумнівів у тому, що підвищений фібриноген у плазмі корелює із ССЗ.
Патологічний механізм, який пов'язує гіперфібриногенемію з підвищеним ризиком клінічно очевидного атеросклерозу, залишається невідомим. Однією з гіпотез є припущення про вплив фібриногену на гладком’язові клітини (СМК) та ендотеліальні клітини, в яких фібриноген діє як попередня матриця для міграції, а продукти розпаду фібрину (огену) діють як мітогени. 7 Ці механізми дозволяють припустити, що підвищений фібриноген сильно впливає на 2 клітини, які беруть участь у формуванні уражень. І навпаки, підвищений рівень фібриногену може бути наслідком атеросклерозу, оскільки фібриноген є білком гострої фази, і його рівень зростає у відповідь на захворювання. Звичайно, підвищений рівень фібриногену може бути як причиною, так і наслідком атеросклеротичної хвороби.
Щоб забезпечити експериментальну систему для вивчення механістичних основ зв'язку між підвищеним фібриногеном та ССЗ, ми генерували трансгенних мишей з гіперфібриногенемією. У цьому дослідженні ми використовували їх для визначення того, чи підвищений рівень фібриногену впливає на атеросклероз, викликаний дієтою у мишей. Ми обрали дієтичну модель для вивчення ініціації та раннього розвитку атеросклерозу, оскільки ми передбачали, що підвищений рівень фібриногену сприятиме патогенезу захворювання. Хоча індуковані дієтою ураження не прогресують до пізніх стадійних бляшок, ураження жировими прожилками в проксимальній аорті нормальних мишей подібні до дуже ранніх уражень у людей. 8 Ураження на нашій миші були досліджені на предмет зміни ініціації, обтяження та зрілості, які зумовлені рівнем генотипу або фібриногену.
Методи
Матеріали
Хімічні речовини купували у Sigma Chemical Co, якщо не зазначено інше. Анестезуючі препарати були придбані у компанії Barber Veterinary Supply. Кролячі антитіла до людського фібриногену були від Dako Corp. Матеріали для забору крові, зрізу та фарбування були від Fisher. Заводчик чау був Picolab Mouse Diet 20 (№ 5058 опромінений) від Purina-Mills; атерогенна дієта (TD 88051) була від Харлан/Теклад.
Трансгенні тварини
Усі процедури за участю мишей були схвалені Інституційним комітетом з догляду та використання тварин. Мишей утримували в повнобар'єрному приміщенні в стерилізованих клітках. Як описано раніше, ми генерували трансгенних мишей шляхом мікроін'єкції локусу фібриногену миші в ооцити C57BL/6. 9 Трансген являв собою фаговий клон Р1 з 80-кілобайтною вставкою 129 геномних ДНК SvEv, включаючи 50-кілобазний фібриногенний локус (α, β та γ), фланкирований на 5 і 25 кб. Трансгенних мишей ідентифікували за допомогою полімеразної ланцюгової реакції. Ми встановили позитивну лінію трансгенного фібриногену (FT +), у якій концентрація фібриногену в плазмі майже вдвічі перевищувала концентрацію нормальних мишей C57BL/6. У цих тварин відсутні дефекти родючості і тромботичні захворювання, і вони живуть нормально. 9
Експериментальний дизайн
Мишей до нашої ери годували заводчиком чау до евтаназії через 8 місяців (миші BC8) або 12 місяців (миші BC12); чау-селекціонер містив стандартні поживні речовини плюс 9% жиру і 20% білка. Мишей AD годували селекційним чау протягом 4 місяців, а потім годували атерогенною дієтою до евтаназії через 4 місяці (миші AD4, вік 8 місяців) або 6 місяців (миші AD6, вік 10 місяців) на дієті; ця атерогенна дієта, розроблена Пейгеном та співавт., 8 містила стандартні поживні речовини плюс 15,8% жиру, 1,25% холестерину та 0,5% холату натрію. Кров відбирали у всіх тварин щомісяця, починаючи з 2 місяців (миші до нашої ери) або через 4 місяці (у мишей з AD, за 1 день до початку атерогенної дієти).
Плазмові аналізи
Тварин голодували протягом 4-6 годин і знеболювали кетаміном/ксилазином (0,31 мл/0,11 мл, доведені до 1 мл у стерильному фізіологічному розчині), виходячи з ваги (0,1 мл/30 г). Кров брали з ретро-орбітального простору і центрифугували при 15000 об/хв протягом 15 хвилин, а супернатант плазми зберігали при -80 ° C. Рівні фібриногену визначали методом ІФА. 9 Загальний холестерин визначали за допомогою модифікації набору загального холестерину Wako CII. Коротко кажучи, у 96-лунковому планшеті 100 мкл хромогенного розчину субстрату/ферменту змішували з 1 мкл зразка (у двох примірниках). Через 10 хвилин при 37 ° C планшет зчитували при 550 нм. Загальний холестерин у міліграмах на децилітр визначали як середню оптичну щільність зразка, поділену на середню оптичну щільність стандарту.
Підготовка та вимірювання аортальних зрізів
Після того, як мишам знеболили (див. Плазмові аналізи), серце було перфузовано через лівий шлуночок 10 мл свіжого 4% параформальдегіду. 10 Тканину фіксували in situ протягом> 24 годин. Аорти обробляли та оцінювали, як описано Paigen et al 8 та модифіковано Reddick et al. 10 Коротко кажучи, серце розрізали в площині безпосередньо під 2 передсердями, як показано на малюнку 2А. Синус верхньої частини серця/аорти був вбудований у сполуку ОСТ, заморожений та серійно розрізаний (товщиною від 6 до 8 мкм). Розділи були ідентифіковані за місцем розташування, зображеним на малюнку 2А (тобто розділи 1, 2, 3 або 4). 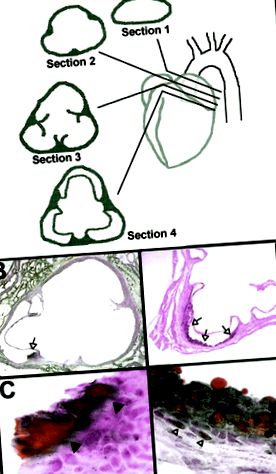
Малюнок 2. Гістологія ураження. Аорти розрізали у вигляді діаграм і фарбували Суданом IV та гематоксиліном. A, аортальний синус, перерізаний у площині, паралельній лінії, проведеній між днищами обох передсердь. Розділ 1 знаходиться поза межами серця. Розділ 2 показує місця кріплення клапанів. У розділі 3 показані шматки клапанів та місця кріплення. Розділ 4 показує комплектні клапани/насадки. B, Розділ 4 (оригінальне збільшення × 2) від миші FT +/BC, на якому зображено забруднений Судан IV (відкрита стрілка). C, Вище збільшення (оригінальне збільшення × 40) ураження, показаного на панелі B. Внутрішня межа відкладення ліпідів позначена закритими наконечниками стрілок. D, Розділ 4 (оригінальне збільшення × 4) миші FT−/AD, що показує ураження жирової смуги, що простягається від однієї заслінки клапана до наступної (відкриті стрілки, оригінальне збільшення × 4). E, Вище збільшення (початкове збільшення × 40) ураження, показаного на панелі D. Пінопластові клітини (закриті стрілки) та насичені холестерином SMC (відкриті наконечники стрілок) чітко видно.
Зрізи фарбували Суданом IV (для ліпідів) та гематоксиліном за стандартними методами фарбування. Після захоплення зображення зі збільшенням × 2 площу ураження вимірювали, використовуючи або NIH Image (версія 1.62), або Scion Image (версія beta 3b). Слайди розділу 4 від AD4 та відібраних мишей BC8 були імуно забарвлені антитілом до людського фібриногену.
Статистичний аналіз
Узагальнені оцінювальні рівняння (GEE) використовувались для того, щоб індивідуально враховувати всі моменти часу, одночасно враховуючи кореляцію між мишами. Моделі GEE дозволяють оцінювати закономірності в часі, а також коваріати, такі як холестерин, фібриноген та генотип.
Результати
Експериментальний дизайн
Як описано в Методах, протягом усього експерименту тварин або утримували на селекційному чау (група BC), або годували атерогенною дієтою (група AD), починаючи з віку 4 місяців. Миші BC служили контролем для групи AD та експериментальними тваринами для оцінки спонтанного атерогенезу. Результати повідомляються як генотип/група дієт: FT +/BC8 (n = 21) та FT−/BC8 (n = 20), FT +/BC12 (n = 19) та FT−/BC12 (n = 18), FT +/AD4 (n = 20) і FT−/AD4 (n = 20), і FT +/AD6 (n = 15) і FT−/AD6 (n = 12).
Рівні холестерину в плазмі крові у мишей на нормальних та атерогенних дієтах
Рівні холестерину представлені на малюнку 1А, де дані зліва від вертикальної смуги були отримані від усіх мишей, а дані праворуч від мишей, евтаназованих у віці 10 (миші AD6) або 12 (миші BC12) місяців. Усі миші починали з однаковим рівнем холестерину. Для мишей BC через 2 місяці середній рівень холестерину становив 118 ± 29 мг/дл у мишей FT + (відкриті кола) та 114 ± 21 мг/дл у мишей FT− (заповнені кола). Через 8 місяців середній рівень холестерину у мишей BC не суттєво змінився для жодного генотипу: 121 ± 34 мг/дл для мишей FT + та 123 ± 32 мг/дл для мишей FT−. З 9 місяця до евтаназії середній рівень холестерину у мишей BC постійно підвищувався, кінцеві рівні становили 168 ± 28 мг/дл для мишей FT + та 171 ± 50 для мишей FT−. Таким чином, через 12 місяців чау-селекції рівні холестерину у всіх мишей були значно підвищені відносно початкових рівнів (P
Фігура 1. Плазмові значення холестерину та фібриногену. Вимірювали рівень холестерину (А) або фібриногену (В) щомісяця, починаючи з 2 місяців (група BC) або через 4 місяці (група AD). Смуга в 8 місяців відображає евтаназію мишей BC8 і AD4. Дані ліворуч від цього стовпчика - від усіх мишей, а праворуч - лише від мишей BC12 та AD6. Заповнені кола означають мишей FT−/BC (n = 38/18, загальна кількість/BC12); відкриті кола, миші FT +/BC (n = 40/19); заповнені квадрати, миші FT−/AD (n = 32/12, всього/AD6); і відкриті квадрати, миші FT +/AD (n = 35/15).
Гістологія ураження
При евтаназії синус аорти розрізали (малюнок 2А) і фарбували Суданом IV для виявлення ліпідвмісних уражень. Як було описано раніше, 8,11,12 більшість уражень було виявлено в розділі 4. Репрезентативні зразки розділу 4 показані на малюнках 2B-2E. Зафарбована Суданом IV зона в аорті від миші FT +/BC показана в × 2 (Малюнок 2B) та × 40 (Малюнок 2C) оригінальні збільшення. Це ураження не мало характеристик жирової смуги, як визначено Старі та співавт. 13, оскільки не було внутрішньоклітинного накопичення ліпідів (порівняйте з малюнком 2Е). Ці відкладення ліпідів були лише у мишей BC, в тих самих місцях (основа клапанів), як жирові прожилки у мишей AD. З віком у цих мишей розвивалося більше мишей, і їх розмір, але не кількість, збільшувався. Хоча ураження подібного характеру не були описані, ми оцінили їх як ураження у мишей до нашої ери. Такі ураження можуть бути пов’язані з багатою дієтою чау-селекціонерів.
Область, зафарбована Суданом IV в аорті миші FT−/AD6, показана з початковим збільшенням × 4 (малюнок 2D) та × 40 (малюнок 2Е). На відміну від уражень BC, це ураження мало особливості жирової смуги, включаючи круглі пінопластові клітини в інтимі (закриті стрілки на малюнку 2E) та SMC з цитоплазматичними відкладеннями холестерину (відкриті наконечники стрілок на малюнку 2E). Усі ураження у тварин з АД були класичними жировими прожилками, хоча жодне з них не мало фіброзних ковпачків. Це означає, що підвищений рівень фібриногену не впливав на розвиток або прогресування уражень, спричинених дієтою.
На додаток до плям Судану IV, зразки 4 зразків мишей BC8 та AD4 були імуно забарвлені поліклональними антитілами до людського фібриногену. Незважаючи на те, що фарбування аналогічного зрізу 4 з апоЕ нульової миші 10 продемонструвало фібрино-антигени при більш розвинених ураженнях, ми не виявили фібрино-антигени ні в відкладах ліпідів, ні в ураженнях жирової смуги (дані не наведені).
Морфометричний аналіз
Ми дослідили зрізи у 79 мишей і оцінили всі ділянки, пофарбовані Суданом IV, як ураження. Більшість з 36 мишей, яких годували лише селекційними чау (13 з 19 мишей до н. Е. 8 мишей і 10 з 17 мишей до н. Е.), Не мали уражень. За одним винятком, інші миші BC мали лише 1 ураження, завжди в розділі 4. Виняток, миша FT−/BC8, мав 3 ураження в розділі 4. Середня кількість уражень на миші BC, включаючи мишей без уражень, становить представлені в таблиці 1; це число було завжди
ТАБЛИЦЯ 1. Номер та площа ураження, враховуючи всіх експериментальних тварин
ТАБЛИЦЯ 2. Номер та площа ураження, враховуючи лише тварин, які зазнали ураження
Для кожної миші площа ураження визначалася як сума площ кожного окремого ураження в мікрометрах у квадраті. Середні значення для всіх мишей представлені в таблиці 1, а середні значення лише для мишей з ураженнями представлені в таблиці 2. Оцінка всіх тварин дозволила оцінити загальний тягар ураження на основі охопленої площі, тоді як оцінка лише мишей з ураженнями надав інформацію про якість самих уражень. Для мишей, яких годували чау-селекціонером, у 4 з 6 мишей BC8 та 4 з 7 мишей BC12 загальна площа ураження становила 3 мкм 2, при цьому найменша площа становила 1,1 × 10 3 мкм 2. Решта мишей мали загальну площу ураження> 3 × 10 3 мкм 2, при цьому найбільша загальна площа становила 1,0 × 10 4 мкм 2. Площа ураження у мишей, які харчувались атерогенною дієтою, була в 10 разів більша. Розділ 4 у 21 з 24 мишей AD4 з ураженнями мав загальну площу ураження 4 мкм 2 (найменша площа ураження становила 0,5 × 10 3 мкм 2); У 3 мишей загальна площа ураження> 3 × 10 4 мкм 2 (найбільша - 4 × 10 4 мкм 2). Через 6 місяців на атерогенній дієті ділянки ураження були більшими: 6 з 14 мишей AD6 мали зони ураження 4 мкм 2, а 8 з 14 мишей AD6 мали зони ураження> 3 × 10 4 мкм 2 .
RANCOVA було застосовано до 3 моделей, обговорених у Методах. Ці аналізи проводили двічі з використанням або всіх тварин в експериментальній популяції, або лише тих тварин, у яких були ураження. Аналіз всієї популяції експериментальних тварин дає змогу вказати на вплив фібриногену на ініціювання або локалізацію уражень, що розвиваються. Оцінюючи лише ненульових тварин, аналіз даних додатково ілюструє вплив фібриногену на область ураження, кількість ураження або зрілість ураження. Ми включаємо дані обох аналізів (таблиці 1 та 2), оскільки відмінності в цих цифрах підкреслюють вплив включення мишей без уражень чи ні. Ці колективні аналізи свідчать про те, що ні генотип, ні середні значення фібриногену не впливали ні на загальну площу (діапазон P= 0,097 - 0,980) або число (діапазон P= Від 0,102 до 0,941) уражень у розділі 4 мишей BC або розділах 2-4 мишей AD. Ці дані чітко не вказують на значну різницю між числом або площею ураження та рівнем генотипу або фібриногену.
Обговорення
Таким чином, наші дані вказують на те, що в нашій мишачій моделі фібриноген не грав жодної ролі в індукції, обтяженні або прогресуванні ранніх атеросклеротичних уражень. Хоча в цьому дослідженні вивчався лише ранній атеросклероз, цей висновок, судячи з усього, суперечить великій кількості епідеміологічних звітів про захворювання людей. Ці звіти виявили, що гіперфібриногенемія пов’язана з посиленим атеросклерозом на всіх стадіях та у всіх частинах судинного дерева (коронарних, сонних та периферичних). 6 Наші результати більш відповідають результатам Xiao et al., 14, які виявили, що дефіцит фібриногену не змінює розвиток атеросклеротичного ураження на мишачій моделі. Злучивши нульових мишей фібриногену з нульовими мишами ApoE, вони змогли вивчити вплив дефіциту фібриногену на розвиток атеросклерозу, що розвинувся. Їх результати показали, що у нульових мишей apoE фібриноген не потрібен для розвитку атеросклеротичної хвороби, що розвинулася, а також дефіцит фібриногену не впливає на формування, розмір та морфологію уражень. Ці комбіновані дослідження на мишах припускають, що підвищений рівень фібриногену у людей може бути відповіддю на захворювання, але не може безпосередньо змінювати ріст і розвиток атеросклеротичного ураження.
Отримано 5 вересня 2002 р .; редакція прийнята 25 вересня 2002 р.
Цю роботу підтримав грант Національного інституту охорони здоров’я HL-52706. Ми вдячні Шін Джа Кім за підготовку заморожених зрізів та доктору Роберту Багнеллу за допомогу у мікроскопії. Ми також дякуємо докторам Вірджинії Годфрі та Нобуйо Маеді за поради протягом усієї роботи та за критичне прочитання рукопису.
- Вплив Momordica charantia на резистентність до інсуліну та вісцеральне ожиріння у мишей на дієті з високим вмістом жиру
- Вплив вмісту β-глюкану та перлів ячменю на ожирених мишей, що викликаються дієтою. - Аое - 2017 - Зернові
- Вплив преадипоцитів, отриманих від мишей, що харчуються з високим вмістом жиру, на ангіогенний потенціал
- Вплив хронічного психічного стресу та атерогенної дієти на імунно-запальне середовище в Росії
- Фруктоза та токсична дія цукру - дієта лікар