Дієта матері під час вагітності пов’язана з мікробіомом дитячого стільця залежно від режиму пологів
Анотація
Передумови
Мікробіом кишечника відіграє важливу роль у здоров’ї немовлят та розвитку імунітету, і на нього можуть впливати ранні впливи. Дієта матері може впливати на мікробіом кишечника немовляти шляхом вертикального перенесення материнських мікробів на немовлят під час вагінальних пологів та годування груддю. Ми мали на меті вивчити зв’язок материнської дієти під час вагітності з мікробіомом кишечника немовляти через 6 тижнів після пологів у діад матері-немовляти, залучених до дослідження когортних народжень у Нью-Гемпширі. Зразки випорожнень немовлят відбирали у 145 немовлят, а пренатальну дієту матері оцінювали за допомогою опитувальника частоти їжі. Ми використовували цільове секвенування гіперваріабельної області 16S рРНК V4-V5 для характеристики мікробіоти кишечника немовляти. Щоб врахувати відмінності в базовому рівні та траєкторіях руху мікробних профілів немовлят, ми здійснили стратифікацію аналізів за режимом доставки.
Результати
Ми виявили три скупчення мікробіомів кишечника немовляти, що характеризуються підвищеною кількістю Біфідобактерії, Стрептокок і Клострідій, і Бактероїди, відповідно в цілому та у вагітно доставленому дитячому прошарку. В аналізах, стратифікованих на немовлят, народжених вагінально та з урахуванням інших потенційних факторів, споживання плодів у матері асоціювалося зі структурою мікробної спільноти немовлят (ПЕРМАНОВА, стор
Передумови
Дослідження вивчали внесок матері у здоров’я немовлят, включаючи вплив материнської дієти під час вагітності та годування груддю. Пренатальна дієта впливає на ризик розвитку алергії у немовлят та дітей. Наприклад, середземноморська дієта під час вагітності асоціюється із зниженим ризиком стійких та атопічних хрипів та атопії у дітей у віці 6,5 років [1, 2]. Високе споживання м’яса під час вагітності пов’язане з підвищеним ризиком хрипів у перший рік життя, тоді як споживання молочних продуктів у матері пов’язане зі зниженим ризиком інфантильних хрипів [2]. Мало відомо про фактичні механізми, за допомогою яких дієта матері впливає на здоров’я дітей; ми висуваємо гіпотезу, що материнська дієта впливає на розвиток мікробіому кишечника в дитинстві і згодом впливає на результати здоров'я дитини. Встановлено, що дієта є важливим фактором мікробіому кишечника. Доведено, що короткочасні дієти, що складаються виключно з рослинної або тваринної їжі, змінюють мікробіом кишечника людини [3]. Крім того, дослідження на людях та гуманізованих мишах-гнотобіотиках показують, що дієти зі зниженими вуглеводами [4] або з високим вмістом полісахаридів змінюють склад мікробіому кишечника [5].
На сьогоднішній день досліджень зв’язку материнської дієти з мікробіомом кишечника немовлят, що розвивається, було обмеженим. В одному дослідженні спостерігалося, що дієта з високим вмістом жиру у матері під час вагітності була пов’язана з мікробним складом меконію, але дані про дієту матері були обмеженими [6]. Один із механізмів, на який мікробіом кишечника немовляти може впливати материнська дієта - це вертикальний перенос материнських мікробів немовлятам під час пологів. Існує добре встановлена взаємозв'язок мікробіому кишечника немовляти з режимом розродження (кесарево розтин проти вагінально народжених немовлят) [7, 8], яке може зберігатися і в зрілому віці [9]. Як варіант, материнська дієта може впливати на розвиток плода та подальшу реакцію господаря на мікробні популяції під час та після народження. Крім того, відмінності в складі грудного молока, обумовлені материнською дієтою, можуть сприяти мікробіому кишечника немовлят у немовлят на грудному вигодовуванні. Ми дослідили взаємозв'язок материнської дієти під час вагітності з мікробіомом дитячого стільця у 6-тижневих немовлят та виявили асоціації в групах режиму пологів.
Результати
Навчання населення
Характеристики досліджуваної сукупності зведені в таблицю 1 (n = 145). Вік матері коливався від 22 до 44 років, у середньому 31,9 року. Понад 70% матерів серед населення мали принаймні вищу освіту, понад 90% були одруженими, і більшість з них були вперше матерями. Куріння під час вагітності було рідкісним - 4,8%, а населення мало дещо надмірна вага із середнім ІМТ до вагітності 25,6. Наше населення мало більше немовлят чоловічої статі, ніж немовлят жіночої статі (57,2% чоловіків), а середня вага при народженні та термін вагітності 3427 г та 39,3 тижня відповідно. Більшість немовлят народилися вагінально (66,9%) і вигодовувались виключно на грудному вигодовуванні (70,3%) у віці 6 тижнів. Відвідування дитячого садка та вплив антибіотиків у дітей у віці до 4 місяців або раніше були рідкістю. Заходи та розподіл пренатальної дієти матері наведені в Таблиці 1. Більшість характеристик суб'єктів та дієтичні фактори матері не відрізнялися між групами режимів пологів (Таблиця 1).
Склад мікробної спільноти та фактори харчування матері
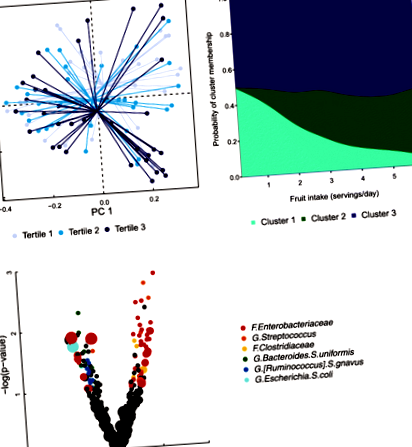
Ми виявили 11 029 093 послідовності бактерій у 145 6-тижневих зразках стільця немовлят, які пройшли контроль якості. Найбільш поширеною систематичною групою була Enterobacteriaceae що складає 20,0% 6-тижневого мікробіома дитячого стільця, а потім - Біфідобактерії (18,4%), Бактероїди (10,4%), і Стрептокок (8,10%) (Додатковий файл 1: Таблиця S1). Відкритий референтний збір OTU ідентифікував загалом 4260 OTU у нашій популяції 6-тижневих зразків дитячого стільця, причому 2850 OTU відповідали ідентифікаторам Greengenes та 1410 OTU de novo. Наш основний аналіз був зосереджений на вагінально народжених немовлятах (n = 97). З урахуванням способу годування немовлят, ІМТ матері, співвідношення та партія, споживання плодів у матері було пов’язано зі складом мікробіомів дитячого стільця (узагальнена відстань UniFrac PERMANOVA, стор = 0,028; Таблиця 2; Рис. 1а). В аналізі чутливості вплив споживання плодів матері на мікробіом кишечника немовлят у немовлят, які народились вагінально, зберігався, коли обмежувався немовлятами, які були виключно на грудному вигодовуванні (загальна відстань UniFrac PERMANOVA, стор = 0,022; Таблиця 2). За винятком немовлят, які могли отримувати антибіотики або тих, хто був доставлений передчасно (Додатковий файл 1: Таблиця S10, Рисунок S7a), якісно не змінили результати.
Скупчення мікробіомів немовляти в кишечнику
Ми виявили три окремі скупчення мікробіому кишечника новонароджених у немовлят із вагінальним пологами (n = 97), з кластером 1 характеризується великою чисельністю роду Біфідобактерії, кластер 2 за родами Стрептокок і Клострідій, і скупчення 3 за родом Бактероїди (Додатковий файл 1: Рисунок S1, таблиця S1). Для оцінки взаємозв'язку між дієтичними факторами матері та членством у кластерах немовлят ми використовували багаточленну логістичну регресію з кластером 1 як референтною групою. Шанси приналежності до кластеру 2 у 2,73 рази більші за кожну додаткову порцію плодів для матері на день (95% ДІ 1,36, 5,46; Таблиця 3, Рис. 1b). Ці результати узгоджувались, коли немовлята, народжені раніше терміну, не були включені в аналізи (додатковий файл 1: Таблиця S9, Рисунок S6a).
Оперативні таксономічні одиниці в кишках немовляти та дієтичні фактори матері
Асоціації у немовлят, народжених за допомогою кесаревого розтину
Обговорення
Ми спостерігали відмінності як у загальній структурі мікробної спільноти немовлят, так і в конкретних мікробах щодо факторів харчування матері, часто в залежності від режиму пологів. Деякі наслідки материнської дієти були більш очевидними у немовлят, що вигодовуються виключно на грудному вигодовуванні; однак ми не змогли порівняти дітей з виключно штучним вигодовуванням, оскільки більшість немовлят отримували трохи грудного молока.
У кількох випадках харчовий фактор матері був пов'язаний з мікробом в обох групах пологів, але в протилежних напрямках. Оскільки кесарів розтин призводить до диференціальної структури мікробного співтовариства немовляти [24], а мікробіом кишок є складною системою, такі відмінності ймовірні; для підтвердження цього спостереження будуть потрібні експериментальні дослідження. Однак асоціації між материнською дієтою та мікробними спільнотами немовлят не завжди відрізнялися способом доставки. Наприклад, показник середнього материнського рівня AMED постійно позитивно та негативно асоціювався з результатами Enterobacteriaceae родини, і додатково негативно пов'язаний з видом кишкова паличка, в обох режимах доставки.
Вибірка нашого дослідження була взята з Північної Нової Англії, яка має відносно однорідну популяцію; це може обмежити узагальнення дослідження. Однак, обмежуючи незміряне збентеження через різницю в мікробіомах людини між популяціями, що може призвести до помилкових асоціацій з харчовими відмінностями, наше дослідження також може мати більшу внутрішню валідність. Дієта матері оцінювалась шляхом самостійного звітування між 24 та 28 тижнями вагітності, і не виключено, що режим харчування змінюється ближче до кінця вагітності або під час лактації. Однак дієти часто стабільні, і оцінка частоти прийому їжі до середини вагітності (FFQ), ймовірно, є достатньо репрезентативною для пізньої вагітності та дієти під час лактації у високої частки людей [25, 26]. Тим не менше, ефекти, які ми спостерігаємо, можуть бути частково обумовлені материнською дієтою під час лактації. Крім того, ми не можемо зробити висновок, якщо наслідки материнської дієти спостерігаються лише у немовлят, які перебувають на грудному вигодовуванні, а також у тих, хто переважно годується сумішами, або в поєднанні суміші та грудного молока. Також можливо, що на зв'язок між материнським опроміненням та мікробіотою немовляти на 6 тижні життя впливають фактори, не досліджені в цьому дослідженні.
Майбутні дослідження, що вивчають взаємозв'язок між материнською дієтою та компонентами грудного молока, включаючи мікробіологічні та харчові профілі, а також потенційний вплив материнської дієти на мікробіом плода, можуть запропонувати розуміння механізмів впливу материнської дієти на мікробіом кишечника немовляти. Визначення впливу змін мікробіому кишечника немовлят внаслідок материнської дієти на здоров’я та розвиток немовлят - це можливість уточнити дієтичні рекомендації для вагітних та годуючих жінок для підтримки здоров’я немовлят.
Висновки
На закінчення ми виявили три групи спільнот мікробних спільнот немовлят і спостерігали вплив численних пренатальних дієтичних факторів матері на мікробіом кишечника немовляти, які часто варіювали залежно від режиму доставки.
Методи
Навчання населення
Суб'єкти цього дослідження були в Нью-Гемпширському когортному дослідженні (NHBCS), яке проводило зразки дитячого стільця протягом 6 тижнів після пологів. Як було описано раніше [27, 28], учасниками NHBCS є вагітні жінки, які отримують допологовий догляд у клініках штату Нью-Гемпшир, США, які повідомили, що покладаються на приватне, нерегульоване, а також своє домашнє джерело води. Учасників віком від 18 до 45 років набирали у віці від 24 до 28 тижнів вагітності. Центр захисту людей у Дартмуті надав затвердження комісії з огляду інституцій. Всі методи проводили відповідно до керівних принципів. Письмова інформована згода була отримана на участь усіх суб’єктів для них та їхніх дітей. З 31 березня 2011 року, коли перший потенційний суб’єкт, який мав можливість забрати 6-тижневий зразок дитячого стільця, був перевірений на відповідність вимогам, і 30 червня 2015 року, коли дані були заморожені для цього аналізу, 6569 жінок пройшли обстеження на відповідність вимогам і 1334 мали право. Було зараховано дев'ятсот сімдесят шість суб'єктів, а 361 забезпечив 6-тижневі зразки стільця для немовлят, 187 з яких мали доступні дані секвенування генів 16S рРНК (додатковий файл 1: Рисунок S2).
Телефонні опитування, що проводились кожні 4 місяці, визначали спосіб годування немовляти, включаючи терміни припинення грудного вигодовування та дату початку кожної нової суміші, залежно від обставин, а також вживання ліків, таких як антибіотики. Немовлят, про яких повідомлялося, що ніколи не вводили молочні суміші та годували їх грудним молоком, вважали виключно грудним вигодовуванням, тоді як тих, хто коли-небудь годував груддю та годував сумішшю, годували комбінацією грудного молока та суміші незалежно від того, немовля було ще на грудному вигодовуванні під час збору стільця. Ті, хто ніколи не годувався груддю і отримував лише суміші, вважалися виключно штучним вигодовуванням. Режим пологів брали із записів пологів матері, а ріст, вага та паритет перед вагітністю визначали за допомогою самостійного опитування при вступі до дослідження та використовували для обчислення ІМТ до вагітності.
Дієтні дані матері та оцінка дієти Середземноморської дієти
Дієти матері під час вагітності оцінювали протягом гестаційних 24–28 тижнів за допомогою перевіреної анкети щодо частоти харчування (FFQ) [25]. Ми розрахували оцінку альтернативної середземноморської дієти (aMED) на основі показників щоденного споживання їжі, отриманих FFQ, дотримуючись методу Tobias et al. 2012 [29], за винятком споживання алкоголю для адаптації балу до когорти вагітних. Щоденне споживання овочів, фруктів, бобових, сої та горіхів, цільного зерна, риби та морепродуктів, а також співвідношення мононенасичених до насичених жирів (MUFA: SFA) вище медіани вважається корисним для здоров’я та надає 1 бал за шкалою aMED. Вживання червоного та переробленого м’яса вважається менш корисним для здоров'я, а споживання нижче медіани дає 1 бал до показника aMED. Це призводить до можливих значень балів aMED від 0 до 7, а більш високий бал вказує на більшу прихильність до середземноморської дієтичної схеми. Ми додатково розглянули кожен з цих дієтичних компонентів та вживання окремих молочних, поліненасичених жирних кислот (PUFA) та омега-3 жирних кислот, ейкозапентаенової кислоти (EPA) та докозагексаєнової кислоти (DHA) окремо.
Збір зразків та вилучення ДНК
Зразки випорожнень у немовлят відбирали на 6-тижневому контрольному періоді після пологів у матері, а також розподіляли і заморожували при - 80 ° C протягом 24 годин. Дотримуючись встановлених методів, розглянутих Ву та співавт. [30], ми використовували набір для екстракції ДНК Zymo (Zymo Research) для вилучення мікробної ДНК із розморожених зразків та кількісної оцінки ДНК за допомогою нанодропа OD260/280.
Цільове секвенування генів 16S рРНК
Гіпервариабельна область V4-V5 гена бактеріальної 16S рРНК була секвенирована в Морській біологічній лабораторії (MBL) в Вудс-Гоулі, штат Массачусетс, за допомогою встановлених методів [31, 32]. Як описано раніше [24], амплікони 16S рДНК V4-V5 генерували з очищених зразків геномної ДНК за допомогою злитих праймерів. Використання прямих праймерів, що містять один із восьми штрих-кодів із п'яти нуклеотидів, між областями моста і послідовності праймерів Illumina та 16S-специфічною областю, а також одного зворотного праймера, що містить 1 з 12 індексів Illumina, дає змогу мультиплексувати 96 зразків на смугу. Посилення проводились у трьох примірниках з одним негативним контролем для внутрішнього контролю якості на MBL. Ми використали qPCR (Kapa Biosystems) для кількісної оцінки пулу ампліконів, і один цикл Illumina MiSeq 500 у парному кінці для послідовності кожного пулу з 96 бібліотек. Ми демультиплексували та розподіляли набори даних, використовуючи Illumina MiSeq Reporter та спеціальний скрипт Python.
Профілювання мікробіомів
Для ідентифікації профілів структури мікробної популяції ми використовували послідовності ампліконів повної довжини для гіперваріабельних областей гена рРНК V4-V5. Ми об’єднали пряме та зворотне читання на основі перекриття послідовностей [33], видалили послідовності праймерів та відкинули послідовності, що містять неоднозначні нуклеотиди. Ми використовували vsearch [34] для видалення химер, як нових, так і порівняно з навчальним посиланням на класифікатор RDP.
Обробка даних та статистичний аналіз
Ми ідентифікували відкриті довідкові оперативні таксономічні одиниці (OTU), використовуючи QIIME версії 1.9.1 [35] з алгоритмом UCLUST та 97% подібністю [36]. Ми використовували вирівнювання PyNAST [37] з основними посиланнями Greengenes [38, 39] для побудови таблиць OTU та призначення таксономії [39, 40]. Філогенетичні дерева були побудовані з використанням методу FastTree [41]. Подальші аналізи були проведені з використанням R версії 3.2.2 [42]. Ми розрахували узагальнені відстані UniFrac між парами зразків, використовуючи таблиці OTU та філогенетичне дерево, що корениться в середній точці. Узагальнений UniFrac об'єднує зважені та незважені UniFrac для виявлення відмінностей у поміркованих рядах, а не виключно у дуже рясних чи рідкісних рядках [43, 44]. Із 187 зразків стільця для немовлят з наявними даними секвенування ми знизили 18 за відсутність даних FFQ для матері, 14 за відсутність методу годування немовлят та 7 за відсутність ІМТ матері. Ми відкинули три зразки низької якості з підрахунком прочитаних
- Дієта матері впливає на довгострокове здоров'я дітей задовго до вагітності
- Дієта матері під час вагітності та її асоціація з медуллобластомою у дітей A Діти
- Дієта немовлят та збільшення ваги вагітних у матері передбачають раннє метаболічне дозрівання кишечника
- Дієта матері під час вагітності та кишкові маркери пов'язані з ранньою мікробіотою кишечника
- Материнські ліпіди під час вагітності пов'язані з підвищеною реактивністю кортизолу у дітей