Вплив дієти з високим вмістом жиру на розвиток аденоми товстої кишки на тваринній моделі
Листування: Хуан-Лонг Цінь, доктор медичних наук, доктор медичних наук, відділення хірургії, Шоста народна лікарня, що входить до Шанхайського університету Цзяо Тонг, 600 Ішань-роуд, Шанхай 200233, Китай. moc.oohay@niqgnolnauh
Телефон: + 86-21-64361349 Факс: + 86-21-64361349
Анотація
ЦІЛЬ: Дослідити вплив дієти з високим вмістом жиру на формування попередників колоректального раку за допомогою тваринного.
МЕТОДИ: Щурів Wistar розділили на дві групи, яких годували або дієтою з високим вмістом жиру (HFD), або дієтою з нормальним вмістом жиру (ND), а 1,2-диметилгідразин вводили в дозі 40 мг/кг протягом 10 тижнів . Масу тіла/масу печінки/масу епідидимального жиру реєстрували після жертви щурів, а також спостерігали утворення аденоми товстої кишки. Рівні інсуліну, лептину, фактора некрозу пухлини (TNF) -α, інсуліноподібного фактора росту (IGF) -1 та тригліцеридів визначали за допомогою імуноферментного аналізу для порівняння змінених рівнів біохімічних показників та запальних цитокінів у сироватка між щурами, які годували ND та HFD. Активність проліферації клітин (Ki-67) визначали за допомогою імуногістохімічного аналізу. Вестерн-блот та імунофлуоресцентне фарбування використовували для вивчення експресії проліферуючих клітинних ядерних антигенів (PCNA), циклооксигенази (COX) -2, цикліну D1, β-катеніну та ядерного фактора (NF) -κB білків в аденомі та тканинах порівняльного контролю.
РЕЗУЛЬТАТИ: Кількість аденоми товстої кишки та епітелію товстої кишки Ki-67 були значно вищими у групі HFD, ніж у групі ND. Група HFD також мала збільшену масу тіла, масу печінки та вагу жиру епідидиму, що було пов’язано із підвищенням рівня сироваткового інсуліну, лептину, TNF-α, IGF-1 та тригліцеридів. Індукована HFD підвищена регуляція білків PCNA, COX-2, цикліну D1, β-катеніну та NF-κB, як виявлено за допомогою вестерн-блот та імунофлюоресцентного фарбування.
ВИСНОВОК: HFD сприяє утворенню аденоми товстої кишки через запалення, порушення метаболізму та збільшує прогресування клітинного циклу.
Основна порада: Це дослідження було проведено для вивчення впливу дієти з високим вмістом жиру на частоту розвитку аденоми товстої кишки, індукованої інтраперитонеальним введенням 1,2-диметилгідразину щурам Wistar. Ми продемонстрували, що дієта з високим вмістом жиру (HFD) збільшує проліферативну активність епітеліальних клітин товстої кишки, і ми робимо висновок, що опосередкований HFD ріст пухлини може бути пов'язаний із запаленням та посиленням прогресування клітинного циклу. Це дослідження може сприяти розумінню природи взаємозв'язку між високим споживанням жиру та підвищеним ризиком колоректальної карциноми.
ВСТУП
Колоректальний рак (КРР), на який припадає близько 10% випадків ракових захворювань, є основною причиною захворюваності та смертності у всьому світі:> 1 мільйон нових випадків та> 600000 смертей щорічно, що робить його четвертою причиною смертності від раку у світі [1,2]. Генетична схильність, схоже, пояснює лише незначну частку випадків, тоді як багато факторів ризику для КПР пов'язані із західним способом життя. Нещодавно багато епідеміологічних досліджень дали докази взаємозв'язку між споживанням жиру з їжею та підвищеним ризиком виникнення КРР [3]. Більшість досліджень на тваринах показали, що дієта з високим вмістом жиру (HFD) призводить до збільшення кількості хімічно індукованих аберантних вогнищ крипт (ACF) [4], які є ідентифікованими ураженнями при експериментальному канцерогенезі товстої кишки та пухлинах [5]. Крім того, відомо, що надмірне споживання харчових жирів спричиняє ожиріння у людей та гризунів [6,7], а також спричиняє рак раки товстої кишки [8].
Хоча зв'язок між ЧСЧ або ожирінням, спричиненим дієтою, та підвищеним ризиком виникнення КРК досліджували в популяційних спостережних дослідженнях, а також in vitro (експериментальних) дослідженнях (переважно зосереджених на захворюваності на АКФ або зміні зростання ксеногрантовані клітини раку товстої кишки людини), мало розуміння щодо впливу HFD на утворення попередників (аденоми товстої кишки) CRC. Отже, дане дослідження було проведено для вивчення впливу HFD на частоту канцерогенезу товстої кишки in situ, викликаного 1,2-диметилгідразином (DMH).
МАТЕРІАЛИ І МЕТОДИ
Тварини та хімікати
У цьому дослідженні використовували 4-тижневих самців щурів Wistar (180-200 г), отриманих від Shanghai Shriek Laboratory Animal Corporation. Усі тварини були розміщені в пластикових клітинах (чотири або п’ять щурів/клітка) в контрольованих умовах вологості (44 ± 5%), світла (12 годин світло/темний цикл) і температури (22 ± 2 ° C). DMH був придбаний у Sigma-Aldrich (Сент-Луїс, Міссурі, Сполучені Штати) і свіжоприготований перед використанням в 1 ммоль/л ЕДТА-сольового розчину з рН, відрегульованим до 7,0 з використанням розведеного розчину NaOH.
Експериментальні процедури
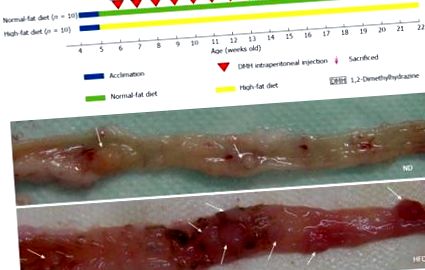
Протокол експерименту та репрезентативні зображення аденоми товстої кишки. В: Протокол експерименту з аденомою товстої кишки. Щурів (4-тижневого віку) поділяли на групу з нормальним жиром (ND) (n = 10) та групу з високим вмістом жиру (HFD) (n = 10). Через шістнадцять тижнів після початку внутрішньочеревної ін’єкції 1,2-диметилгідразину (ДМГ) щурів евтаназували; B: Репрезентативні зображення аденоми у зразках товстої кишки з групи ND (вгорі) та групи HFD (внизу), коли товсті кишки розкривали поздовжньо. Розташування аденоми позначається стрілками.
Розтин та перелік пухлини
Напередодні перед евтаназією їх тримали на ніч натщесерце з питною водою ad libitum та евтаназували наступного дня. Після того, як вони були знеболені (кетамін 100 мг/кг + ксилазин 15 мг/кг, внутрішньовенно), у крові брали проби крові шляхом пункції серця [23]. Зразки центрифугували протягом 15 хв при 4000 об/хв, сироватку відокремлювали та розподіляли аликвотами та заморожували при -80 ° C до подальшого аналізу. Видалили всю товсту кишку, розрізали її поздовжньо і промили крижаним сольовим розчином. Товста кишка була покладена рівно на асептичний рушник, і була підрахована загальна кількість пухлин у всій товстій кишці. Після цього пухлини розрізали на половинки; один був підготовлений до гістологічного дослідження, а другий поміщений у кріотрубку і негайно заморожений у рідкому азоті для вестерн-блот. Також збирали та зважували жир печінки та епідидиму.
Олійно-червоне фарбування O
Зрізи тканин печінки з груп ND та HFD фіксували протягом 24 годин у 4% параформальдегіді, 0,2% пікриновій кислоті та 0,5% глутаральдегіду в 0,2 моль/л фосфатному буфері (pH = 7,4) при 4 ° C. Після промивання протягом 1 дня 15% -ною сахарозою при 4 ° C зрізи інкубували протягом 1 години в олійно-червоній фарбувальній ванні для фарбування для накопичення жиру. Після видалення плями та промивання зрізів 60% ізопропанолом, зображення кожної групи було сфотографовано.
Імуноферментний аналіз
Рівні тригліцеридів у сироватці крові, холестерину, інсуліну, IGF-1, лептину та TNF-α, IL-6, CXCL-10 вимірювали за допомогою відповідних наборів імуноферментного аналізу (ІФА) (RD, Міннеаполіс, Міннесота, США) (n = 10 від кожної групи) відповідно до інструкцій виробника.
Гістологічні дослідження та імуногістохімія
Тканини товстої кишки фіксували в 10% нейтральному фосфатно-забуференному формаліні, регулярно обробляли, ділять на 5 мкм і фарбували гематоксиліном та еозином для мікроскопічного дослідження. Для імуногістохімії зв’язані з формаліном парафінові зв’язки товстої кишки депарафінізували, регідратували та інкубували протягом 5 хв у 3% H2O2 для дезактивації ендогенної пероксидази. Зрізи блокували 5% бичачим сироватковим альбуміном, інкубували послідовно з анти-Ki-67 антитілом (1: 200; Abcam, Кембридж, Массачусетс, США) та біотинільованими вторинними антитілами коня проти миші (Vector Laboratories, Burlingame, CA, США) відповідно до інструкцій виробника і, нарешті, фарбують гематоксиліном. Забарвлення Ki-67 було оцінено двома незалежними дослідниками за допомогою світлової мікроскопії з яскравим полем.
Імунофлуоресцентне фарбування
Для візуалізації експресії циклооксигенази (ЦОГ) -2 та пов’язаних із клітинним циклом білків, таких як проліферуючий клітинний ядерний антиген (PCNA), проводили імунофлуоресценцію. Парафінові зрізи блокували на наявність ендогенної пероксиду та обробляли для оптимального отримання антигену, як описано раніше. Зрізи інкубували з антитілами PCNA та COX-2 (Cell Signaling Technology, Danvers, MA, США). Далі зонди досліджували за допомогою кон’югованого з ціаніном-3 вторинного антитіла IgG (Jackson ImmunoResearch Laboratories, Філадельфія, Пенсільванія, США). Клітинні ядра фарбували 4,6-діамідино-2-феніліндолом (DAPI). Інкубація без першого антитіла служила негативним контролем. Зображення зрізів пухлини отримували під мікроскопом DSY5000X за допомогою камери Nikon D200 та системи візуалізації.
Вестерн-блот
Тканини товстої кишки гомогенізували, обробляли ультразвуком і переносили в крижаний буфер для лізису, що містить інгібітор протеази. Концентрацію білка визначали, використовуючи набір BCA Protein Assay Kit (Pierce Biotechnology, Рокфорд, Іллінойс, США). Екстраговані білки розділяли на 10% SDS-PAGE і переносили на мембрани полівінілідендифториду (Millipore, Bedford, MA, США). Потім мембрани інкубували при температурі 4 ° С протягом ночі з відповідними первинними антитілами, специфічними для PCNA, цикліну D1, β-катеніну та NF-κB (1: 1000; Технологія клітинної сигналізації). Після цього мембрани три рази (по 20 хв.) Промивали сольовим розчином, забуференним Tris (TBS), що містить 0,1% Tween 20 (TBS-T), а потім інкубували протягом 1 години з відповідним кон'югованим з пероксидазою хроном вторинним антитілом ( 1: 2000) в TBS-T протягом 4 год при 4 ° C. Нарешті, білки візуалізували за допомогою посиленого методу хемілюмінесценції (набір ECL, Pierce) відповідно до інструкцій виробника. β-актин використовували як внутрішній контроль навантаження.
Статистичний аналіз
Кількісні змінні аналізували за допомогою критерію Стьюдента або критерію Манна-Уітні. Дані представлені як середнє значення ± SD. Довірчі інтервали протягом дослідження були встановлені на рівні 95%. Двостороння величина P Рисунок 2, 2, маса тіла була значно вищою у групі HFD, ніж у групі ND, після 1 тижня лікування (тобто у 6-тижневого віку), і ця різниця зберігалася до кінця дослідження (Рисунок (Рисунок 2А). 2А). На початку дослідження середня маса тіла становила 181,5 ± 9,3 г та 187,7 ± 6,5 г у групах ND та HFD відповідно (P = 0,054). До кінця дослідження за 16 тижнів середня маса тіла значно зросла до 317,4 ± 8,2 г у групі ND та 368,6 ± 13,1 g у групі HFD (P (Рисунок 2B, 2B, C). Вага епідидимального жиру значно зросла до 3,19 ± 0,26 г у групі ND та 5,13 ± 0,45 г у групі HFD (збільшення в 1,61 рази, P (рис. 2D 2D).
Зміни маси тіла та репрезентативні зображення печінки. В: Зміни маси тіла щурів, які харчуються нормальним жиром (ND) (синя лінія, n = 10) та дієтою з високим вмістом жиру (HFD) (червона лінія, n = 10). Суттєві відмінності спостерігались між групами ND та HFD в усі моменти часу, крім початкових 2 тижнів; B: Репрезентативні зображення печінки з групи ND (ліворуч) та групи HFD (праворуч). Печінка з групи HFD, схоже, мала жировий печінкоподібний вигляд, а фарбування Олійно-червоним О також також свідчить про те, що в цитоплазмі клітин печінки більше крапель ліпідів. Візуалізація була задокументована зі збільшенням × 200; C: Середня вага печінки з обох груп. Кожна колонка являє собою середнє значення ± SD 10 щурів/група; D: Середня вага епідидимального жиру з обох груп. Кожна колонка представляє середнє значення ± SD 10 щурів/групу. a P (Рисунок 2E). 2E). Середня кількість аденом у групі з HFD становила 4,2 на щура, тоді як у групи ND було лише 1,9 пухлини на щура (P Рисунок 3A 3A та B, відповідно, і слід зазначити, що ніяких морфологічних відмінностей в аденомах між Групи ND та HFD. Щоб вивчити сприяючий вплив HFD на формування аденоми товстої кишки, попередника колоректального канцерогенезу, визначали проліферативну активність епітеліальних клітин товстої кишки за допомогою фарбування Ki-67. Як показано на малюнку Рисунок 3C-F, 3C -F, що включає сусідні нормальні тканини епітелію та аденоми, спостерігалося значне збільшення фарбування Ki-67 в аденомах у групі HFD порівняно з групою ND. Зокрема, ми виявили, що в Ki-67 + крипти з у сусідньому нормальному епітелії клітини Ki-67 + були в основному обмежені дном товстої кишки у щурів, що годувались ND, тоді як клітини Ki-67 + у позитивних криптах щурів, що харчувались HFD, в основному були присутні на всій висоті крипти Тому, ці результати показали, що проліферативна активність епітеліальних клітин товстої кишки сприяла HFD, що призводило до збільшення утворення аденоми товстої кишки.
- Хронічна активація протеїнкінази, що активується AMP, і дієта з високим вмістом жиру мають адитивний ефект
- Вплив 6-місячної веганської дієти з низьким вмістом вуглеводів («Еко-Аткінс») на серцево-судинні фактори ризику та
- Вплив курячої дієти на функцію нирок та ліпідний профіль у пацієнтів із діабетом 2 типу
- Вплив інтенсивного втручання в їжу з високим вмістом білка та низьким глікемічним індексом на
- Вплив дієти з помірним вмістом жиру з авокадо та без нього на кількість, розмір і розмір ліпопротеїдів