Внесок мікробіоти кишечника у опосередковані протизапальними ефектами P28GST: експериментальний та клінічний аналіз
Бенуа Фоліньє
Колін Пле
2 ун-т. Лілль, CNRS, Інсерм, CHU Лілль, Інститут Пастера де Лілля, U1019 — UMR 8204 — CIIL — Центр інфекції та імунітету Лілля, F-59000 Лілль, Франція; [email protected] (C.P.); [email protected] (C.D.)
Марі Тітекат
Арно Дендовен
Орельєн Паньї
Катерина Даніель
2 ун-т. Лілль, CNRS, Інсерм, CHU Лілль, Інститут Пастера де Лілля, U1019 — UMR 8204 — CIIL — Центр інфекції та імунітету Лілля, F-59000 Лілль, Франція; [email protected] (C.P.); [email protected] (C.D.)
Елізабет Співак
Мюріель Поттьє
Бенджамін Бертін
Крістел Нойт
Домінік Депланк
3 ун-т. Лілль, Інсерм, CHU Лілль, CIC 1403, Центр досліджень клініки, F-59000 Лілль, Франція; [email protected]
Лоран Дюбюк
П’єр Деремо
4 Service des Maladies de L’Appareil Digestif et de la Nutrition, CHU Lille, F-59000 Lille, Франція
Монік Капрон
Енні Стандарт
Пов’язані дані
Анотація
1. Вступ
2. Матеріали та методи
2.1. Матеріали
Хімічні речовини та реактиви закуповували у компанії Sigma – Aldrich Chemical (St Quentin Fallavier, Франція), якщо не зазначено інше. Партії білка P28GST були виготовлені та очищені з рекомбінантної культури Saccharomyces cerevisiae в умовах належної виробничої практики компанією Eurogentec S.A (Seraing, Бельгія). P28GST консервували ліофілізованим у NH4HCO3 10 мМ та 6% лактози. Цей препарат був суспендований одночасно з 0,2% гідроксидом алюмінію або без нього, ад'ювант, сумісний з тваринами та людьми (Alhydrogel®, Brenntag Nordig, Frederikssund, Данія та Miltenyi Biotec, Париж, Франція).
2.2. Експерименти на тваринах та етика
Мишей BALB/c (самки віком 6 тижнів) купували у Charles Rivers (L’Arbresle, Франція) та утримували їх у приміщеннях для утримання тварин без патогенів. Експерименти на тваринах відповідали законодавству Франції (урядовий закон 87-848). Усі дослідження були схвалені місцевою комісією з розгляду етики розслідувань (Nord-Pas-de-Calais CEEA N ° 75, Лілль, Франція; посилання на протоколи 352012 та 19-2009R) та урядом Франції уряду № APAFIS # 7542-20 1608251651940 ).
2.3. Протоколи імунізації
Імунізацію проводили мишам BALB/c трьома підшкірними ін'єкціями (у спину між лопатками) P28GST при 5 мкг.кг -1 з інтервалом у 2 тижні, як описано раніше [7]. В якості альтернативи контрольні миші отримували або фізіологічний розчин (CTL), лише ад'ювант (ад’ювант), або P28GST з ад’ювантом (P28GST + ад’ювант).
2.4. Індукція оцінки коліту та запалення тринітробензолсульфокислотою (TNBS)
Модель тринітробензолсульфонової кислоти (TNBS) хімічно індукованого гострого коліту була впроваджена у 13-тижневих самок BALB/c (n = 10 мишей на групу), як описано раніше [30]. В інших місцях повідомлялося про анатомопатологічні та запальні показники, включаючи кількісну ланцюгову реакцію зворотної транскриптази-полімерази [31]. Коротко кажучи, 0,5 см середніх зразків товстої кишки гомогенізували за допомогою приладу FastPrep (MP Biomedicals, Illkirch, Франція), загальну РНК виділили за допомогою колон RNAspin (Macherey – Nagel, Hoerdt, Франція). Зворотну транскрипцію та ПЛР у режимі реального часу проводили з наборами реакцій (комплект високої ємності кДНК RT, Applied Biosystems - Fischer Scientific, Illkirch, Франція) та реагентами (Universal PCR Master Mix, Applied Biosystems - Fischer Scientific, Illkirch, Франція), відповідно до інструкцій виробника. Ланцюгові реакції полімерази (ПЛР) проводили на апараті MX3005P (Agilent Technologies, Les Ulis, Франція). Спеціальний аналіз експресії генів (TaqMan, Applied Biosystems) був використаний з комерційно розробленими та перевіреними праймерами, які перелічені в Таблиці S1 в Додаткових матеріалах. Ген ведення домашнього господарства, бета-актин, використовувався як внутрішній контроль. Дані аналізували за допомогою методу 2-ΔΔCt і виражали як збільшення у кратному значенні порівняно зі значеннями контрольної групи.
2.5. Пацієнти та зразки калу людини
Пацієнти із хворобою Крона (CD) були частиною пілотного клінічного випробування фази 2а, призначеного для оцінки безпеки P28GST, спрямованого на контроль запалення при помірному КР (ClinicalTrials.gov,> NCT02281916). Як французьке управління охорони здоров’я (Agence Nationale de Sécurité des Médicaments, ANSM), так і Етичний комітет Nord-Ouest IV схвалили пілотне дослідження (номер EudraCT 2013-000595-15), і всі суб’єкти дали інформовану згоду на участь у дослідженні. Вісім пацієнтів були включені після операції з резекції кишечника або середнього ступеня тяжкості. Зараховані пацієнти отримували три підшкірні ін'єкції (одна ін'єкція на місяць) по 100 мкг P28GST, асоційованого з Альгідрогелем®, як рекомендований ад'ювант. Для цього дослідження зразки калу до та після введення P28GST були отримані лише для 5 пацієнтів і дозволено аналіз мікробіоти. Зразки заморожували і зберігали при -80 ° C до аналізу.
2.6. Аналіз мікробіоти
Екстракція ДНК, цілеспрямований метагеномічний аналіз 16S та біоінформатичний аналіз були досягнуті згідно оптимізованих та стандартизованих методологій, розроблених Genoscreen (Лілль, Франція), і повністю детально описані в Додаткових матеріалах.
2.7. Лікування антибіотиками та трансплантація мікробіоти в калі
У деяких експериментах наївних мишей у віці (n = 20) лікували антибіотиками широкого спектру протягом 5 днів, щоб полегшити подальше відновлення трансплантації калових мікробіоти (Abx) (Рисунок S4). Склад антибіотичного коктейлю та відповідна процедура представлені в додаткових матеріалах.
Зразки калу десяти мишей-донорів (від 200 до 300 мг кожна) були асептично зібрані та об'єднані в 0,5% цистеїну 1X PBS для максимального збереження анаеробних бактерій. Стілець (100 мг мкл -1) контрольних або імунізованих донорів ресуспендували енергійною сумішшю протягом 1 хв і центрифугували при 2000 об/хв протягом 2 хв для осадження сміття. Супернатант збирали та доставляли відповідним віку мишам-реципієнтам через пероральний апарат (по 200 мкл кожного реципієнта) протягом 15 хв після виведення для запобігання змінам бактеріального складу. Мишей-реципієнтів (n = 10 у кожній групі), яких годували звичайною дієтою та питною водою, або обробляли антибіотиками, піддавали трансплантації мікробіоти три дні поспіль протягом трьох тижнів, починаючи з першого посилення імунізації P28GST (див. Також Рисунок S4).
2.8. Статистичний аналіз
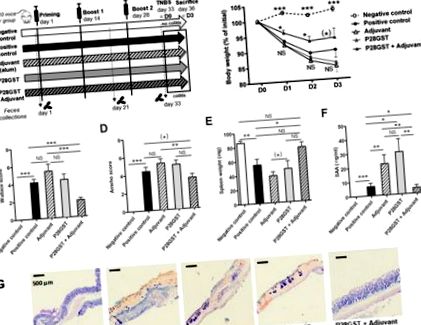
Нарешті, ці спостереження відповідали транскрипційним сигнатурам у запалених товстих кишках (малюнок 2 A – H). Дійсно, TNBS-індукована регуляція генів запалення (таких як імуно-пов’язані Il-6, Il-1β та Tnf-α) та генів, пов’язаних з окислювальним стресом (таких як Nos2 та Cox2), була значно менш помітною P28GST + ад'ювантне лікування. Останнє також нормалізувало падіння гомеостатичних генів, які були знижені при колітах (таких як Pparγ та Zo1).
Криві розрідження видів бактерій у залежності від кількості послідовностей вказували на загальне різноманіття бактерій, досягнуте для чотирьох експериментальних груп у три розглянуті моменти часу (див. Додаткові матеріали, рисунок S1A – C). Середня кількість оперативних таксономічних одиниць (OTU) 150 на одну особу узгоджується з іншими дослідженнями на мишах [32,33]. При D0, перед будь-яким лікуванням, питоме багатство спостережуваних ОТУ було подібним у всіх групах, хоча середнє число ОТУ було трохи, але значно нижчим у зразках калу з групи ад'ювантів. Це може бути пов'язано із загальною неоднорідністю лабораторних мишей. На D21 показники багатства та індекси Шеннона вже не відрізнялися між групами, що свідчить про стабілізовану різноманітність, на яку не впливають умови проживання та лікування. Однак у кінцевій точці D33, на відміну від альфа-різноманітності, дані все ще були порівнянні з попередніми часами, незначне зменшення різноманітності вимірювалось лише у тварин, оброблених P28GST (Додаткові матеріали, рисунки S1D – I та S2C).
Імунізація мишей ад’ювантом, P28GST та (P28GST + ад’ювант) викликає незначні зміни у складі мікробіоти калу в порівнянні з фізіологічним розчином як контролем. Дані були отримані шляхом аналізу послідовностей генів 16S рРНК. (A) Середня відносна чисельність на рівні типу для кожної групи мишей, n = 8 на групу. (B) Індивідуальна відносна чисельність на рівні виду свідчить про послідовність ефектів. (C.) Середня відносна чисельність на рівні сім’ї для кожної групи мишей та (D) зосередити увагу на відповідному низько представленому середньому відносному достатку на рівні сім'ї (нижче 6%), n = 8 на групу. Результати виражаються у% від загальної кількості оперативних таксономічних одиниць (OTU). * p (*) 0,05 Рисунок 4 A – D). Щодо відносної чисельності на рівні сім'ї та сім'ї, таксономічний розподіл підтвердив незначні зміни, пов'язані з імуномодуляцією. Ці варіації, помірно відмінні від тих, що спостерігались у попередньому експерименті, все ще були досить незначними. Знову ж таки, деякі суттєві, але незначні зміни були помічені на рідкісних ОТУ, проте ад'ювант P28GST + не змінив загальної структури домінуючих бактеріальних видів та сімейств (Малюнок 4 E, F). Однак група імунізованих мишей, які зазнали коліту TNBS, рекапітулювала нижчий рівень запалення кишечника порівняно з неімунізованими мишами, що показано меншим обсягом втрати ваги, зниженням смертності та значним зниженням макроскопічних показників запалення (p = 0,014), (Малюнок 4 G – I). Ці неімунізовані та імунізовані P28GST здорові миші (неімунні та імунні), відповідно, служать донорами фекалій для трансплантації наївним реципієнтам (неімунні R та Immu-R).
Трансплантація калу не зумовлює значних змін мікробіоти і не передає стійкості до коліту. Середня відносна чисельність у типі (A) та сімейний рівень (B) для неімунізованих (NI) та імунізованих (I) фекалій мишей-донорів, n = 5 на групу; відповідні репрезентативні фекальні трансплантації (FT) (після ресуспендування, n = 1) та відповідні фекалії мишей-реципієнтів, на 36 день, n = 5 на групу. Результати виражаються як% від загальної кількості OTU. (C.) Відсоток втрати початкової ваги (попередній коліт, на день 36 = D0), виражений як порівняння індивідуальних ваг, зареєстрованих при вбивстві (день 39 = D3), як середнє значення ± SEM, і (D) макроскопічні клінічні (Уоллесові) оцінки товстої кишки на 39 день як у неімунізованих, так і у імунізованих реципієнтів групи мишей; означає ± SEM. n = 10 на групу для параметрів оцінки коліту (C. і D); NS, не суттєво відрізняється від групи позитивного контролю.
3.5. Трансплантація калу мишам, які отримували антибіотики, недостатня для відновлення P28GST, викликаних корисними протизапальними ефектами
Фекальна мікробіота хворих на хворобу Крона не була змінена після трьох підшкірних ін’єкцій P28GST. (A) Криві розрідження спостережуваних ОТУ як функція читання продемонстрували велику неоднорідність мікробіоти серед пацієнтів при Т0 і при Т1 (B), n = 5. (C.) Основний координатний аналіз (PCoA) мікробіоти калу, зібраної у 5 хворих на КД до та після ін’єкцій P28GST з використанням зваженого UniFrac. Кольори означають зразки від кожної людини. Порівняння бета-різноманітності до та після ін’єкцій P28GST не показало суттєвої різниці з тестом PERMANOVA (p = 0,81, кількість перестановок 10000). Індивідуальні відносні показники вмісту, проаналізовані на основі 16S метагеномних послідовностей у тилі (D) та на сімейному рівні (Е) до (T0) та після досягнення протоколу лікування (T1) описують добре збережений розподіл для кожного зразка.
4. Обговорення
У цій роботі, де імунізація унікальним гельмінтовим білком (P28GST) профілактично змінює сприйнятливість мишей до коліту, ми раніше продемонстрували, що такі протизапальні ефекти включають внесок еозинофілів слизової оболонки, діючи як Т-хелперний тип (Th2) індуктори відгуку [7]. На додаток до системної та місцевої індукції IL-13 та IL-5, можна припустити можливу роль IL-25, як нещодавно було показано у захисті від амебного коліту, що діє через еозинофіли та придушення TNF-α через новий шлях вродженої імунної відповіді слизової [39].
Оскільки гідроксид алюмінію давно використовується для стимулювання реакцій Th2, запропонований механізм базується на внеску базофілів [40], хоча інші типи клітин можуть виявитися вирішальними. Однак ми не можемо виключити, що деякі додаткові явища можуть також сприяти. Відповідно, в іншому контексті виклику Toxoplasma gondii, наприклад, було доведено, що імунізація TgHSP70, білком теплового шоку, може викликати захист та масивну протизапальну подію сильним окислювальним ефектом у віддаленому місці, незважаючи на відсутність прямого роль у нейтралізації антитіл і контролі над процесами зараження паразитами [41]. Подібний механізм може мати місце також на користь бактеріального гомеостазу кишечника та подальшої профілактики коліту, як нещодавно було виявлено [42], хоча це ще потрібно продемонструвати. У сукупності точний клітинний спосіб дії, індукований імунізацією P28GST, ще не з’ясований, але попередні результати вказують на помітну роль регуляторних клітин (регуляторні DC, T reg та M2-макрофаги) та протизапальний цитокін IL-10.
Можлива роль мікробіоти кишечника в цьому протоколі імуномодуляції є ключовим питанням, яке потрібно було дослідити. Іншими словами, чи імунізує P28GST модуляція мікробіоти кишечника? Якщо так, чи деякі захисні ефекти підтримуються такими бактеріальними зрушеннями? У цьому дослідженні ми чітко показали, що імуномодуляція P28GST не впливала на загальну різноманітність та багатство мікробіоти фекалій миші. Можна було виявити лише незначні варіації таксонів з дуже малою кількістю. Зазначимо, ці граничні варіації помірно відрізнялись між обома нашими експериментами, ймовірно, через розбіжність базальної мікрофлори з різними партіями тварин та часом, але не впливаючи на сприятливий вплив P28GST на коліт. Це було на відміну від нещодавнього звіту, який показує, що полегшення алергічної астми, що супроводжується інфекцією H. polygyrus, включало склад мікробіоти та подальше утворення коротколанцюгових жирних кислот для сприяння регуляторним реакціям Т-клітин господаря [43].
Визначення модифікацій у мікробній спільноті значною мірою залежить від використовуваних методологій. Таким чином, можливий внесок мікробіоти кишечника в опосередковані P28GST протизапальні ефекти, якщо вони існують, повинен бути досить тонким або включати інші механізми, такі як неідентифікована бактерія або складна асоціація декількох мікробів з імунно-пов’язаними та наслідки, пов’язані з метаболомією. Однак наші підходи до трансплантації калу не змогли продемонструвати, що модифікації мікробіоти кишечника, викликані P28GST + ад'ювантом, змогли відновити протизапальні ефекти, викликані P28GST. Беручи до уваги дуже близький склад мікробіоти у донорів та наївних мишей, навіть у тих, хто був попередньо пролікований антибіотиками, не дивно, що після трансплантації калу в обох групах реципієнтів не спостерігали відмінностей у полегшенні коліту. статус імунізації.
У сукупності ми дійшли висновку, що був (i) низький вплив імуномодуляції P28GST на мікробіоти кишечника та (ii) відсутність головної ролі такої мікробіоти у опосередкуванні захисних ефектів. Це становить найбільший інтерес у терапевтичній перспективі P28GST у хворих на ВЗК, знижуючи ризик антагонізму через антибіотики та інші протимікробні методи лікування. Більше того, хоча властива неоднорідність мікробіому кишечника у різних популяціях людини може орієнтувати вроджені та адаптивні імунні реакції [29], той факт, що мікробіота не була посередником корисних ефектів на основі P28GST, змушує пропонувати таке лікування пацієнтам, навіть хоча вони схильні до дисбіозу та дисбалансу мікробів, що може зменшити імуногенність при ВЗК. Це обнадіює, хоча ми очікуємо подальших перспективних результатів подальших клінічних випробувань, спрямованих на спрямування запальних захворювань кишечника. Більше того, наша робота також надає перспективи для використання P28GST при інших патологіях, пов’язаних з імунітетом.
Подяка
Автори хотіли б подякувати пацієнтам за участь у дослідженні ACROHNEM, клініцистам та усім працівникам, особливо Лорану Бегіну та Патріку Геле, за їх внесок. Ми також вдячні Марі Дельбеке (U 995 Inserm), Стефані Феррейра, Марі Клеман (Genoscreen), Сеголену Кабоше і Гаелу Евену (PEGASE) за їх технічні поради, а також Домінік Хьюз і Томасу Белхеру за виправлення англійського синтаксису.
- Користь для здоров’я коралів, використання, побічні ефекти, дозування та взаємодія
- Побічні ефекти кортикостероїдів - StatPearls - Книжкова полиця NCBI
- CORDYCEPS Оцінки користувачів щодо ефективності, побічних ефектів, безпеки та взаємодії - WebMD
- Естрадіол, дозування; Побічні ефекти
- Екстракт насіння селери Переваги, побічні ефекти; Дозування