Вивільнення нейромедіатора, регульоване пресинаптичним комплексом MALS – ліпрін-α
Олав Олсен
1 Кафедра фізіології Каліфорнійського університету, Сан-Франциско, Сан-Франциско, Каліфорнія 94143
Кімберлі А. Мур
2 Кафедра клітинної та молекулярної фармакології Каліфорнійського університету, Сан-Франциско, Сан-Франциско, Каліфорнія 94143
Масакі Фуката
1 Кафедра фізіології Каліфорнійського університету, Сан-Франциско, Сан-Франциско, Каліфорнія 94143
Тошинарі Казута
1 Кафедра фізіології Каліфорнійського університету, Сан-Франциско, Сан-Франциско, Каліфорнія 94143
Джонатан С. Тринідад
3 Кафедра фармацевтичної хімії Каліфорнійського університету, Сан-Франциско, Сан-Франциско, Каліфорнія 94143
Фред В. Кауер
1 Кафедра фізіології Каліфорнійського університету, Сан-Франциско, Сан-Франциско, Каліфорнія 94143
Мішель Стреулі
4 ImmunoGen, Inc., Кембридж, Массачусетс 02139
Хідемі Місава
5 Департамент неврології, Столичний інститут неврології, Токіо 183-8526, Японія
Альма Л. Берлінгейм
3 Кафедра фармацевтичної хімії Каліфорнійського університету, Сан-Франциско, Сан-Франциско, Каліфорнія 94143
Роджер А. Ніколл
1 Кафедра фізіології Каліфорнійського університету, Сан-Франциско, Сан-Франциско, Каліфорнія 94143
2 Кафедра клітинної та молекулярної фармакології Каліфорнійського університету, Сан-Франциско, Сан-Франциско, Каліфорнія 94143
Девід С. Бредт
1 Кафедра фізіології Каліфорнійського університету, Сан-Франциско, Сан-Франциско, Каліфорнія 94143
Анотація
Синапси - це вузькоспеціалізовані міжклітинні з’єднання, організовані молекулами адгезиву та лісів, які вирівнюють пресинаптичний везикулярний вивільнення з постсинаптичними рецепторами нейромедіаторів. Комплекс білків PDZ MALS/Veli – CASK – Mint-1 зустрічається по обидва боки синапсу і має потенціал пов’язувати молекули транссинаптичної адгезії з цитоскелетом. У цьому дослідженні ми очистили білковий комплекс MALS від мозку та виявили ліпрін-α як головний компонент. Білки ліприну організовують пресинаптичну активну зону і регулюють вивільнення нейромедіаторів. Зазвичай, мутантні миші, яким бракувало всіх трьох ізоформ MALS, помирали перинатально з утрудненим диханням та порушенням збудливо-синаптичної передачі. Збудливі постсинаптичні течії різко зменшились у аутаптичних культурах у мишей з потрійним нокаутом MALS через дефіцит пресинаптики в циклічному циклі. Ці висновки узгоджуються з моделлю, згідно з якою комплекс MALS – CASK – liprin-α завербує компоненти апарату синаптичного вивільнення до адгезивних білків активної зони.
Вступ
Синаптична передача вимагає точного узгодження пре- та постсинаптичної спеціалізацій. З пресинаптичної сторони синаптичні везикули, що містять нейромедіатори, повинні бути вирівняні та стиковані в активних зонах, де везикули зливаються з пресинаптичною мембраною для секреції (Südhof, 2004). На постсинаптичній стороні нейромедіаторні рецептори повинні бути згруповані разом з відповідними механізмами передачі сигналу, щоб реагувати на випущені передавачі. Нещодавні дослідження почали з'ясовувати молекулярний механізм, відповідальний за організацію синаптичних з'єднань. Молекули адгезії, що охоплюють синаптичну щілину, діють як на стабілізацію, так і на визначення пресинаптичної активної зони та постсинаптичну спеціалізацію (Ichtchenko et al., 1995; Fannon and Colman, 1996; Flanagan and Vanderhaeghen, 1998). Цитозольні молекули, пов’язані з цими адгезивними факторами, допомагають розташувати синаптичні везикули та нейромедіаторні рецептори на відповідних сторонах синапсу (Hata et al., 1996; Torres et al., 1998; Perego et al., 2000).
Один з таких наборів модульних білків риштування складається з потрійного комплексу MALS/Veli (ссавців LIN-7/гомолог хребетних LIN-7), CASK (білок периферичної плазматичної мембрани) та Mint-1 (білок 1, що взаємодіє з munc-18), які є хребетними гомологами комплексу, вперше виявленого у Caenorhabditis elegans, який опосередковує розвиток вульви (Kaech et al., 1998). У мозку ссавців комплекс MALS – CASK – Mint-1 зустрічається по обидва боки синаптичних з’єднань і вважається, що він виконує різні ролі в цих двох місцях. Пресинаптично цей комплекс пов'язує з нейрексином (Hata et al., 1996), молекулою адгезії, яка зв'язується через синапс з постсинаптичним нейролігіном (Ichtchenko et al., 1995). Крім того, Mint-1 співпрацює з Munc18-1, важливим компонентом апарату злиття синаптичних пухирців (Okamoto and Südhof, 1997). Посинаптично MALS зв’язується з N-метил-d-аспартатом (NMDA) - типом глутаматних рецепторів (Jo et al., 1999), і повідомляється, що він транспортує везикули рецепторів NMDA вздовж мікротрубочок (Setou et al., 2000).
Генетичні дослідження не змогли встановити суттєву роль комплексу MALS – CASK – Mint-1 у мозку. Три гени MALS існують у ссавців (Borg et al., 1998; Butz et al., 1998; Jo et al., 1999), а цілеспрямоване порушення MALS-1 і MALS-2 призводить до компенсаторної регуляції MALS-3 в ЦНС (Misawa et al., 2001). Мутантні миші монетного двору-1 не виявляють дефектів збуджуючої синаптичної передачі, а лише незначний дефект гальмівної синаптичної передачі (Ho et al., 2003). Також не повідомляється про синаптичний аналіз щодо нокаутів CASK, які гинуть при народженні через дефекти середньої лінії (Laverty and Wilson, 1998).
Кілька молекул, які опосередковують розвиток синапсів, були виявлені за допомогою генетичних досліджень безхребетних. Наприклад, мутація C. elegans syd-2 розсіює пресинаптичні активні зони (Zhen and Jin, 1999). Подібний структурний дефект зустрічається у мух, у яких відсутній ортолог Drosophila melanogaster syd liprin-α, що супроводжує супутнє зниження синаптичної передачі (Kaufmann et al., 2002). Ліпрін-α зв'язується з рецепторним білком тирозинфосфатазою Длар (Serra-Pages et al., 1998), пропонуючи модель, за допомогою якої ліпрін-α і Длар співпрацюють для організації пресинаптичних активних зон. Залишається невизначеним, як ліпрін-α зв'язується з механізмом синаптичних пухирців.
Для визначення основних ролей комплексу MALS у ссавців ми очистили комплекс MALS від мозку. Виділення комплексу MALS виявило зв'язок із сімейством молекул цитоскелетної та пресинаптичної адгезії. Що важливо, ми виявили ліпрін-α1, -α2, -α3 та -α4 у комплексі MALS. Асоціація з цим комплексом опосередковується через SAM-домени в ліприн-α та NH2-кінцеву область у CASK. Використовуючи стерильні домени α мотиву (SAM) ліпріну-α як домінантного негативу, ми порушили комплекс MALS – ліпрін у дисоційованих нейронах. Щоб зрозуміти функцію комплексу MALS, ми створили мутантних мишей, у яких відсутні всі три гени MALS. Миші, у яких не було жодного гена, були життєздатними та фертильними. Однак миші, у яких відсутні всі три гени MALS, загинули протягом однієї години після народження. Ця перинатальна летальність пов'язана з порушенням пресинаптичної функції, що відображає пресинаптичний дефіцит безхребетних, яким не вистачає ортологів ліпрін-α. Ці дослідження встановлюють вирішальну роль комплексу MALS в екзоцитозі синаптичних пухирців та залученні ліприну-α до цього процесу.
Результати
Протеомічна характеристика комплексу MALS в мозку
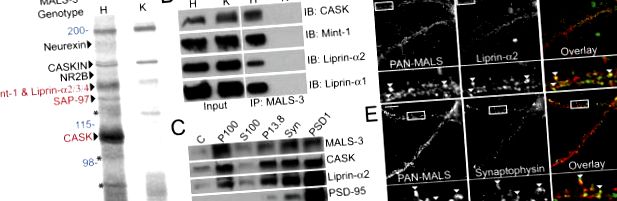
Щоб визначити молекулярну роль MALS, ми оцінили склад білкового комплексу MALS. Ми провели підготовчу імунопреципітацію MALS-3 з гомогенатів мозку та використовували нокаутованих мишей MALS-3 (рис. S1, доступний за посиланням http://www.jcb.org/cgi/content/full/jcb.200503011/DC1) як потужний контроль. У імунопреципітації MALS-3 була присутня серія білкових смуг, які відсутні в опадах з нокаутів MALS-3. Було виявлено кілька відомих компонентів комплексу MALS-3, включаючи нейрексин, КАСКІН, NMDA-рецептор 2B, Mint-1 та PALS-1, який є білком, асоційованим з lin-7 (рис. 1 A). Фарбування сріблом імунопреципітатів показало специфічні смуги при 140, 120 та 105 кД (рис. 1 А). Мас-спектрометрія показала, що смуга 105 кД відповідає CASK, смуга 120 кД відповідає SAP-97, а смуга 140 кД містила монетний двір-1, а також ліприн-α2, -α3 та -α4 (рис. . 1 А). Вестерн-блот підтверджує ефективну коімунопреципітацію CASK, монетного двору-1 та ліпріну-α1 та -α2 (рис. 1 Б).
Ідентифікація нейронального білкового комплексу, що містить MALS та ліприн-α. (A) Імунопреципітація MALS-3 з екстрактів мозку показала низку смуг в гетерозиготі (H), які відсутні у нокауті MALS-3 (K). Смуги були ідентифіковані за допомогою МС/МС, отриманих за допомогою джерела мікроіон-розпилювача, приєднаного до мас-спектрометра (червоний) і підтверджений Вестерн-блот (чорний). Молекулярні ваги представлені синім кольором, а продукти розкладу монетного двору-1 позначені зірочками. (B) Вестерн-блоттінг гетерозигот та нокаутуючих екстрактів мозку, імунопреципітованих для MALS-3, демонструє специфічну асоціацію CASK, Mint-1, liprin-α1 та -α2 з MALS-3. (C) Вестерн-блоттінг показує, що MALS-3, CASK та ліприн-α2 високо збагачені синаптофізином (Synphy) у фракції синаптосоми (Syn) та PSD-95 у фракціях PSD. (D та E) Культури гіпокампа (28 DIV) фарбували на MALS, ліприн-α2 та синаптофізин. Імуноофарбовування показує, що як ліпрін-α2 (D), так і синаптофізин (Е) частково колокалізуються з MALS (наконечники стрілок). Брусок, 20 мкм.
Взаємодія ліприну-α із комплексом MALS
Мутанти ліпріну-α у D. melanogaster (та мутанти syd у C. elegans) виявляють порушений екзоцитоз синаптичних пухирців. Наше відкриття, що ліприн-α зв’язується з комплексом MALS – CASK, є новим. Відповідно до цього, MALS, CASK та ліприн-α2 збагачувались синаптичними біохімічними фракціонуваннями екстрактів мозку (рис. 1 С). Крім того, MALS частково колокалізувався ліприном-α2 та пресинаптичним маркером синаптофізином у культивованих нейронах гіпокампа (рис. 1, D та E).
Білки Liprin-α містять збережені ділянки спіральної спіралі, три домени SAM та COOH-кінцеву область, яка зв'язується з певними доменами PDZ (рис. 2 B). Використовуючи аналіз імунопреципітації та двогібридну систему дріжджів, ми виявили, що MALS-1 безпосередньо не зв’язується з ліприном-α2 (рис. 2, A [вгорі ліворуч і C). Тому ми запитали, чи можуть інші основні компоненти комплексу MALS безпосередньо асоціюватися з ліприном-α2. Дійсно, CASK, але не Монетний двір-1, безпосередньо зв’язаний з ліприном-α2 (рис. 2 А, внизу зліва та вгорі праворуч). Крім того, ми виявили, що CASK може пов'язувати ліпрін-α2 з комплексом MALS-1 (рис. 2 А, внизу праворуч). Ці біохімічні асоціації також переспрямовують розподіл білка в трансфікованих клітинах, і всі три ізоформи MALS можуть асоціюватися з CASK, утворюючи комплекси MALS – CASK – liprin-α (рис. 1 та and2; 2; неопубліковані дані).
Доменне відображення взаємодії MALS – ліпрін-α. (A) CASK, але не MALS-1 або Mint-1, коімунопреципітований ліприн-α2 у трансфікованих клітинах COS. У присутності CASK MALS коімунопреципітований ліприн-α2. (B) Схеми, що представляють структурні домени MALS-3 (синій), CASK (помаранчевий) та liprin-α2 (жовтий). (C) За допомогою двогібридного аналізу дріжджів CASK, але не MALS-3, взаємодіяв з ліприном-α2. Для зв'язування CASK – ліприн-α домену SAM1 ліприну-α2 достатньо для взаємодії з CASK. І CaMK-подібний домен, і перший домен L27 CASK були необхідними для зв'язування з ліприном-α2.
Для визначення місця взаємодії між ліприном-α2 та CASK ми використовували двійкову гібридну систему. Ми виявили, що повна довжина CASK легко зв’язується з повним зрістом ліприн-α2 (рис. 2 С). Це зв'язування було опосередковано спеціально першим доменом SAM у ліприн-α2. Делеційний аналіз CASK показав, що для зв'язування необхідні CAM-кіназа (CaMK) та перший домен L27 CASK. Нам не вдалося додатково зіставити цю взаємодію, припускаючи, що для належного згортання домен зв'язування може вимагати великих послідовностей.
Цілеспрямоване порушення MALS-3 та розведення мишей з дефіцитом MALS
Щоб вивчити суттєву роль MALS у цьому комплексі, ми спрямували на порушення MALS-3. Наш вектор націлювання замінив екзони 3, 4 і 5 MALS-3 касетою неоміцину (рис. S1, A – C). Після цілеспрямованого руйнування в ембріональних стовбурових клітинах ми генерували мишей з дефіцитом MALS-3. Мутантні миші MALS-3 народились за очікуваним менделівським співвідношенням і не виявили явних поведінкових відхилень. Вестерн-блоттінг показав повну відсутність білка MALS-3 у нокауті (рис. S1 D). Гістологічний огляд головного мозку не показав грубих анатомічних відхилень. Як повідомлялося раніше (Misawa et al., 2001), MALS-3 дифузно зустрічається у численних нейрональних популяціях мозку (рис. S1 E). Крім того, експресія MALS-3 регулюється вгору, особливо в області зубчастих звивин гіпокампу, у мишей з подвійним нокаутом MALS-1/2 (рис. S1 E).
Ми вивели мишей-нокаутів MALS-3 з раніше створеними мутантами MALS-1/2, що дало 27 можливих генотипів. Ці генотипи сполук представлені на рис. 3 А. Ми виявили, що більшість мишей, у яких відсутня як MALS-1, так і -3, загинули незабаром після народження, тоді як миші без MALS-1 та -2 були життєздатними та фертильними. Миші, у яких не було MALS-2 та -3 та гетерозиготні по MALS-1, загинули протягом другого післяпологового тижня. Нарешті, миші, у яких відсутні всі три ізоформи MALS, виявляли нерегулярне, важке дихання і помирали протягом однієї години після народження. Повна відсутність MALS не пов'язана з ембріональною летальністю, оскільки передбачуване менделівське співвідношення плодів було виявлено, коли кесарів розтин проводився в ембріональний день 18 (рис. 3 Б).
Покоління мишей, у яких відсутні всі три ізоформи MALS. (А) Генотипування ПЛР мишей MALS. Поодинока зірочка вказує на мишей, які загинули протягом декількох годин після народження, а подвійна зірочка позначає лінію, яка загинула протягом другого тижня після пологів. (B) Статистика, отримана при схрещуванні мишей MALS-1/2 K та MALS-3 H. Генотипування 2-тижневих мишей не показало мишей TKO. Однак ембріональні миші (E18) показали передбачуване співвідношення мишей W, H та K.
Порушення комплексу MALS – CASK – liprin-α
Миші MALS з потрійним нокаутом (TKO) здаються анатомічно нормальними при народженні; однак їх перинатальна смерть та утруднене дихання свідчать про неврологічний дефіцит. Щоб оцінити, чи виявляють компоненти комплексу MALS або інших синаптичних білків кількісні відмінності експресії, ми провели вестерн-блоттінг у мишей MALS TKO порівняно з мишами-нокаутами MALS-1/2, які були фенотипово нормальними або дикого типу (WT). Ми виявили, що рівні CASK різко знижуються у MALS TKO, тоді як рівні всіх інших аналізованих синаптичних білків були нормальними у мишей TKO (рис. 4, A та B). Ми також виявили, що синаптична локалізація CASK, але не інших синаптичних маркерів, була частково порушена в культурах нейронів TKO (рис. 4, C та D).
Експресія CASK знижується у мишей з дефіцитом MALS. (А) Мозок мишей Е18 отримував імуноблотинг на численні синаптичні білки. (B) CASK був помітно знижений (31% контролю ± 8; *, P 90% нейронів були інфіковані, і ні вірус, ні GFP не впливали на розподіл MALS (рис. 5 A). Однак експресія ліпріну домінантно-негативна (GFP-SAM) неправильно спрямував MALS на несинаптичні ділянки та суттєво порушив синаптичну локалізацію MALS (рис. 5 B). Ці результати свідчать про те, що ліприн-α перебувають вище від MALS і можуть функціонувати, принаймні частково, завдяки їх взаємодії з MALS– CASK комплекс.
- IPhone 6 для схуднення у вересні; Партнери каналу
- Останній випуск Китайських добавок до таблеток для схуднення - Глобальне дослідження Великобританії
- Луїза в DUNGANNON, діловий комплекс Ballysaggart - Данганнон, графство Тайрон, для схуднення
- Кремль наказав Білорусі звільнити передбачуваних російських найманців
- Мультимодальна сигналізація в малій потоковій жабі (Micrixalus saxicola) в складній акустиці